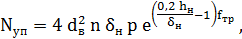Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Запасы урана и основные его месторождения в РоссииСтр 1 из 9Следующая ⇒
Содержание
Введение Целью данной курсовой работы является исследование процесса активации – подготовка к выщелачиванию упорных урансодержащих руд растворами бифторида аммония. Возрастающая потребность в России в ядерном топливе требует увеличения добычи урана. С связи с этим разрабатываются новые месторождения, такие как Эльконское на юге Якутии. Оно является одним из самых крупнейших месторождений в мире. Но основное количество урана ассоциировано с браннеритом, который практически не растворим в содовых растворах, очень устойчив и трудно растворим в серной кислоте. За счет высокого содержания кварцевого концентрата. Для этого требуется высокая кислотность растворов кислоты, а это достаточно не экономично. Поэтом требуется применение новых эффективных технологий. Например использование фтораммониевой технологии с применением бифторида аммония. Данный реагент приводит к разложению силикатов, с образованием фтораммониевых комплексных солей. А также данный реагент легко регенерируется и возвращается в голову процесса.
Задачами работы является расчет материальных и тепловых потоков, расчет основного аппарата, а также рассмотреть вопросы безопасности и экологичности процесса. Аналитический раздел Руды и минералы урана Уран широко распространен в природе. В довольно значительных концентрациях он обнаружен во многих горных породах, океанах и морях, в лунном грунте, в метеоритах. Почти повсеместное присутствие урана объясняется высокой химической активностью, хорошей растворимостью его солей, способностью принимать участие в разнообразных химических реакциях и образовывать соединения со многими другими элементами. Среднее содержание урана в земной коре составляет (2 – 4)⋅10–4 %, т.е. в 1 тонне содержится около 3 грамм урана. Содержание урана в мантии земли примерно 10–6 %. Всего в относительно тонком 20-километровом слое земной коры содержится около 1014 т урана. В различных породах земной коры содержание урана неодинаково. Более богаты ураном кислые изверженные породы с высоким содержанием кремнезема SiO2. В настоящее время известно около 150 минералов, включающих уран как основной компонент, и еще около 50 других минералов, содержащих незначительные количества урана в качестве примесей. Урановые минералы можно разделить на две большие группы – первичные и вторичные. Первичными называются минералы, образовавшиеся при формировании земной коры (как правило, магматического происхождения). Вторичные минералы – те, которые образовались на более поздних стадиях под действием природных факторов. Таблица 1 – Важнейшие минералы урана
Уран в рудах может входить в состав урановых минералов, но может образовывать значительные скопления в залежах фосфатов, залежах лигнитов (лигнит – каменный уголь низкого качества, промежуточная форма между торфом и бурым углём, структура сохраняет структуру дерева) или монацитовых песков.
Наряду с ураном эти руды содержат золото, которое и является основным объектом промышленной добычи. Кроме золота, из урановых минералов извлекают медь, титан, тантал, ванадий и ряд редкоземельных металлов. 12% мирового выпуска урана приходится на производства, где уран извлекается в качестве побочного продукта. По условиям образования среди урановых руд различают: · эндогенные руды, отложившиеся при повышенных температурах и давлениях из пегматитовых расплавов и водных (предположительно постмагматических) растворов, характерны для складчатых областей и активизированных платформ; · экзогенные руды, сформировавшиеся в близкоповерхностных условиях и на поверхности Земли в процессе осадконакопления (сингенетические руды) или в результате циркуляции грунтовых вод (эпигенетические руды), связаны преимущественно с молодыми платформами. По размерам зёрен урановых минералов выделяются: · крупнозернистые урановые руды (свыше 25 мм в поперечнике), · среднезернистые (3–25 мм); · мелкозернистые (0,1–3 мм); · тонкозернистые (0,015–0,1 мм); · дисперсные (менее 0,015 мм). Размеры агрегатов и зёрен урановых минералов определяют возможность механического обогащения руд. По химическому составу нерудной составляющей среди урановых руд различают: · силикатные (в основном из силикатных минералов); · карбонатные (более 10–15% карбонатных минералов); · железоокисные, представляющие собой железо-урановые руды; · сульфидные, содержащие более 8–10% сульфидных минералов; · каустобиолитовые, состоящие в основном из органического вещества. Химический состав руд часто имеет решающее значение при выборе способа их переработки. Так, например, из силикатных руд уран выщелачивается кислотами, из карбонатных – содовыми растворами; железо-окисные руды подвергаются доменной плавке, при которой уран концентрируется в шлаках; каустобиолитовые урановые руды иногда обогащаются путём их сжигания и т.д. По содержанию урана выделяются 5 сортов руд: · очень богатые руды (свыше 1% урана); · богатые (1–0,5%); · средние (0,5–0,25%); · рядовые (0,25–0,1%); · бедные (менее 0,1%). В качестве побочного продукта уран извлекается из руд, содержащих 0,01–0,015% урана (например, из золотоносных конгломератов Витватерсранда, ЮАР) и даже 0,006–0,008% (фосфориты Флориды, США). Основными технологическими характеристиками урановых руд являются: · химический состав нерудной составляющей (вмещающей породы); · «контрастность» руды; · крупность зёрен урановых минералов и их агрегатов. Химический состав нерудной составляющей играет решающее значение при выборе способа их химической переработки. Из силикатных руд уран выщелачивают кислотами; из карбонатных – содовыми растворами; сульфидные руды предварительно подвергают обжигу; железо-окисные руды подвергают переплавке, а затем уран выщелачивают из шлака и т.д. Другой важной характеристикой урановых руд является «контрастность» – степень неравномерности содержания урана в кусковой фракции горной массы. По «контрастности» руды подразделяются: · «контрастные» – смесь богатых штуфов, содержащих основную массу урана и породы с низким содержанием урана, содержание урана в штуфах превышает в десятки раз среднее содержание урана во всей горнорудной массе;
· «слабоконтрастные» – руды с более или менее равномерным распределением урана по всей горнорудной массе; могут быть руды с небольшим превышением урана в штуфах (в 3 – 5 раз). «Контрастность» руд играет важную роль при выборе метода их обогащения: «контрастные» руды обогащают исключительно радиометрическим методом; для «слабоконтрастных» руд радиометрический метод обогащения непригоден, их обогащают либо гравитационным, либо флотационным методом. Размеры зёрен и агрегатов определяют, в основном, степень измельчения руд при их обогащении и гидрометаллургической переработке.
Выщелачивания урановых руд Выщелачивание – это процесс перевода в раствор одного или нескольких компонентов твердого вещества с помощью водного или органического растворителя, часто в присутствии окислителей и восстановителей. В гидрометаллургических схемах переработки рудного сырья выщелачивание обычно проводят после измельчения руды и ее обогащения. Иногда перед выщелачиванием руды и концентраты обжигают в окислит. атмосфере (на воздухе) или в присутствии добавок (CaO, CaSO4, H2SO4, сульфатов, хлоридов, фторосиликатов и др.), что способствует вскрытию минералов и переводу их в иные, легкорастворимые химические соединения. Вслед за выщелачиванием проводят разделение жидкой и твердой фаз путем отстаивания, фильтрации и другими методами. Целью выщелачивания является избирательное растворение минералов урана. Способы выщелачивания: 1) Карбонатное (содовое); 2) Кислотное. Выбор способа выщелачивания зависит от: 1) Типа урановых минералов; 2) Размера урановых минералов; 3) Состава пустой породы. Руды урана: · Первичные (4 валентный уран) – используется кислотное выщелачивание с окислителем; · Вторичные (6 валентный уран) – используется как кислотное так и содовое выщелачивание. Минералы урана: · 1 группа (черни, ванадаты, фосфаты, арсенаты) – легко растворяются без окислителя, поэтому используется карбонатный и кислотный способы; · 2 группа (уранинит, настуран, различные смолки) – растворяются с добавкой окислителя, используются также оба способа; · 3 группа (браннерит, давидит) – являются труднорастворимыми, поэтому используется только кислотное выщелачивание.
Состав пустой породы: · 1 тип (нерастворимые: силикатные породы, граниты) – используется оба типа выщелачивания; · 2 тип (растворимы в кислых растворах: карбонаты, фосфаты, слюды, биотиты) – используется карбонатный способ; · 3 тип (растворимы в карбонатных растворах: сульфиды) – применяют кислотный способ. Основная масса урана из добываемых руд выщелачивается серной кислотой. Основным недостатком серной кислоты при вскрытии урановых руд является необходимость добавления окислителя. В качестве окислителя можно применять HNO3, MnO2, KClO3 и др. Чаще всего в промышленной практике применяют очищенный природный минерал пиролюзит (MnO2). При выщелачивании урана из руд, содержащих минералы группы уранинита – настурана, серной кислотой в присутствии MnO2 протекает следующая реакция: U3O8 + 4H2SO4 + MnO2 → 3UO2SO 4 + MnSO4 + 4H2O. Наряду с простым сульфатом в кислой среде образуются комплексные сульфатные анионы уранила [UO2(SO4)2]2– и [UO2(SO4) 3]4–. Простой сульфат существует в растворах, при pH>2. Константа устойчивости простого сульфата К = 50. Дисульфатный комплекс уранила образуется в растворах при рН =1..2. Константа устойчивости этого комплекса К = 350. Трисульфатный комплекс образуется при рН меньше единицы, т.е. в сильнокислых средах. В процессе выщелачивания урана из кремнистых руд при повышенных температурах примерно 1 % кремнезёма вскрывается серной кислотой с образованием труднофильтрующейся кремневой кислоты, что в значительной степени затрудняет дальнейшую переработку пульп и растворов: SiO2 + H2SO4 → H2SiO 3. Глинозём в количестве 3 – 5 % от исходного количества переходит в раствор в виде хорошо растворимого сульфата алюминия Al2(SO4)3: Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O. Железо в рудах может содержаться в виде оксидов или карбонатов. Из оксидов железа в серной кислоте легко растворяется Fe2O3 , труднее Fe3O4. Карбонат железа FeCO3 легко растворяется. В присутствии окислителя двухвалентное железо окисляется до трёхвалентного: 2FeSO4 + 2H2SO4 + MnO2 → Fe2(SO4)3 + MnSO4 + 2H2O. Таким образом, в пульпе железо будет присутствовать в виде Fe2(SO4)3 . Растворимость Fe2(SO4)3 вследствие гидролиза ограничена. В горячей воде растворимость не превышает 5 – 7 г/л, поэтому при большем содержании железа оно будет выпадать в осадок в виде Fe(OH)3: Fe2(SO4)3 + 3H2O → 2Fe(OH)3 ↓ + 3H2SO4. При выщелачивании других типов руд (фосфатных, ванадатных) фосфор, ванадий и другие элементы количественно переходят в раствор.
Таблица 4 – Химический состав исследуемой пробы руды
Браннерит - хрупкий материал с сильным смолистым блеском и раковистым изломом. Цвет его, в зависимости от степени изменения, варьирует от черного и коричневого разных оттенков до медово-желтого. Отличительной особенностью месторождения браннеритовых руд является то, что в результате последующих галогенных процессов и брекчирования, в том числе - образования поздних карбонатных брекчий,имело место интенсивное разложение браннерита с выносом основных составляющих его компонентов (урана и титана).
Внешне в процессе окисления браннерит теряет черную окраску. Вначале он становится менее плотным, постепенно теряет свой характерный, жирный блеск, меняет показатель преломления. Химические анализы браннеритов и продуктов его изменения (Белова,1964) показывают, что в процессе окисления четырехвалентный уран, характерный для не окисленного браннерита, превращается в шестивалентный, отношение же U к Тi до определенного момента остается более или менее постоянным, т.е. минерал, видимо, не распадается; затем уран начинает выноситься энергичнее, а вынос титана замедляется. По данным электронномикроскопического исследования браннерит в процессе окисления претерпевает сложные превращения, следствием которых является образование новых кристаллических фаз. На ранних стадиях изменения образуются продукты естественной раскристаллизации метамиктного браннерита - рутил (Тi02) и фаза UO2(тонкодисперсный уранинит), а также фаза "X" (U+6Ti2O7). Интенсивно измененный браннерит - медово-желтый - сложен реликтовыми кристаллами браннерита, аморфным веществом с реликтамикристаллов UO2 и включениями TiO2 в виде анатаза. Конечные продукты изменения браннерита - охристые, желто-окрашенные руды - состоят в основном из анатаза с тонкодисперсно рассеянным по его поверхности ураном, минеральную форму нахождения которого установить не удалось. Вышеописанные изменения связаны с окислением браннерита, в основном, в процессе наложения на него карбонатных брекчий. В случае развития по браннериту метасоматического рисовидного кварца, минерал, интенсивно разрушаясь, остается в массе кварца в виде реликтов. Местами окварцевание сопровождается переотложением браннерита с образованием призматических удлиненных кристаллов типа щеток, растущих на колломорфных выделениях браннерита.
Технологический раздел Расчетный раздел Материальный баланс 3.2.1 Материальный баланс процесса фторирования (материальный баланс основного аппарата) Материальный расчет основывается на законе сохранения материи, в данном случае - массы веществ, с учетом условий равновесия, определяемых термодинамикой процесса и ею макрокинетикой:
Gруды = 700000 т/год = 1917,8 т/сут Руда поступает в аппарат в виде пульпы. Пройдя стадию измельчения, классификации и сгущения в пульпе находится 50% воды от массы руды. Определим сколько воды в пульпе: 1917,8 т – 100% Х – 50% Отсюда
Gразб1 = 958,9 т/сут В сухой руде CSiO2 = 57,55%. Тогда получим:
Степень фторирования руды α = 10%. Тогда
Реакция, протекающая в аппарате: SiO2 + 3NH4F·HF = (NH4)2SiF6 + 2H2O + NH3 М 60 57 178 18 17 По реакции определим массы всех компонентов. Определим массовый расход БФА (сухого):
Концентрация БФА СБФА = 10%. Т.к. руда подается с водой и для того, чтобы в аппарате не было слишком много воды, мы приготовим раствор БФА более крепкий, чтоб та вода, которая подается с рудой разбавляла раствор БФА до нужной нам концентрации. Рассчитаем массу воды необходимая для разбавления БФА до 10%:
Рассчитаем концентрацию БФА, которую можно получить при разбавлении этой водой:
Концентрация БФА СБФА = 15%. Определим массовый расход ГФСА:
Массовый расход аммиака:
Массовый расход воды (по реакции):
Массовый расход руды после реакции:
На основании расчета материальных потоков составим таблицу материального баланса (таблица 9).
Таблица 9 – Материальный баланс процесса
Поскольку материальный баланс сошелся, значит, расчеты реакции были произведены, верно.
Тепловая нагрузка аппарата Тепловая нагрузка аппарата определяется на основании теплового баланса. В общем виде тепловой баланс запишется уравнениями:
Так как все теплоемкости даны в Дж/(моль∙К) то полученные теплоты необходимо будет разделить на молярную массу. Также нам необходимо все массы перевести из т/сут в кг/сек (таблица 14). Таблица 14 – Массовые расходы веществ
Определим количество тепла, вносимое в аппарат с исходными веществами и теплоносителем:
Чтоб аппарат не перегрелся, компенсируем тепло химической реакции:
Определим количество тепла, уносимое из аппарата продуктами, идущее на нагрев аппарата и теряемое в окружающую среду:
Определим расход пара
Отсюда расход пара равен:
Определим тепло конденсата:
Определим тепло воды, которая образуется при конденсировании острого пара:
Определим тепло потерь:
Результаты теплового баланса сведены в таблицу 15.
Таблица 15 – Тепловой баланс процесса
Конструктивный расчет Определение объема аппарата При заданной производительности процесса рабочий объем аппаратов [12] определяют по формуле:
Определим объем одного аппарата, используя формулу:
Выразим из формулы (1) объем одного аппарата и получим:
Расчет мешалки После выбора и расчета основных размеров мешалки определяется мощность, потребляемая на перемешивание, для чего используются критериальные уравнения мощности
Отсюда
Согласно [1] Расчетная мощность, потребляемая на перемешивание жидкости, определяется по формуле:
Тогда
Мощность привода мешалки рекомендуется рассчитывать по формуле:
Коэффициент, учитывающий высоту уровня жидкости, находится в соответствии с [7]:
Отсюда
Выбираем сальниковые уплотнения [7], используемые при герметизации до 0,6 МПа. Мощность, затрачиваемая на преодоления трения в уплотнениях вала мешалки [7], находится по формуле:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-17; просмотров: 201; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.125.171 (0.17 с.) |
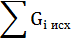
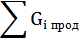











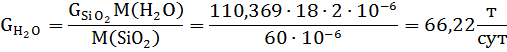






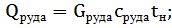
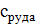
 при t=25°С;
при t=25°С;


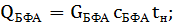

 при t=25°С;
при t=25°С;



 при t=25°С;
при t=25°С;



 ;
;

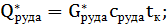
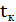

 ;
;

 при Р=0,1МПа;
при Р=0,1МПа;

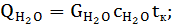 ;
;
 при t=80°С;
при t=80°С;

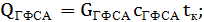

 при t=80°С;
при t=80°С;


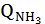


 ,
,  при t=80°С;
при t=80°С;















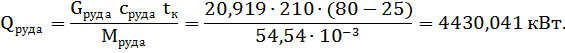








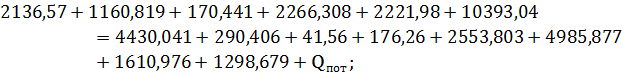
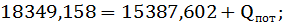
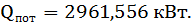


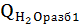




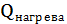
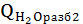





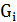
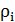

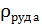
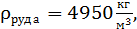 при t=80°C;
при t=80°C;

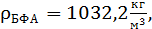 при t=80°C;
при t=80°C;
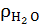
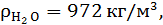 при t=80°C.
при t=80°C.










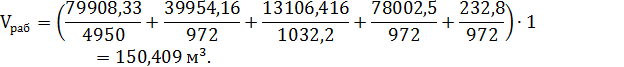





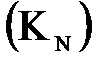 от модифицированного критерия Рейнольдса
от модифицированного критерия Рейнольдса  и конструктивных особенностей перемешивающего устройства.
и конструктивных особенностей перемешивающего устройства.


 кг/м3;
кг/м3;



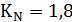 .
.


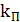
 для аппарата без перегородок [7];
для аппарата без перегородок [7];

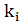
 [7];
[7];

 [7];
[7];