
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Молекулярная физика и термодинамика.Стр 1 из 4Следующая ⇒
Молекулярная физика и термодинамика.
История атомистических учений. Наблюдения и опыты, подтверждающие Атомно- молекулярное строение вещества. Масса и размеры молекул. Постоянная Авогадро. Все тела состоят из частиц – атомов и молекул. Современные приборы(электронный микроскоп, ионный проектор) позволяют видеть отдельные атомы и молекулы. Эти частицы находятся в непрерывном хаотическом (тепловом) движении Опытные доказательства – диффузия и броуновское движение Диффузия – взаимное проникновение молекул одного вещества в промежутки между молекулами другого вещества. Диффузию можно наблюдать для газообразных, жидких и твердых тел. Примеры:
Экспериментальное исследование броуновского движения – Жан Перрен. Траектория броуновской частицы.
3. Частицы взаимодействуют друг с другом силами притяжения и отталкивания. Опытные доказательства – существование твердых, жидких и газообразных тел; существование силы трения; усилие, необходимое для сжатия любого тела; существование объемных тел. Масса и размер молекул. Постоянная Авогадро Определения m – масса всего вещества, кг p – давление, Па V- объем всего вещества, м3 . 1л= 10-3 м3 N – чис ло всех молекул в веществе ρ =m/V – плотность вещества, кг/м3. 1 г/см3 = 106 кг/м3 n= N/V – конце нтрация молекул, или число молекул в единице объема. 1/м3=м-3 m0 – масса одной молекулы Количество веществаν («ню») пропорционально числу частиц. Единица измерения количества вещества - моль Моль равен количеству вещества системы, содержащей столько же частиц, сколько содержится атомов в 0,012 кг углерода. Постоянная Авогадро - количество молекул в одном моле вещества
Если известно количество вещества (число молей ν), то число молекул N во всем веществе
Количество вещества можно найти как отношение числа атомов или молекул вещества к постоянной Авогадро:
Молярной массой называется величина, равная массе одного моля данного вещества:
Зная молярную массу, можно посчитать количество вещества:
Значения молярной массы, выраженные в г/моль, приведены в таблице Менделеева. Например, молярная масса атома водорода (H) равна 1 г/моль, молекулы водорода (H2) 2 г/ моль, молекулы углекислого газа (CO2 )12+32=44 г/моль, молекулы воды (H2O) 2+ 16=18 г/моль.
Масса молекул
Для определения массы одной молекулы m0 нужно разделить массу вещества на число молекул в нем
Посчитаем массу одной молекулы воды:
Давление идеального газа Причина давления идеального газа на стенки сосуда заключается в том, что молекулы при столкновениях со стенками сосуда взаимодействуют с ними по законам механики как упругие тела.
Если подсчитать импульс, переданный одной молекулой, умножить на число соударений и разделить на время наблюдения, мы получим давление газа на стенку сосуда.
Результат называется основным уравнение МКТ.
справедливо также уравнение
Уравнения изопроцессов
Изотермический
Для двух состояний газа p1V1= p2V2
Изобарный
Для двух состояний газа
Изохорный
Для двух состояний газа
Плавление и кристаллизация Плавлением называется процесс превращения твердого тела в жидкость. Кристаллизацией называется превращение жидкости в твердое тело. Для того, чтобы тело расплавилось, ему нужно передать некоторое количество теплоты Q. Эта энергия расходуется на разрыв прочных связей кристаллической решетки твердого тела. В процессе плавления температура тела не меняется до тех пор, пока все оно не превратится в жидкость. Для каждого тела существует строго определенная температура плавления.
При кристаллизации тело отдает тепло окружающим телам. Плавление и кристаллизация данного вещества происходят при одной и той же температуре. Например, 0 оС – это температура, при которой плавится лед, если получает тепло, или кристаллизуется вода, отдавая при этом тепло.
Для того, чтобы полностью расплавить данное тело при температуре плавления, необходимо затратить количество теплоты, равное Q= λm, где m – масса тела λ – удельная теплота плавления данного вещества Удельной теплотой плавления λ называется количество теплоты, необходимое для того, чтобы превратить 1 килограмм данного вещества, взятого при температуре плавления, в жидкость при той же температуре. Размерность удельной теплоты плавления Дж/(кг) Парообразование и конденсация Парообразованием называется процесс превращения вещества из жидкого состояния в газообразное. Конденсация– это процесс, превращения пара в жидкость. Парообразование происходящее с открытой поверхности жидкости, называется испарением. Испарение жидкости происходит при любой температуре. При испарении наиболее быстрые молекулы покидают поверхность жидкости и переходят в пар. При испарении внутренняя энергия вещества уменьшается (остывание чая в стакане). Кипением называется парообразование, происходящее по всему объему жидкости. Для данной жидкости кипение происходит при определенной температуре, которая называется температурой кипения. Например, при нормальном атмосферном давлении температура кипения воды равна 100 оС Температура кипения жидкости уменьшается при уменьшении атмосферного давления.
Удельной теплотой парообразования r называется количество теплоты, необходимое для того, чтобы полностью превратить в пар 1 кг данной жидкости при постоянной температуре. Количество теплоты, необходимое для полного испарения данной массы жидкости при тепературе кипения, равно Q = rm При конденсации пара такое же количество теплоты передается окружающим телам. В закрытом сосуде жидкость и ее пар могут находиться в состоянии динамического равновесия, когда число молекул, вылетающих из жидкости, равно числу молекул, возвращающихся в жидкость из пара, т. е. когда скорости процессов испарения и конденсации одинаковы. Влажность воздуха В атмосферном воздухе всегда присутствуют пары воды при некотором парциальном давлении p, которое меньше или равно давлению насыщенного пара p 0. Парциальное давление p водяного пара в воздухе называется абсолютной влажностью воздуха. Относительной влажностью воздуха
Если парциальное давление водяного пара в воздухе равна давлению насыщенного пара, относительная влажность равна 100%.
Первый закон термодинамики Первый закон термодинамики является законом сохранения энергии, распространенным на тепловые явления. Внутренняя энергия может изменяться двумя способами: теплопередачей и совершением работы. В общем случае внутренняя энергия изменяется как за счет теплопередачи, так и за счет совершения работы.
Формулировка закона: Первый закон термодинамики
Рис. 2 Первый закон термодинамики (первое начало термодинамики) утверждает, что внутренняя энергия определяется только состоянием системы, причем изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе: D U = A внешн + Q Если при нагревании газ расширяется и при этом совершает работу A, то первый закон термодинамики можно сформулировать по-другому: Q = D U + A Количество теплоты, переданное газу, равно сумме изменения его внутренней энергии и работы, совершенной газом. Работа газа и работа внешних сил вследствие 3-го закона Ньютона равны по модулю и имеют противоположный знак: A внешн = – A
КПД теплового двигателя Коэффициентом полезного действия η тепловой машины называется отношение работы A к количеству теплоты Q 1, полученному рабочим телом за цикл от нагревателя:
Коэффициент полезного действия η указывает, какая часть тепловой энергии, полученной рабочим телом от нагревателя, превратилась в полезную работу. Остальная часть (1 – η) была «бесполезно» передана холодильнику. Коэффициент полезного действия тепловой машины всегда меньше единицы (η < 1).
Первый закон термодинамики не устанавливает направления тепловых процессов. Однако, как показывает опыт, многие тепловые процессы могут протекать только в одном направлении. Такие процессы называются необратимыми. Например, при тепловом контакте двух тел с разными температурами тепловой поток всегда направлен от более теплого тела к более холодному. Никогда не наблюдается самопроизвольный процесс передачи тепла от тела с низкой температурой к телу с более высокой температурой. Следовательно, процесс теплообмена при конечной разности температур является необратимым. Обратимыми процессами называют процессы перехода системы из одного равновесного состояния в другое, которые можно провести в обратном направлении через ту же последовательность промежуточных равновесных состояний. При этом сама система и окружающие тела возвращаются к исходному состоянию. Необратимыми являются процессы превращения механической работы во внутреннюю энергию тела из-за наличия трения, процессы диффузии в газах и жидкостях, процессы перемешивания газа при наличии начальной разности давлений и т. д. Все реальные процессы необратимы, но они могут сколь угодно близко приближаться к обратимым процессам. Обратимые процессы являются идеализацией реальных процессов.
Общим свойством всех необратимых процессов является то, что они протекают в термодинамически неравновесной системе и в результате этих процессов замкнутая система приближается к состоянию термодинамического равновесия.
Первый закон термодинамики не может отличить обратимые процессы от необратимых. Он просто требует от термодинамического процесса определенного энергетического баланса и ничего не говорит о том, возможен такой процесс или нет. Направление самопроизвольно протекающих процессов устанавливает второй закон термодинамики. Он может быть сформулирован в виде запрета на определенные виды термодинамических процессов. Немецкий физик Р. Клаузиус дал другую формулировку второго закона термодинамики: Невозможен процесс, единственным результатом которого была бы передача энергии путем теплообмена от тела с низкой температурой к телу с более высокой температурой.
Молекулярная физика и термодинамика.
|
|||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-17; просмотров: 251; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.240.243 (0.058 с.) |
 Броуновское движение – тепловое движение взвешенных в газе или жидкости частиц. Обнаружил английский ботаник Роберт Броун в 1827 году. Причина броуновского движения частицы заключается в том, что удары молекул жидкости о частицу не компенсируют друг друга.
Броуновское движение – тепловое движение взвешенных в газе или жидкости частиц. Обнаружил английский ботаник Роберт Броун в 1827 году. Причина броуновского движения частицы заключается в том, что удары молекул жидкости о частицу не компенсируют друг друга.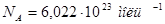
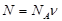
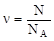

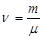
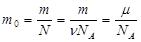

 По закону сохранения импульса в результате упругого удара каждая молекула передает стенке импульс, следовательно, на стенку со стороны молекул действует сила.
По закону сохранения импульса в результате упругого удара каждая молекула передает стенке импульс, следовательно, на стенку со стороны молекул действует сила.
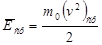 Поскольку среднее значениекинетической энергии поступательного движения молекул идеального газа:
Поскольку среднее значениекинетической энергии поступательного движения молекул идеального газа:






 называют отношение парциального давления
называют отношение парциального давления  водяного пара, содержащегося в воздухе при данной температуре, к давлению
водяного пара, содержащегося в воздухе при данной температуре, к давлению  насыщенного пара при той же температуре, выраженное в процентах:
насыщенного пара при той же температуре, выраженное в процентах:





