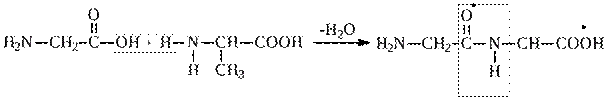Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Классификация протеиногенных аминокислот
Существует несколько классификаций протеиногенных аминокислот, в основу которых положены разные критерии. Рассмотрим лишь некоторые из них: 1. Классификация по электрохимической природе радикала (R): а) неполярные аминокислоты (их 8) – гидрофобные (нерастворимые в воде): аланин (ала); валин (вал); лейцин (лей); изолейцин (иле); пролин (про); фенилаланин (фен); триптофан (три); метионин (мет); б) полярные аминокислоты (их 12) – растворяются в воде; в свою очередь они делятся на: - незаряженные (их 7): глицин (гли); серин (сер); треонин (тре); цистеин (цис); тирозин (тир); аспарагин (асп); глутамин (глн); - заряженные отрицательно (их 2): аспарагиновая кислота (асп); глутаминовая кислота (глу); - заряженные положительно (их 3): лизин (лиз); гистидин (гис); аргинин (арг). 2. Классификация по способности синтезироваться в организме человека и животных: а) незаменимые (не синтезируются в организме, поэтому должны поступать с пищей, их 8): валин, лейцин, изолейцин, триптофан, фенилаланин, метионин, треонин, лизин); б) заменимые (синтезируются в организме) – их 12. Биологическая роль аминокислот Помимо того, что аминокислоты являются структурными блоками белков, они используются в живых организмах для синтеза разнообразных веществ. Разные аминокислоты (как протеиногенные, так и непротеиногенные) являются предшественниками пептидов, азотистых оснований, гормонов, витаминов, нейромедиаторов, алкалоидов и других важнейших соединений. Так, например, из триптофана синтезируются витамин РР (никотиновая кислота) и серотонин, из тирозина – такие важные гормоны, как адреналин, норадреналин, тироксин. Из аминокислоты валин образуется витамин В3 (пантотеновая кислота). Аминокислота пролин является соединением, защищающим живые клетки от многих стрессов (в том числе, окислительного). Химические свойства. Химические свойства аминокислот определяются наличием в их структуре нескольких функциональных групп, в общем случае аминогруппы (свойства оснований), и карбоксильной группы (свойство кислот). Поэтому в реакциях аминокислоты способны проявлять как основные, так и кислотные свойства – это амфотерные соединения, реагирующие и с кислотами, и с основаниями. В результате образуются соответствующие соли:
В зависимости от кислотности среды аминокислоты в растворе существуют в одной из форм:
в щелочной среде в нейтральной среде в кислой среде Если в аминокислоте преобладают кислотные группы, то раствор аминокислоты имеет кислую реакцию. Растворы кислот с основными радикалами имеют щелочную реакцию. Аминокислоты способны в ступать в реакции как с участием аминогруппы, так и с участием карбоксильной группы., характерные для соответствующих классов соединений. Реакция по аминогруппе (взаимодействие с азотистой кислотой):
Оксикислота Взаимодействие со спиртами (реакция по карбоксильной группе) приводит к образованию сложных эфиров:
Взаимодействие аминокислот друг с другом с отщеплением воды и образованием продукта, в котором фрагменты связаны пептидной связью:
Пептидная связь Подобные соединения – продукты конденсации двух и более продуктов аминокислот – называют пептидами. Они относятся к классу амидов. Качественной реакцией на аминокислоты является образование окрашенных в сине – фиолетовый цвет продуктов с нингидрином (аминокислоты им окисляются):
Нингидрин Ароматические аминокислоты при нагревании взаимодействуют с концентрированной HNO3 (нитрируется бензольное кольцо), продукты окрашены в желтый цвет (ксантопротеиновая реакция).
Классификация белков В зависимости от химического состава белки делятся на 3 группы: 1. Простые белки построены из аминокислот и при гидролизе распадаются только на аминокислоты. Протамины и гистоны – содержат до 85% аргинина, поэтому имеют выраженные основные свойства. Белок сальмин, полученный из молок семги; клупеин – из молок сельди, скорее относятся к пептидам, т.к. имеют Mr не более 5000 Да. Протамины в основном являются белковой частью нуклеотидов (ДНК). Гистоны сосредоточены главным образом в ядре и представляют белковую часть РНК. Проламины и глютелины – белки растительного происхождения: зеин получают из кукурузы, глютенин - из пшеницы. Содержат до 25% глу, 10-15% про. Альбумины и глобулины – содержатся в сыворотке крови, молоке, яичном белке, мышцах и т.д. Это глобулярные белки, отличающиеся различной растворимостью (альбумины растворяются лучше), по Mr (альбумины имеют молекулярную массу, равную 69000 Да, глобулины - 150000Да).
2. Пептиды – это низкомолекулярные азотсодержащие соединения, состоящие из остатков аминокислот и имеющие молекулярную массу менее 5000 Да. а) с гормональной активностью (АКТГ, окситоцин, вазопрессин и др.); 3. Сложные белки или протеиды – состоят из двух частей: белковой и небелковой. Небелковую часть называют простетической группой, а белковую часть, утратившую простетическую группу, называют апобелком.
Подробно рассмотрим группу гемопротеидов – это Hb и его производное миоглобин (белок мышечной ткани), хлорофиллсодержащие белки и ферменты (цитохромы b, С, С1, каталаза, пероксидаза). Все они в качестве простетических групп содержат Fe (или Mg)–порфирины, а отличаются белковой частью.
Структуру гема впервые раскрыл Ненцкий, а его синтез провел Фишер. Фетальный HbF – в крови новорожденного содержится до 80%, к концу 1-го года жизни он почти полностью заменяется на HbA1. HbA состоит из 4 ППЦ: 2α–субъединиц и 2β–субъединиц. Четыре субъединицы или протомера ППЦ гемоглобина связаны друг с другом гидрофобными взаимодействиями. Молекула гемоглобина диссоциирует на два димера - αβ и α1β1. Каждый протомер содержит гем, находящийся в гидрофобной «нише», защищающей его от окисления в ферри-форму. Mr ППЦ гемоглобина равна 64458 (64500) Да.
В основе простетической группы Нb лежит протопорфирин, у которогоимеются: в положении 1,3,5,8-СН3– метильный R; в положении 2,4 СН1=СН– винильнный R; в положении 6,7 СООН–СН2–СН2 – остатки пропионовой кислоты. Железо, входящее в состав гемоглобина, имеет 2 ковалентные и 4 координационные связи; четыре связи образуют связи с атомами азота, пятая координационная связь присоединяет кислород к гему, шестая – связывает гем и ППЦ.
|
||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-17; просмотров: 1870; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.21.34.0 (0.011 с.) |