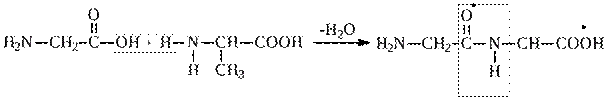Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Общая характеристика белков и аминокислот.Стр 1 из 3Следующая ⇒
Общая характеристика белков и аминокислот. Строение, классификация и свойства аминокислот Белки – это высокомолекулярные азотсодержащие органические соеди-нения, состоящие из остатков аминокислот, соединенных пептидными связями. Иными словами белки – это полимеры, мономерами которых являются аминокислоты. Белки построены из сотен или тысяч аминокислотных остатков, соединенных пептидными связями. Разнообразие существующих в природе белков зависит от особенностей аминокислотного состава, количества аминокислотных остатков и порядка их сочетания. Общая характеристика аминокислот Всего в природе обнаружено около 300 аминокислот. По способности входить в состав белков аминокислоты бывают: 1) Протеиногенные (протеин – белок; генезис – дающий, рождающий). Количество белковых, или протеиногенных аминокислот, составляет относительно невелико: в живых организмах имеется 20 основных протеиногенных аминокислот. Помимо стандартных 20 аминокислот, в белках встречаются и модифицированные аминокислоты, которые являются производными обычных аминокислот. 2) Непротеиногенные (в состав белков не входят); бывают α, β и γ. Примеры: · β-аланин (входит в состав витаминов В3); · γ-аминомасляная кислота (участвует в передаче нервного импульса; участвует в цикле обезвреживания аммиака). В виде очищенных препаратов белковые (протеиногенные) аминокислоты представляют собой белые кристаллические вещества: сладкие, горькие или не имеющие вкуса. Все белковые аминокислоты являются α-аминокислотами с характерной общей структурной особенностью: наличием карбоксильной и аминной групп, связанных с атомом углерода в α-положении.
Помимо карбоксильной и аминогрупп, каждая аминокислота имеет радикал, который у разных аминокислот неодинаков по структуре, электрическому заряду и растворимости. Аминокислоты, входящие в состав белков.
Химические свойства.
Химические свойства аминокислот определяются наличием в их структуре нескольких функциональных групп, в общем случае аминогруппы (свойства оснований), и карбоксильной группы (свойство кислот). Поэтому в реакциях аминокислоты способны проявлять как основные, так и кислотные свойства – это амфотерные соединения, реагирующие и с кислотами, и с основаниями. В результате образуются соответствующие соли:
В зависимости от кислотности среды аминокислоты в растворе существуют в одной из форм:
в щелочной среде в нейтральной среде в кислой среде Если в аминокислоте преобладают кислотные группы, то раствор аминокислоты имеет кислую реакцию. Растворы кислот с основными радикалами имеют щелочную реакцию. Аминокислоты способны в ступать в реакции как с участием аминогруппы, так и с участием карбоксильной группы., характерные для соответствующих классов соединений. Реакция по аминогруппе (взаимодействие с азотистой кислотой):
Оксикислота Взаимодействие со спиртами (реакция по карбоксильной группе) приводит к образованию сложных эфиров:
Взаимодействие аминокислот друг с другом с отщеплением воды и образованием продукта, в котором фрагменты связаны пептидной связью:
Пептидная связь Подобные соединения – продукты конденсации двух и более продуктов аминокислот – называют пептидами. Они относятся к классу амидов. Качественной реакцией на аминокислоты является образование окрашенных в сине – фиолетовый цвет продуктов с нингидрином (аминокислоты им окисляются):
Нингидрин Ароматические аминокислоты при нагревании взаимодействуют с концентрированной HNO3 (нитрируется бензольное кольцо), продукты окрашены в желтый цвет (ксантопротеиновая реакция).
Классификация белков В зависимости от химического состава белки делятся на 3 группы: 1. Простые белки построены из аминокислот и при гидролизе распадаются только на аминокислоты. Протамины и гистоны – содержат до 85% аргинина, поэтому имеют выраженные основные свойства.
Белок сальмин, полученный из молок семги; клупеин – из молок сельди, скорее относятся к пептидам, т.к. имеют Mr не более 5000 Да. Протамины в основном являются белковой частью нуклеотидов (ДНК). Гистоны сосредоточены главным образом в ядре и представляют белковую часть РНК. Проламины и глютелины – белки растительного происхождения: зеин получают из кукурузы, глютенин - из пшеницы. Содержат до 25% глу, 10-15% про. Альбумины и глобулины – содержатся в сыворотке крови, молоке, яичном белке, мышцах и т.д. Это глобулярные белки, отличающиеся различной растворимостью (альбумины растворяются лучше), по Mr (альбумины имеют молекулярную массу, равную 69000 Да, глобулины - 150000Да). 2. Пептиды – это низкомолекулярные азотсодержащие соединения, состоящие из остатков аминокислот и имеющие молекулярную массу менее 5000 Да. а) с гормональной активностью (АКТГ, окситоцин, вазопрессин и др.); 3. Сложные белки или протеиды – состоят из двух частей: белковой и небелковой. Небелковую часть называют простетической группой, а белковую часть, утратившую простетическую группу, называют апобелком.
Подробно рассмотрим группу гемопротеидов – это Hb и его производное миоглобин (белок мышечной ткани), хлорофиллсодержащие белки и ферменты (цитохромы b, С, С1, каталаза, пероксидаза). Все они в качестве простетических групп содержат Fe (или Mg)–порфирины, а отличаются белковой частью.
Структуру гема впервые раскрыл Ненцкий, а его синтез провел Фишер. Фетальный HbF – в крови новорожденного содержится до 80%, к концу 1-го года жизни он почти полностью заменяется на HbA1. HbA состоит из 4 ППЦ: 2α–субъединиц и 2β–субъединиц. Четыре субъединицы или протомера ППЦ гемоглобина связаны друг с другом гидрофобными взаимодействиями. Молекула гемоглобина диссоциирует на два димера - αβ и α1β1. Каждый протомер содержит гем, находящийся в гидрофобной «нише», защищающей его от окисления в ферри-форму. Mr ППЦ гемоглобина равна 64458 (64500) Да.
В основе простетической группы Нb лежит протопорфирин, у которогоимеются: в положении 1,3,5,8-СН3– метильный R; в положении 2,4 СН1=СН– винильнный R; в положении 6,7 СООН–СН2–СН2 – остатки пропионовой кислоты. Железо, входящее в состав гемоглобина, имеет 2 ковалентные и 4 координационные связи; четыре связи образуют связи с атомами азота, пятая координационная связь присоединяет кислород к гему, шестая – связывает гем и ППЦ.
Вторичная структура белка (ВСБ).
Известны три основных типа ВСБ: α-спираль.
Закручивание ППЦ происходит по часовой стрелке, то есть у спирали – правый ход. Через каждые 5 витков (18 АК; 2,7 нм) конфигурация ППЦ повторяется.
Стабилизируется ВСБ в первую очередь водородными связями, и во вторую – пептидными и дисульфидными. Водородные связи в 10-100 раз слабее обычных химических связей; однако за счет их большого количества они обеспечивают определенную жесткость и компактность ВСБ. Боковые R-цепи α-спирали обращены к наружи и расположены по разные стороны от ее оси. β-структура.
Образование водородных связей происходит, как и в α-спирали, между CO– и NH– группами.
Содержание α-спирали и β-структуры в разных белках неодинаково. Не вся ППЦ уложена в спирали или складчатые слои. Беспорядочный клубок
Некоторые участки вообще не имеют какой-либо правильной периодической пространственной конфигурации. Их обозначают как беспорядочный клубок, однако такие участки имеют свою фиксированную конформацию, которая определяется аминокислотным составом этого участка, а также ВСБ и ТСБ смежных областей, окружающих беспорядочный клубок. В областях беспорядочного клубка ППЦ могут легко изгибаться и изменять свою конфигурацию, в то время как α-спирали и β-структуры представляют собой довольно жесткие структуры.
Встречаемость α-спирали и β-структуры в различных белках.
Третьичная структура белка (ТСБ).
По форме своих молекул и особенностям пространственной структуры белки делятся на две группы – глобулярные и фибриллярные белки. Дисульфидные связи приводят к тому, что удаленные друг от друга области ППЦ сближаются и образуют фиксированные петли. Гидрофобные взаимодействия осуществляются за счет сближения R аминокислот с молекулой воды. Неполярные гидрофобные R, отталкиваясь от водного окружения, как бы втягиваются внутрь белковой молекулы, образуя там так называемые «сухие зоны». А гидрофильные R обращены к наружи образующейся глобулы и ориентированы в сторону воды. Все образующиеся химические связи определены аминокислотным составом и их чередованием в ППЦ. Таким образом, ТСБ – это компактное расположение или упаковка в пространстве одной или нескольких ППЦ в определенном объеме. Четвертичная структура белка(ЧСБ).
Димеры и протомеры называются субъединицами. Протомеры – это наименьшие субъединицы. Белки, молекулы которых построены из нескольких ППЦ, называются олигомерами или олигобелками. Классификация белков До сих пор не существует единой, строго научной классификации белков, с помощью которой можно было бы их систематизировать. Поэтому используется несколько разных классификаций. По составу белки делят на: · Простые – белки, состоящие только из аминокислот и при гидролизе распадающиеся соответственно только на аминокислоты. По характеру растворимости эти белки можно разделить на следующие группы: 1. Альбумины – белки, растворимые в воде. Альбумины легко высаливаются из водных растворов с помощью солей. Они широко распространены в органах и тканях животных и растений.
2. Глобулины – нерастворимы в чистой воде, но растворяются в слабых водных растворах различных солей. Обычно в качестве растворителя используют 10%-ный NaС1 или КCl. Глобулины встречаются как в животных, так и в растениях, однако особенно много их в белках семян бобовых. 3. Глютелины – белки растительного происхождения, растворимые в растворах щелочей, так как содержат большое количество дикарбоновых аминокислот (глутамат, аспартат). Глютелины содержатся в семенах злаков, у которых они (совместно с проламинами) составляют основную массу клейковины, а также в зеленых частях растений. 4. Проламины – белки растительного происхождения, растворимые в 50-70%-ном растворе этилового спирта. Содержат 20-25% глутамата и 10-15% пролина (отсюда название). Проламины встречаются исключительно в семенах злаков, у которых они (совместно с глютелинами) составляют основную массу клейковины. · Сложные – кроме белковой части, содержат небелковую группу. 1. Липопротеины (в своем составе содержат липиды). 2. Металлопротеины (содержат металлы, к примеру, многие ферменты). 3. Нуклеопротеины (содержат нуклеотиды). 4. Гликопротеины (содержат углеводы). Липо- и гликопротеиды входят в состав мембран клеток. По конформации белки делят на: 1. Фибриллярные – состоят из параллельно расположенных полипептидных цепей, которые образуют волокна–фибриллы. Очень прочные, нерастворимые в воде. Выполняют структурную функцию (соединение тканей животных). Примеры: коллаген (кости), α-кератины (волосы, ногти). 2. Глобулярные – имеют форму глобулы, растворимы в воде. Выполняют динамическую функцию (движение веществ). Примеры- ферменты, гормоны, антитела, транспортные белки. 3. Промежуточные белки – имеют форму фибриллы, но растворимы в воде. К примеру, миозин, фибриноген. По количеству полипептидных цепей белки делят на: 1. Мономерные (состоят из одной полипептидной цепи). 2. Олигомерные (состоят из нескольких полипептидных цепей). По пищевой ценности белки делят на: 1. Сбалансированные (полноценные); содержат все незаменимые кислоты в нужных человеку пропорциях. К ним относятся белки животного происхождения (мясо, рыба, молоко). 2. Несбалансированные; незаменимые аминокислоты отсутствуют, либо их очень мало. К ним относятся белки растительного происхождения (за исключением сои, амаранта). По выполняемым функциям белки делят на: 1. Ферментативные (каталитически активные; только белки способны выполнять эту функцию). 2. Структурные (входят в состав клеточных мембран). 3. Строительные (например, коллаген, который входит в состав костного вещества; кератин, который входит в состав ногтей и волос). 4. Транспортные (транспортируют различные вещества, например, белок гемоглобин переносит кислород). 5. Защитные (например, такие белки, как антитела, обеспечивают защиту от инфекций). 6. Регуляторные (например, гормоны – регулируют обмен веществ). 7. Запасающие, или резервные (белки семян, яиц). 8. Сократительные (такие белки мышечных волокон как актин и миозин). Кроме того, белки, а точнее, образующиеся при их гидролизе аминокислоты, при полном расщеплении способны давать некоторое количество энергии. Однако энергетическая функция не является основной для белков и аминокислот. Основные свойства белков Физико-химические и химические свойства белков отличаются исключительным разнообразием. 1. Кислотно-основные (амфотерные) свойства.Определяются главным образом ионизируемымиR-группами пептидной цепи. В зависимости от реакции растворителя белок будет диссоциировать либо как кислота (в щелочном растворе), либо как щелочь (в кислом растворе). Поэтому в щелочном растворе молекулы белка будут заряжены отрицательно, а в кислом – положительно. Для каждого белка характерно определенное значение рН, соответствующее изоэлектрической точке, при которой белок остается неподвижным в электрическом поле. При значениях рН, лежащих выше изоэлектрической точки, белок несет суммарный отрицательный заряд, а при значениях рН ниже изоэлектрической точки – суммарный положительный. 2. Растворимость белков в воде.Характерна для глобулярных белков, в то время как фибриллярные белки являются гидрофобными. Как правило, растворимость в воде минимальна в их изоэлектрической точке. Она повышается по мере уменьшения ионной силы раствора и понижается при увеличении концентрации нейтральных солей (высаливание). При изоэлектрической точке наблюдается также наименьшая вязкость белковых растворов и наиболее легкое осаждение белка из раствора. 3. Гидролиз пептидных связей. В живых клетках он осуществляется при участии протеолитических ферментов (протеаз). 4. Оптические свойства.Заключаются в способности вращать плоскость поляризации света, рассеивать световые лучи ввиду значительных размеров белковых частиц и поглощать ультрафиолетовые лучи (оптические свойства белков используют при их количественном определении, измерении молекулярной массы и т.д.). 5. Гидрофильность белков.Вследствие того, что при образовании пространственной структуры белков гидрофобные радикалы аминокислот прячутся внутрь молекулы, а полярные, как правило, оказываются на поверхности, белки при взаимодействии с водой окружаются гидратной оболочкой и набухают. Набухание зерна при замочке, кондиционировании и прорастании, набухание белков муки при изготовлении теста, образование студней при добавлении желатины к различным кондитерским изделиям – все эти процессы тесно связаны с набуханием белков. 6. Способность белковых растворов превращаться в коллоидные системы – гели. В гелях растворитель и белок образуют одну внешне гомогенную массу, подобную студню. Гели обладают рядом физических свойств, характерных для твердого вещества. Свойства геля зависят от наличия в нем как бы своеобразного скелета, состоящего из белковых молекул. В гелях имеется гидратационная вода, окружающая толстым слоем коллоидные частицы белка, а также вода, удерживаемая в капиллярных пространствах между ними. 7. Набухание геля – способность поглощать и удерживать большое количество воды (впитывание воды). Сопровождается увеличением его объема и сильным давлением. Набухание геля зависит от концентрации водородных ионов и от присутствия солей. Минимальное набухание наблюдается при изоэлектрической точке данного белка. Явление, обратное набуханию, - отделение воды от геля – называется синерезисом. 8. Денатурация – изменение уникальной структуры нативного белка, сопровождающееся потерей характерных для него свойств: растворимости, биологической активности, электрофоретической подвижности. Денатурация может вызываться повышением температуры, РН, механическим воздействием, излучением. Денатурация, как правило, затрагивает третичную и частично вторичную структуры белковой молекулы и не сопровождается какими-либо изменениями первичной структуры. При определенных условиях денатурированный белок можно частично или полностью вернуть к исходному состоянию. Такой белок называют ренатурированным. Денатурация белков имеет большое значение в явлениях жизни. Она сопровождается параллельно идущими изменениями гидрофильности белков и их способности к взаимодействию с другими веществами. Так, по мере старения организма происходит постепенная денатурация белков и снижение их гидрофильности. Пример подобной необратимой денатурации – это старение семян, которые, даже при наиболее благоприятных условиях хранения, через определенный срок теряют способность к прорастанию; при этом одновременно происходит уменьшение гидрофильности белков. Весьма важную роль играет процесс обратимой денатурации белков – переход глобулярных белков в фибриллярное состояние и обратные превращения. Возможно, что именно с подобными обратимыми превращениями белков, сопровождающимися изменениями их гидрофильности и реактивности, теснейшим образом связаны такие явления, как завядание растений, движение протоплазмы. Денатурация белков происходит в целом ряде процессов пищевой промышленности: при выпечке хлеба и кондитерских изделий, при сушке макарон, овощей, молока или яичного порошка, при изготовлении консервов. 9. Осаждаемость – способность белков осаждаться под действием солей, ионов тяжелых металлов и органических растворителей. Водная оболочка, имеющаяся вокруг белковой глобулы, способствует устойчивости белковых растворов и препятствует осаждению белка. Если отнять у белковых глобул связанные с ними молекулы воды (дегидратация) и уменьшить таким образом их гидратацию, то они начнут слипаться, образуя более крупные частицы белка, и в конце концов будут оседать из раствора. Каждый индивидуальный белок разделяемой смеси осаждается из нее при определенной концентрации той или иной соли, в то время как другие белки при данной концентрации соли остаются в растворе. Процесс осаждения белка из раствора под действием солей называется высаливанием. 10. Качественные (цветные) реакции. Обладая аминокислотными радикалами различной химической природы, белковые молекулы способны давать широкий круг реакций. При взаимодействии белка с отдельными химическими веществами возникают окрашенные продукты реакции, образование которых обусловлено наличием в молекуле белка той или иной аминокислоты или химической группировки. Поэтому так называемые цветные реакции на белки часто используют для установления белковой природы вещества, изучения аминокислотного состава различных природных белков, количественного определения белков, количественного определения в белке той или иной аминокислоты.
Общая характеристика белков и аминокислот.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-17; просмотров: 633; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.17.174.239 (0.05 с.) |