
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Часть 2. Долговечность и защита от коррозии бетонных и железобетонных изделий и конструкцийСтр 1 из 5Следующая ⇒
Часть 2. Долговечность и защита от коррозии бетонных и железобетонных изделий и конструкций История развития науки о долговечности Первое научное исследование процессов коррозии бетона на гидравлических вяжущих под действием морской воды датируется 1857 годом (работа Вика «Исследования химических причин разрушения гидравлических составов морской водой и способов определения их сопротивляемости этому воздействию»). Вика обнаружил химическое взаимодействие Са(ОН)2 с сульфатом магния (МgSO4) растворенным в воде с образованием гидроокиси магния (Мg(ОН)2) и гипса СаSO4, что вызывало разрушение цементного камня. С начала 19 века началось массовое применение бетонов на основе гидравлических вяжущих в морских сооружениях. Поэтому первые исследования долговечности посвящены именно морским сооружениям. В Российской империи большую роль в становлении науки о долговечности сыграли обследования морских железобетонных сооружений, выполненные в течение 1902-1904 гг. Шуляченко А.Р., Чарномским В.И., Байковым А.А. В 1880-1890 гг. появились первые ж/б конструкции и началось их массовое использование в промышленных здания и сооружениях. В начале 20 века проведены исследования поведения ж/б конструкций в различных грунтах и атмосфере индустриальных районов. В США в 1925 г. были начаты длительные исследования поведения ж/б конструкций в естественных грунтах со значительным содержанием сульфатов с расчетом получения результатов через 25, 50 и более лет. В 1951 году Миллером опубликованы результаты исследований через 25 лет. В России до революции коррозионные исследования относились в основном к морским сооружениям. Промышленность же была слаба. Лишь с началом индустриализации начался расцвет науки. Существенный вклад внесли Будников П.П., Бутт Ю.М., Иванов Ф.М., Кинд В.А., Красильников К.Г., Москвин В.М., Шестоперов С.В. и др. До войны разработаны нормы агрессивности воды-среды и проведены основополагающие исследования. В 1937 г. проведена первая конференция по коррозии бетона, а с 1954 г. конференции проходят регулярно в 5-6 лет. С 1950г. начаты исследования коррозии стальной арматуры. Центральная лаборатория коррозии НИИЖБа – головная организация по изучению коррозии бетона и железобетона создана в 1954 году.
Основными направления развития науки о долговечности являются: - разработка теории коррозии бетона и железобетона; - исследования коррозии бетона в различных средах; -исследование коррозии арматуры и повышение защитных свойств бетона по отношению к стальной арматуре; - исследование работы железобетонных конструкций в различных агрессивных средах и создание коррозионностойких конструкций; - защита железобетонных конструкций лакокрасочными, пленочными и полимерными покрытиями; - технико-экономическая оценка защиты железобетонных конструкций; -изучение поведения ж\б конструкций в натурных условиях и разработка методов испытаний. Коррозия бетона I вида 2.5.1 Описание механизма коррозии К коррозии бетона первого вида относятся процессы, которые возникают при фильтрации через тело бетона воды или водных растворов. Процесс коррозии обусловлен растворимостью продуктов гидратации портландцемента в воде. Наиболее растворимым компонентов является гидроксид кальция (Са(ОН)2), который в избыточном количестве присутствует в поровой структуре. Поэтому данный вид коррозии получил название «коррозия выщелачивания». Интенсивность коррозии определяется проницаемость (плотностью) бетона и минералогическим составом цемента. Данный вид коррозии наиболее интенсивно проявляется в случае постоянной фильтрации жидкости через тело бетона. Интенсивность коррозии возрастает при наличии в фильтрующей воде сульфат ионов, ионов хлора, натрия и калия. Количество Са(ОН)2 в цементном камне составляет примерно: - 9-11% в возрасте 1 месяц; - 15% в возрасте 3 месяца. Растворимость Са(ОН)2 в дистиллированной воде при 200С – 1,18 г/л (в расчете на СаО). При действии воды на цементный камень образуется пересыщение раствора с концентрацией СаО до 1,6-1,7 и даже 1,9 г/л.. Присутствие одноименных ионов (Са++, ОН–) снижают растворимость, а посторонних (SО Если создаются благоприятные условия для процесса выщелачивания, то вначале в раствор переходит и удаляется свободный гидроксид кальция (Са(ОН)2), а затем при уменьшении водородного показателя происходит гидролиз гидросиликатов (СSН) и гидроалюминатов (САН) кальция с выделением гидроксида кальция (Са(ОН)2). Также происходит гидролиз и других гидратов, одновременно гидратируются и зерна клинкера.
2.5.2 Методы исследования Для исследования процесса коррозии первого вида наибольшее распространение получили следующие методы: – экстрагирование водой цементного камня; – фильтрация воды через раздробленный цементный камень; – напорная фильтрация воды через образцы ненарушенного цементного камня и бетона; – растворение извести при омывании водой наружной поверхности образцов. Метод исследования на раздробленных образцах дает лишь ориентировочную картину и не может использоваться для оценки интенсивности коррозии. Для изучения процесса коррозии предпочтение отдают методу напорной фильтрации воды через образцы (рис.3). Но можно использовать и метод «омывания», например, при имитационных исследованиях.
Участок (а-б). Прямопропорциональная зависимость (при малой скорости фильтрации и большой толщине изделия). Скорость коррозии определяется количеством фильтрующейся воды (в расчете на единицу поверхности) Участок (б-в). Концентрация растворенной извести уменьшается с увеличением скорости фильтрации, т.к. процесс лимитируется временем диффузии извести из глубины микрокапилляров в водный фильтрационный поток Участок (в-г). Количество растворенной извести остается постоянным, не зависящим от скорости воды и определяется только скоростью диффузии Са(ОН)2 в цементном камне данной структуры (в случае омывания бетонной поверхности большими количествами воды). Рисунок 3. Зависимость количества удаленной извести от скорости фильтрации воды через образец а) б)
Рисунок 4. Снижение прочности цементного раствора (а) и бетона (б) при выщелачивании. 2.5.3 Факторы, оказывающие влияние на стойкость цементного камня и бетона. 2.5.3.1 Вяжущее Стойкость цементного камня и бетона при коррозии I вида зависит от: - минерального и вещественного состава цемента; -микроструктуры цементного клинкера (определяемой скоростью охлаждения клинкера, тонкостью помола и др.); Например, при ограничении содержания С3S стойкость цементного камня повышается. Лучшая стойкость к коррозии у белитовых цементов. С увеличением отношения С3S/С2S стойкость снижается. С возрастанием содержания в цементе добавок, связывающих Са(ОН)2, стойкость возрастает. По возрастанию стойкости вяжущие можно расположить следующим образом: – песчаный портландцемент; – портландцемент; – гипсошлаковый цемент; – пуццолановый портландцемент; – песчано-пуццолановый портландцемент; – глиноземистый цемент (прежде всего за счет высокой плотности). Введение в состав цемента активной гидравлической добавки, способной к связыванию гидроксида кальция, существенно повышает его стойкость. Минеральные добавки к цементу не только изменяют химический состав цементного камня, придавая ему большую стойкость к воздействию воды, но и повышают плотность бетона (снижают водонепроницаемость). По убыванию способности связывать гидроксид кальция добавки можно расположить в следующей последовательности (по доле активности в мг СаО на 1г добавки в 28 суток)
сиштофф – 364; бренский трепел – 300; вольский трепел – 296; карадачский трас – 105 английская пемза – 40; нальчинский пепел – 36. Процесс связывания Са(ОН)2 добавками не ограничивается 28 сутками и является достаточно продолжительным. 2.5.3.2 Технологические факторы Так как стойкость к первому виду коррозии зависит от степени связывания Са(ОН)2 и плотности бетона, следовательно к основным технологическим параметрам можно отнести: - повышение температуры и длительности твердения (позволяет связать больше Са(ОН)2). Наиболее эффективна автоклавная обработка; - обеспечение высокой относительной влажности среды при твердении бетона; - увеличение продолжительности твердения в нормально-влажностных условиях (особенно эффективно при использовании пуццоланового портландцемента). 2.5.4 Методы защиты от коррозии I вида Признаком коррозии I вида является наличии на поверхности бетона белого налета («высолов»), который образуется в результате того, что Са(ОН)2, вымываясь из бетона, попадает на поверхность изделия, карбонизируется и превращается в труднорастворимый карбонат кальция (СаСО3). Наиболее часто коррозия I вида выявляется при эксплуатации: гидротехнических сооружений (плотины); тоннельной обделки; цементных швов; каналов; лотков; резервуаров; труб; штукатурок и т.д. Наличие белых пятен не является свидетельством опасности коррозии, а лишь количество налета может служить оценкой скорости протекания коррозионного процесса. К основным методам защиты конструкций от коррозии I вида относятся: – искусственная либо естественная карбонизация бетона; – обработка поверхности солями и слабыми кислотами с целью образования слоя малорастворимых солей кальция. Пример: Н2SiF6, щавелевая Н2С2О4, фосфорнокислый Са(Н2РО4)2.
Коррозия бетона II вида 2.6.1 Описание механизма коррозии Этот вид коррозии связан с обменными реакциями между кислотами и солями окружающей среды и составными частями цементного камня. Чем интенсивнее реакция, тем скорее разрушается бетон. Разрушение идет с поверхности вглубь изделия. Далее продукты реакции могут смываться механически, либо обладать некоторыми вяжущими свойствами, влияя на процесс коррозии. Разновидностью II вида коррозии является углекислотная коррозия. В природе она встречается наиболее часто, так как углекислота (Н2СО3) присутствует в грунтовых водах за счет биохимических процессов.
На первом этапе происходит реакция между агрессивной углекислотой и карбонатом кальция: Са(ОН)2+Н2СО3 При избытке ионов ОН– на поверхности цементного камня вначале образуется карбонат кальция в твердом виде, который затем переходит в раствор в виде бикарбоната СаСО3 + Н2СО3 Характеристикой интенсивности коррозии служит количество СаО (в виде бикарбоната) в агрессивном растворе. Пуццолановый портландцемент и глиноземистый несколько более стойкие чем портландцемент, что объясняется уплотняющим действием продуктов коррозии, препятствующим свободной диффузии Са++ к поверхности цементного камня. Агрессивность раствора возрастает с увеличением содержания агрессивной углекислоты, т.е. со снижением водородного показателя (рН). Типичным примером II вида коррозии является действие кислот на цементный камень. При воздействии кислоты цементный камень полностью разрушается: Са(ОН)2 + Н2SО4 (или 2НСI; НNО3) = СаSО4 [или СаСI2; Са(NО3)2] + 2Н2О n СаО m SiО2 + р Н2SО4 + aq = n СаSО4 m Si(ОН)4 + aq и т.д. В зависимости от растворимости продуктов реакции изменяется и скорость коррозионного процесса. Например: поверхностные слои можно обрабатывать слабым раствором кремнефтористоводородной кислоты для их уплотнения: 3Са(ОН)2 + Н2SiF6 = 3СаF2 + Si(ОН)4 + 2Н2О Гель Si(ОН)4 в порах слаборастворим, а фторид кальция уплотняет поверхность. Скорость коррозии II вида возрастает при увеличении концентрации кислоты и скорости фильтрации. Опыты показывают, что разрушение бетона происходит быстро, но в более концентрированных растворах (рН=1) пуццолановые портландцементы обладают равной с портландцементом или меньшей стойкостью, а в растворах слабой концентрации (рН=4) стойкость пуццоланового портландцемента равна (для НСI) или выше (для Н2SО4) стойкости портландцемента. Средние относительные скорости коррозии для различных видов вяжущих приведены в таблице 14. Таблица 14. Средние относительные скорости коррозии
Влияние кислоты на скорость коррозии также определяется растворимостью продуктов коррозии. В таблице 15 приведена растворимость некоторых продуктов взаимодействия кислоты с цементным камнем. Таблица 15. Растворимость продуктов взаимодействия кислоты с цементным камнем (солей)
Окончание таблицы 15
Следующей разновидностью коррозии II вида является действие на бетон растворов магнезиальных солей. В основном это сернокислый и хлористый Мg, которые присутствуют в грунтовых водах и морской воде. Взаимодействие идет по следующей схеме:
МgSО4 Са(ОН)2= СаSО4 + Мg(ОН)2 МgСI2 Са(ОН)2= СаCI2 + Мg(ОН)2 Мg(ОН)2 – трудно растворим (18,2 мг/л) и выпадает в осадок. На поверхности бетона и в порах образуется белый налет, а затем происходит скопление белого аморфного вещества. Действие растворов щелочей также относится к коррозии II вида. Существуют утверждения, что щелочи безвредны для бетона. Однако на предприятиях по производству едкого натра и соды разрушаются не только бетон, но и кирпичная, каменная кладки. Растворы щелочей низкой концентрации сами по себе не причиняют значительного вреда бетону, но если в бетоне возникает возможность карбонизация щелочей под действием углекислого газа воздуха (СО2), то происходит накопление в структуре кристаллизирующихся углекислых солей, что приводит к его разрушению. При воздействии на цементный камень и бетон растворов щелочей высокой концентрации механизм коррозии заключается в том, что растворимость Са(ОН)2 при этом значительно снижается, а растворимость других составляющих цементного камня: кремнезема и полуторных окислов увеличивается в основном за счет образования силикатов и алюминатов натрия и калия. Отсюда следует, что воздействие щелочи высокой концентрации на элементы цементного камня и заполнителей, содержащих кремнезем или глинозем, может вызвать разрушение бетона. Коррозия может происходить по одному из двух вариантов: - при полном погружении бетона коррозия за счет растворения SiО2 и АI2О3 из цементного камня и заполнителя. Чем выше концентрация NaОН, КОН, тем интенсивнее коррозия; - при наличии испаряющей поверхности и доступе СО2 коррозия в основном вызывается кристаллизацией углекислых солей щелочных металлов в порах и капиллярах (механизм рассмотрен выше). Повышение температуры среды увеличивает скорость коррозии как при действии щелочей высокой, так и низкой концентрации. К технологическим приемам придания стойкости бетона при воздействии на него растворов щелочей высокой концентрации является повышение плотности (водонепроницаемости), а также использование в качестве вяжущего портландцемента (содержится меньше SiО2, чем в пуццолановом и шлакопортландцементе). 2.6.2 Методы защиты от коррозии II вида К основным методам защиты при действии на бетон кислот относятся: – применение кислотоупорных цементов; – применение полимербетонов; – изоляция поверхности покраской, облицовкой.
Коррозия бетона III вида 2.7.1 Описание механизма коррозии Основным признаком этого вида коррозии является накопление в порах и капиллярах солей с последующей их кристаллизацией с увеличением объема твердой фазы. Соли образуются либо в результате реакции агрессивной среды с компонентами цементного камня, либо привносятся из вне и выделяются из раствора в результате испарения воды. Рост кристаллов в порах и капиллярах в некоторый момент вызывает значительные растягивающие усилия и разрушение структуры. Коррозия III вида может наблюдаться и при проникании в бетон некоторых мономеров и их последующей полимеризации с увеличением объема (пример: мономер хлорпренового каучука – хлорбутена). При коррозии практически всегда вначале уплотнение, поэтому экспресс – методы могут дать ложную картину благополучия. В чистом виде коррозия III вида обычно не встречается, как правило накладывается коррозия I и II вида. III вид проявляется при попеременном высушивании-насыщении, а также при наличии испаряющей поверхности. Основной разновидностью III вида коррозии является - сульфатная коррозия бетона. Сульфаты встречаются в пресных реках и озерах (содержание SО Сульфаты Nа и К способны в значительной степени повысить растворимость составных частей цементного камня (I вид), вызвать развитие обменных реакций с замещением Nа+, К+ и Mg++ в сульфате на ион Са++ из цементного камня (II вид), а при накоплении в порах цементного камня СаSО4 возникает III вид коррозии. Наибольшее влияние на стойкость цементного камня при воздействии сульфатов оказывает гидросульфоалюминат кальция. В зависимости от условий может образовываться две формы гидросульфоалюмината: - трехсульфатный – 3СаО·Аl2О3·3СаSО4·30Н2О (а) - моносульфатный – 3СаО·Аl2О3·СаSО4·12Н2О (б) Наиболее опасна трехсульфатная форма гидросульфоалюмината или «этрингит», «цементная бацилла». Рост его кристаллов вызывает коррозию. В жидкой фазе, заполняющей поры цементного камня, этрингит кристаллизуется из раствора. Соль малорастворима, особенно в растворах сульфатов и гидроксида кальция. Механизм образования этрингита следующий: Са(ОН)2+Na2SО4+ 2Н2О 3СаSО4·2Н2О+С3АН6+23Н2О Коррозия интенсифицируется со снижением t0. 2.7.2 Факторы, оказывающие влияние на стойкость цементного камня и бетона. 2.7.2.1 Влияние вида вяжущего. Содержание MgО в клинкере до 5% не влияет на коррозионную стойкость цементного камня. Содержание гипса в цементе оказывает существенное влияние на стойкость цементного камня. Существует прямая связь между сульфатостойкостью, количеством гипса и тонкостью помола цемента: чем тоньше помол, тем больше гипса может быть введено и химически связано в начальный период гидратации, тем выше сульфатостойкость бетона. По влиянию на сульфатостойкость содержания C3S и C2S в цементе существуют разногласия, но вероятнее всего в зависимости от соотношения C3S/C2S для выпускаемых в настоящее время цементов не оказывает существенного влияния. Но в случае если возможно одновременно протекание I вида коррозии, то предпочтение отдают цементам с большим содержанием C2S. По последним данным С4АF практически не влияет на сульфатостойкость, но данное утверждение требует дальнейшего изучения. Существенное влияние на сульфатостойкость оказывает содержание C3А в цементе. С увеличением С3А стойкость цементного камня снижается. Наблюдение за морскими сооружениями показывают, что бетоны на высокоалюминатном цементе (14-16% С3А) менее стойкий, чем на низкоалюминатном (6% C3А). Для обеспечения требуемой сульфатостойкости цементного камня и бетона предпочтение отдают глиноземистому и сульфатостойкому цементу. Согласно ГОСТ 22266-94 существуют следующие разновидности сульфатостойких цементов: – сульфатостойкий цемент (С3А до 5%, С3А+С4АF до 22%, С3S до 50%); – сульфатостойкий цемент с минеральной добавкой (С3А до 5% и до 10% активных минеральных добавок); – сульфатостойкий шлакопортландцемент (ШПЦ) (С3А до 8%, шлака с А2О3 не > 8%). Также для обеспечения требуемой сульфатостойкости предпочтение следует отдавать так называемым баритовым цементам (часть СаО заменена на ВаО). Вопрос о стойкости пуццолановых и шлакопортландцементов зависит от концентрации раствора, вида иона (Nа2SО4, MgSО4 и др.) Пуццолановый и шлакопортландцемент в общем предпочтительнее применять, чем обычный портландцемент. 2.7.2.2 Влияние химического состава агрессивной среды. По влиянию катиона сульфатные среды можно разделить на три группы (в зависимости от свойств продуктов, образующихся при взаимодействии с минералами цементного камня): 1. Сильнорастворимые гидроксиды – Nа+, К+. Металлы этой группы образуют гипс и высокорастворимые гидроксиды металлов. При фильтрации агрессивного раствора коррозия протекает интенсивнее, а при неподвижном растворе – менее интенсивное; 2. Малорастворимые гидроксиды – Mg++,Fе+++. Металлы этой группы дают сульфаты повышенной агрессивности, разрушительно действующие на все цементные материалы. Лишь в плотном цементном камне и при образовании нерастворимых продуктов реакции может происходить уплотнение структуры, препятствующее дальнейшей коррозии; 3. Летучие или нейтральные соединения –NН При действии Nа2SО4 в основном образуются кристаллы гипса. ГСАК в виде крупных кристаллов в небольшом количестве. Большое количество ГСАК образуется при действии СаSО4 и МgSО4. 2.7.3 Признаки коррозии III вида Внешние признаки: – для плотных бетонов это поверхностное шелушение, отслоения, выкрашивание заполнителя и т.д.; – для неплотных бетонов это растрескивание по всему объему, видимая деформация образца Выделяют следующие стадии разрушения: Стадия 1. В поверхностном слое цементного камня, соприкасающегося с раствором сульфата, образуется пленка из продуктов коррозии. Из кристаллов она представлена в основном гипсом. Пленка более развитая, если действует MgSО4, т.к. откладывается много аморфного Mg(ОН)2. Стадия 2. В цементном камне образуются трещины ориентированные параллельно поверхности, происходит заполнение их гипсом или гипсом и ГСАК. Трещины образуются на участках с повышенным содержанием Са(ОН)2 и менее однородной структурой. Стадия 3. Образуются трещины нормальные к поверхности и происходит распад цементного камня и бетона. 2.7.4 Коррозия бетона при кристаллизации солей в его порах Вариант № 1 - частичное погружение конструкций в агрессивный раствор Кинетика коррозионного процесса определяется: интенсивностью поступления раствора, площадью открытой поверхности, расстоянием от открытой поверхности до уровня агрессивного раствора, температурой, влажностью воздуха. Перенос агрессивной среды (раствора) в теле бетона в сторону испаряющей поверхности происходит по механизму капиллярного переноса, а особенности коррозии определяются соотношением влагопроводности (растворопроводности) бетона и интенсивности испарения. Возможны два случая: а) Влагопроводность бетона больше интенсивности испарения. В данном случае происходит капиллярный подсос раствора без изменения концентрации до испаряющей поверхности. Происходит накопление солей на испаряющей поверхности. Наиболее интенсивно разрушается поверхностный слой бетона в первую очередь за счет выщелачивания (коррозия I вида), т.к. в присутствии солей растворимость Са(ОН)2 повышается; б) Влагопроводность бетона меньше интенсивности испарения. В этом случае испарение раствора начинается уже в глубине бетона. При испарении повышается концентрация агрессивного раствора и происходит кристаллизация солей. При накоплении солей может появиться кристаллизационное давление. Обычно оно невелико. Но полагают, что наибольшую опасность оказывает не просто кристаллизация солей, а увеличение объема соли при фазовом переходе от менее гидратированной формы к более, при высыхании при температуре выше температуры точки фазового перехода, а затем увлажнение при повышении температуры ниже этой точки, что приводит к образованию кристаллогидрата с увеличением объема твердой фазы (по Минасу А.И.) (табл.16). Таблица 16. Увеличение объема твердой фазы при фазовом переходе
Вариант № 2 - Попеременное смачивание бетона растворами солей и высушивание При погружении в агрессивный раствор происходит его поглощение за счет капиллярных сил. При сушке агрессивный раствор мигрирует к испаряющей поверхности. Коррозионные процессы в этих условиях значительно усиливаются и осложняются влиянием температуры, движением жидкого фронта и др. Часто разрушение осложняется коррозией I вида, которая наиболее интенсивно проявляется в условиях циклического воздействия. Например, при насыщении и высушивании образцов в растворе NаСI возможно химическое взаимодействие: 2NаСI + Са(ОН)2 2.7.5 Защита от коррозии III вида. Основными способами защиты от коррозии III вида является: – повышение плотности бетона; - объемная гидрофобизация бетона; - правильный выбор цемента; - применение воздухововлекающих добавок; - гидроизоляция поверхности бетона.
2.8 Внутренняя коррозия бетона – коррозия бетона в результате взаимодействия щелочей цемента с кремнеземом заполнителя 2.8.1 Описание механизма коррозии Разрушение бетона происходит в результате реакции между щелочами цемента и кремнеземом, содержащимся в заполнителе. Впервые данный вид коррозии обнаружил и описал Стэнтон в 1940 году. В результате взаимодействия щелочей с кремнеземом образуются коллоидные растворы силикатов Nа и К, которые создают внутренние напряжения в структуре материала. Как правило, возникают местные концентрированные деформации, что ведет к появлению трещин. Максимум деформаций бетона отвечает максимуму увеличения количества продуктов реакций, а кроме того, основное влияние оказывает местное накопление продуктов реакции на поверхности зерна реакционноспособного кремнезема. Опасность коррозии зависит от размера зерен заполнителя. У очень крупных зерен заполнителя достаточно малая удельная поверхность, и, наоборот, у очень мелких зерен заполнителя, она достаточно высокая. В первом случае продуктов реакции будет настолько мало, что они не смогут привести к образованию опасных напряжений в структуре материала. Во втором случае, продуктов реакции много, но они распределяются по большой поверхности, не вызывая концентрированных напряжений. Кроме того, протекание коррозии лимитируется температурно-влажностными условиями. Благоприятные условия для протекания коррозии: влажность φ Опасность коррозии возникает при содержании щелочей в цементе более 1,0 % по массе и при использовании заполнителей содержащих аморфный (активный) кремнезем. 2.8.2 Признаки коррозии Данный вид коррозии обычно проявляется в дорожных покрытиях, гидротехнических сооружениях, мостах и др. На поверхности бетона появляется мелкая сетка трещин, постепенно растущих. Иногда из трещин в виде капель выделяется жидкое стекло (силикат калия или натрия). Происходит полное разрушение. 2.8.3 Факторы, оказывающие влияние на стойкость бетона. 2.8.3.1 Вид вяжущего Разрушения наиболее часты при применении чисто клинкерных портландцементов без гидравлических добавок, с повышенным содержанием (более 1 %) щелочей. Использование цементов с тонкодисперсными добавками аморфного кремнезема позволяет снизить или исключить опасность коррозии. 2.8.3.2 Вид заполнителя Опасность коррозии возникает в случае использования заполнителей содержащих реакционноспособный микрокремнезем. Ограничение его содержания в заполнителе или использование других заполнителей снижает опасность коррозии. 2.8.4 Защита от коррозии Основными способами защиты от коррозии является применение цементов с низким содержание щелочей и заполнителей с минимальным содержанием реакционноспособного микрокремнезема.
Биокоррозия бетона 2.9.1 Описание механизма коррозии На сегодняшний день нет единого мнения относительно того, какие процессы следует относить к биокоррозии. В основном к бетону относятся как к биостойкому материалу. Бетон не является питательной средой для живых организмов. Биокоррозия возможна, если на поверхности бетона присутствуют органические соединения являющиеся питательной средой для микроорганизмов. Такие соединения могут появиться в бетоне при применении органических добавок или в процессе эксплуатации конструкции. Микроорганизмы поселяясь на поверхности бетона или в теле бетона в процессе жизнедеятельности выделяют продукты метаболизма. Так как процессы жизнедеятельности – это окислительные процессы, то главными продуктами метаболизма являются кислоты. 2.9.2 Защита от коррозии Основным способом защиты от биокоррозии является придание бетону биоцидности, путем обработки поверхности специальными составами, что не только защищает бетон от коррозии, но и придает ему повышенные санитарно-гигиенические свойства.
Газовая коррозия бетона 2.11.1 Описание механизма коррозии Термин «газовая коррозия бетона» носит условный характер, т.к. по существу элементарных процессов коррозия бетона в газовых средах не отличается от коррозии в жидкостях. Химические реакции между кислыми газами и минералами цементного камня протекают в пленках влаги. Газ вначале растворяется, а затем вступает в реакцию. Самый распространенный вид газовой коррозии бетона – это коррозия карбонизации или воздействие углекислого газа (СО2). Углекислый газ содержится в атмосфере. Его содержание составляет приблизительно 0,03% по объему. Также возможна коррозия и при действии других газовых сред. Например, в производственных помещениях присутствуют SО2, НСI, CI2, НF, NО2 и др. кислые газы, а также пары и аэрозоли кислот. Коррозия арматуры в случае газовой коррозии возможна в трех случаях, если: - защитный слой полностью разрушен; - защитный слой нейтрализован (карбонизирован); - защитный слой проницает для солей – активаторов. 2.11.2 Классификация газовых сред. Газы разделяют на группы: I группа - газы, образующие практически нерастворимые и малорастворимые соли кальция. Объем твердой фазы при этом несколько увеличивается, а проницаемость уменьшается. Малая растворимость продуктов реакции исключает их диффузию в глубь бетона. Прочность бетона при этом практически не изменяется. Коррозия арматуры начинается после нейтрализации защитного слоя. К ним относят: двуокись углерода, фтористый водород, фтористый кремний, фосфорный ангидрид, пары щавелевой кислоты. II группа - газы, образующие слаборастворимые соли, содержащие значительное количество кристаллизационной воды, что сопровождается увеличением V твердой фазы и уплотнением бетона. При этом возможна дегратация защитного слоя или его нейтрализация. К ним относят: сернистый и серный ангидрит, сероводород. III группа - газы, образующие хорошо растворимые гигроскопические соли (хлористый водород, хлор, двуокись хлора, поры брома и йода; окислы азота, поры азотной кислоты и др.) При повышении относительной влажности воздуха гигроскопические соли образуют растворы, проникающие за счет капиллярного всасывания либо диффузия в глубину бетона. Образующиеся соли могут быть агрессивными (например: СаСI) или нейтральными (например: Са(NО3)2) по отношению к арматуре. Таблица 17 – Классификация газовых сред
2.11.3 Кинетика нейтрализации (карбонизации) бетона Опасность нейтрализации бетона связана в первую очередь с тем, что снижение рН среды вызывает депассивацию стальной арматуры. Также следует учитывать, что при карбонизации электропроводность бетона снижается в 3-4 раза.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 1540; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.33.107 (0.128 с.) |
 , Сl–, Nа+, К+) повышают. Увеличение растворимости усиливает процесс коррозии.
, Сl–, Nа+, К+) повышают. Увеличение растворимости усиливает процесс коррозии.
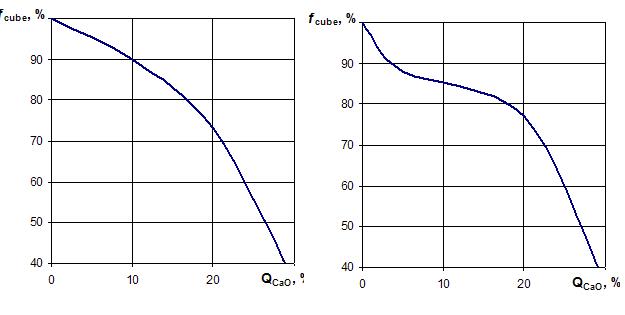
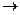 СаСО3 +2Н2О
СаСО3 +2Н2О или Н+ (пример: Са(ОН)2+ (NН4)2SО4= СаSО4+2NН4ОН). При действии соединений этой группы идет не только сульфатная коррозия, но и растворение цементного камня в результате обменных реакций. Растворы с этими катионами весьма агрессивны. Основной метод исследования – измерение деформаций образцов.
или Н+ (пример: Са(ОН)2+ (NН4)2SО4= СаSО4+2NН4ОН). При действии соединений этой группы идет не только сульфатная коррозия, но и растворение цементного камня в результате обменных реакций. Растворы с этими катионами весьма агрессивны. Основной метод исследования – измерение деформаций образцов.
 80% и температура t0 > 10-150С.
80% и температура t0 > 10-150С.


