
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Коррозия стальной арматуры железобетонных конструкций
2.10.1 Теория процесса коррозии стали в бетоне 2.10.1.1 Электрохимическая природа коррозии Коррозия металла – это постепенное физико-химическое разрушение под действием окружающей среды. Для электрохимического механизма коррозии металла характерны следующие условия: условие 1 - наличие разности потенциалов (φ) между отдельными участками поверхности металла (т.е. электрохимическая неоднородность); условие 2 - наличие электрохимической связи между этими участками; условие 3 - активное состояние поверхности на анодных участках, где металл растворяется по реакции: nН2О+Ме условие 4 - наличие достаточного количества деполяризатора, в частности кислорода, необходимого для ассимиляции на катодных участках поверхности металла избыточных электролитов: 4ē+О2+2Н2О →4ОН–. Схема электрохимической коррозии железа следующая: Поскольку существует электрохимическая неоднородность (неоднородность собственно стали и контактной с бетоном поверхности), то условие 1 выполняется. Выполняются так же условие 2 и условие 4 (бетон электропроводен и кислородопроницаем), то отсутствие коррозии обусловлено невыполнением условия 3. Практическое отсутствие коррозии объясняется пассивностью стали в щелочной среде. Гомашов Н.Д. определяет пассивность, как состояние повышенной коррозионной устойчивости металла, вызванное торможением анодного процесса. Наступление пассивности характеризуется обычно резким облагораживанием электродного потенциала металла. Граница пассивирующего действия Са(ОН) проходит около рН=12 при свободном и рН=11,5 при ограниченном доступе воздуха. Если есть активирующие ионы (СI–), то явление пассивности не наступает вовсе, даже и при больших значениях рН. Существует две основные теории пассивности стали в бетоне: 1. Адсорбционный механизм – наступление пассивности связывается с адсорбцией кислорода (или других атомов), изменяющих химические свойства поверхности, вследствие насыщения свободных валентностей металла атомами, или при изменении строения двойного электрического слоя, в результате чего затрудняется протекание электрохимической реакции растворения металла. 2. Пленочный механизм – наступление пассивности связывается с образованием на поверхности металла фазовой защитной пленки, представляющей собой кислородное соединение металла.
Эти теории взаимно дополняют друг друга. Так, по мере того, как адсорбционная пленка, утолщаясь, переходит в фазовую, анодный процесс испытывает дополнительное торможение при прохождении ионов непосредственно через защитную пленку. Образовавшиеся пленки представляют собой γ Fе2О3 или Fе2О4, толщиной 20-100 À. 2.10.2 Процессы и основные химические реакции, протекающие в бетоне. Как известно, на катоде протекают восстановительные реакции, на аноде – окислительные. Анодный процесс (коррозия) – переход металла в раствор в виде гидратированных ионов или его окисление; при этом в металле остается соответствующее число электронов. Анодная реакция: Fе →Fе2++2е или Ме→Меn++nе Катодный процесс: поглощение появившихся в металле избыточных электронов с помощью так называемых деполяризаторов, которыми могут явиться атомы, молекулы, ионы раствора, подвергающиеся восстановлению на всей поверхности металла или отдельных ее участках; Катодная реакция: 2Н++2е→2Н→Н2↑восстановление водорода при рН<4 О2+2Н2О+4е→4ОН– восстановление кислорода с превращением его в ион гидроксила Д+е→Д– (в щелочной и нейтральных средах). Скорости обоих процессов взаимосвязаны. Происходят и вторичные реакции. В растворе ионы металла вступают в реакцию с продуктами катодных реакций. При этом образуются гидроокиси металлов: Fе2++2ОН– →Fе(ОН)2 Труднорастворимая гидроокись железа (II) выпадает в осадок. При избытке кислорода гидроокись (II) окисляется в гидроокись Fе (III) 4Fе(ОН)2+О2+Н2О→4Fе(ОН)3 – нестабильна и разлагается, образуя гидратированный окисел Fе2О3·Н2О Если О2 мало, то образуется 6Fе(ОН)2+О2→6Н2О+2Fе3О4 – магнетит
Газовая коррозия бетона 2.11.1 Описание механизма коррозии Термин «газовая коррозия бетона» носит условный характер, т.к. по существу элементарных процессов коррозия бетона в газовых средах не отличается от коррозии в жидкостях. Химические реакции между кислыми газами и минералами цементного камня протекают в пленках влаги. Газ вначале растворяется, а затем вступает в реакцию.
Самый распространенный вид газовой коррозии бетона – это коррозия карбонизации или воздействие углекислого газа (СО2). Углекислый газ содержится в атмосфере. Его содержание составляет приблизительно 0,03% по объему. Также возможна коррозия и при действии других газовых сред. Например, в производственных помещениях присутствуют SО2, НСI, CI2, НF, NО2 и др. кислые газы, а также пары и аэрозоли кислот. Коррозия арматуры в случае газовой коррозии возможна в трех случаях, если: - защитный слой полностью разрушен; - защитный слой нейтрализован (карбонизирован); - защитный слой проницает для солей – активаторов. 2.11.2 Классификация газовых сред. Газы разделяют на группы: I группа - газы, образующие практически нерастворимые и малорастворимые соли кальция. Объем твердой фазы при этом несколько увеличивается, а проницаемость уменьшается. Малая растворимость продуктов реакции исключает их диффузию в глубь бетона. Прочность бетона при этом практически не изменяется. Коррозия арматуры начинается после нейтрализации защитного слоя. К ним относят: двуокись углерода, фтористый водород, фтористый кремний, фосфорный ангидрид, пары щавелевой кислоты. II группа - газы, образующие слаборастворимые соли, содержащие значительное количество кристаллизационной воды, что сопровождается увеличением V твердой фазы и уплотнением бетона. При этом возможна дегратация защитного слоя или его нейтрализация. К ним относят: сернистый и серный ангидрит, сероводород. III группа - газы, образующие хорошо растворимые гигроскопические соли (хлористый водород, хлор, двуокись хлора, поры брома и йода; окислы азота, поры азотной кислоты и др.) При повышении относительной влажности воздуха гигроскопические соли образуют растворы, проникающие за счет капиллярного всасывания либо диффузия в глубину бетона. Образующиеся соли могут быть агрессивными (например: СаСI) или нейтральными (например: Са(NО3)2) по отношению к арматуре. Таблица 17 – Классификация газовых сред
2.11.3 Кинетика нейтрализации (карбонизации) бетона Опасность нейтрализации бетона связана в первую очередь с тем, что снижение рН среды вызывает депассивацию стальной арматуры. Также следует учитывать, что при карбонизации электропроводность бетона снижается в 3-4 раза. Процесс карбонизации включает следующие стадии: – диффузию СО2 в порах и капиллярах бетона, заполненных воздухом; – растворение СО2 в жидкой фазе с образованием угольной кислоты: СО2+Н2О – взаимодействие кислоты с образование карбоната и бикарбоната кальция
Са(ОН)2+ Н2СО3→СаСО3+2Н2О СаСО3+Н2СО3→Са(НСО3)2 – кристаллизация карбоната кальция. Общая формула для расчета кинетики карбонизации бетона имеет вид: Х = где Х – толщина карбонизированного слоя; D – эффективный коэффициент диффузии, характеризующий проницаемость; m0 – способность бетона поглощать углекислоту, зависящий от расхода цемента, степени гидратации, структуры пор; С0 – концентрация СО2 t – время При известных сроках эксплуатации (t), и глубине нейтрализации (Х 1) легко рассчитать глубину нейтрализации бетона (Х 2) в любой другой срок: Х 2= Х 1 Существуют зависимости, связывающие глубину карбонизации бетона (Х) с технологическими параметрами. Например, формула Кашитами: T= 2.11.4 Влияние вида вяжущего на глубину нейтрализации бетона Относительная глубина карбонизации для различных вяжущих: Портландцемент 1 БТЦ 0,6 ШПЦ (30-40% шлака) 0,6 Цемент с 20% золы 1,9
Пуццолановый ПЦ с 5% 0,7 10% 0,78 15% и добавки 1,14 Без добавки 1 0,15% ССБ 0,75 0,08% милонифт 0,25 0,05% ГКЖ-94 0,25 2,5-4% ННК 0,35-0,40
|
||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 398; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.58.151.231 (0.022 с.) |
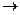 Ме+·nН2О+ē;
Ме+·nН2О+ē; или Х =А
или Х =А 
 ;
;



