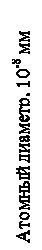Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Условия, влияющие на фазовое равновесие
Существующие теории твёрдого тела пока не в состоянии описать влияние многочисленных факторов, определяющих фазовое равновесие сплавов и особенности их структурного состояния. Поэтому в материаловедении широко используются полуэмпирические модели, наиболее полно отражаемые так называемыми правилами Юм-Роззери относительно пределов растворимости в твёрдом состоянии и в какой-то мере закономерностей распространения и стабильности химических соединений. Эти правила состоят в учёте трёх разных факторов. Размерный фактор. При различии размеров элементов свыше примерно 14-15 % растворимость их в твёрдом растворе должна быть ограниченной тем больше, чем больше это различие. На рис. 6 размеры атомов широко используемых элементов. Там же указан интервал благоприятных размеров, когда размерный фактор не накладывает ограничений на растворимость различных элементов в железе. Расположение элементов в зоне благоприятных размеров является лишь необходимым условием неограниченной растворимости.
Рис. 6. Влияние размерного фактора на способность к образованию твёрдых растворов на основе железа
Достаточным его можно считать, если отсутствует влияние других факторов. Эффект элетроотрицательной валентности. Образование устойчивых химических соединений, сужающих область ограниченных твёрдых растворов, определяется химическим сродством элементов, зависящим от их электроотрицательности. Электроотрицательность элемента является мерой способности его атомов принимать валентные электроны. Химическое сродство и устойчивость химического соединения тем больше, чем более электроотрицателен один элемент и электроположителен другой. Фактор относительной валентности. Данный фактор связывает растворимость одного элемента в другом с различием их валентности (см. табл. 2). Растворимость в элементе с меньшей валентностью всегда больше, чем в элементе с большей валентностью. Следует отметить, что понятие промежуточной фазы шире понятия химического соединения. Оно включает в себя и интерметаллические фазы Лавеса состава АВ2, имеющие кубическую решётку типа MgCu2, гексагональные решётки типа MgZn2 и MgNi2 и играющие большую роль в жаропрочных сталях. Исследования показали, что основным фактором образования фаз Лавеса является всё же соотношение размеров атомов входящих в них элементов.
Структуры с дальним и ближним упорядочением не относят к промежуточным. Для них основным фактором является тот, который характерен для неупорядоченного твёрдого раствора. Перечисленные факторы определяют равновесное фазовое состояние, вытекающее из условий термодинамики. Оно достигается после достаточно длительной выдержки при определённой температуре путём перестройки структуры, для чего, как правило, необходима диффузия. Поскольку диффузия в сильной степени зависит от температуры, построение диаграмм равновесного состояния в низкотемпературной области весьма проблематично. В этих случаях диаграммы могут отражать метастабильные состояния, которые могут быть переведены в стабильные посредством искусственного усиления диффузии (к примеру, облучением материала). Вместе с тем управление диффузией как кинетическим фактором можно использовать для полного или частичного «замораживания» фаз, присущих сплаву при высокой температуре, путём его быстрого охлаждения. Такие приёмы нашли применение в технологии получения материалов с заданными свойствами. На процесс диффузии в сплавах оказывают влияние различия свойств входящих в него элементов, примесей. В этом случае к атомам базовым элементов применяют понятие самодиффузии, к атомам легирующих добавок и примеси – понятие просто диффузии. Как и в чистых металлах, в сплавах миграция вакансий обуславливает превалирующее влияние на диффузионный процесс.
Фазовые превращения Затвердевание Фазовый переход такого рода определяется отводом тепла из расплава. В результате образуется вещество с кристаллической или аморфной структурой. В первом случае переход начинается с образования зародышей твёрдой фазы. Вторая стадия состоит в их росте. Различают гомогенный и гетерогенный способ образования зародышей. Однако гомогенный способ реализуется весьма редко – при затвердевании воды и капелек ртути. Из формальной теории гетерогенного зародышеобразования следует, что его скорость максимальна при критическом переохлаждении, близком для металлов с ГЦК и ОЦК решётками к 0,18 Тм (Тм – температура плавления в К).
Экспериментально установлено влияние механических воздействий (колебания жидкости, наличие её потока), электрических и магнитных полей на рассматриваемый процесс. Между жидкой фазой и зародышем твёрдой фазы иной плотности существует переходная область, называемая диффузной границей. Её продвижение может происходить за счёт бокового движения ступенек, источником которых являются винтовые дислокации. Если термодинамика обуславливает большие движущие силы, продвигается вся граница. Максимальная скорость роста зародышей тоже наблюдается при критическом переохлаждении, но оно соответствует более высокой температуре, чем при процессе их зарождения (рис. 7). Различие температурных зависимостей развития обоих стадий кристаллизации приводит к тому, что с ростом степени переохлаждения величина зерна уменьшается. Снижение скоростей образования и роста зародышей при глубоком переохлаждении связано с ограничением подвижности атомов. Степень кристаллизации при заданной температуре со временем увеличивается вначале с увеличивающейся скоростью за счёт роста числа зародышей, а впоследствии всё медленнее из-за соприкосновения кристаллитов. Движущей силой рассматриваемого фазового перехода, как и других фазовых превращений, является стремление к минимуму свободной энергии вещества (энергии Гиббса). Однако при этом требуются затраты энергии на образование поверхностей раздела. Эти затраты должны быть меньше выигрыша, получаемого при возникновении новой фазы.
Переохлаждение, оС
Рис. 7. Зависимости скорости образования зародышей (1) и скорости их роста (2) от степени переохлаждения
С этих позиций зародыши малого объёма неустойчивы. Чтобы сохраниться и расти дальше, их изначальный размер должен быть равен или больше критического. С понижением температуры уменьшается критический размер, увеличивается число центров кристаллизации, образующихся в единицу времени (восходящая ветвь кривой (1) на рис. 7) и ускоряется процесс кристаллизации в целом. На форму кристаллических образований также влияет скорость и направление отвода тепла, наличие нерастворившихся частиц (центров кристаллизации), конвекционных токов жидкости и т.д. Наблюдается образование характерных для литого металла древовидных кристаллов (дендритов) со стволом, от которого идут ветви. Наложение ряда факторов приводит к характерному распределению зёрен в стальной отливке. В наружной зоне образуется мелкозернистая корка. Вторая зона – зона столбчатых кристаллов, прорастающих вглубь слитка. В третьей, серединной зоне вырастают равноосные кристаллы. Из-за большей плотности твёрдой фазы наблюдаются усадочные раковины, сконцентрированные (спокойная сталь) и разбросанные по объёму слитка (кипящая сталь). Эти особенности структуры видоизменяются последующей обработкой давлением. Существуют различные специальные режимы кристаллизации материала, связанные с решением той или иной задачи. Чаще всего задача состоит в обеспечении определённого распределения примеси в слитке. Для этого его расплавляют и постепенно охлаждают, начиная с одного конца (нормальная кристаллизация). При этом возможно перемешивание жидкости. Другой способ состоит в расплавлении одного участка (зонная плавка) и продвижении его по всему слитку. Данные способы используют и для выращивания монокристаллов. Если их усложнить присутствием и паровой фазы, можно выращивать монокристаллы разных экзотических форм. Переход из жидкого в твёрдое аморфное состояние равносилен образованию переохлаждённой загустевшей жидкости. В этом случае отсутствуют определённые температура плавления и кристаллическая структура.
|
||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 232; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.114.38 (0.008 с.) |