
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Гравиметрический (весовой) анализ
В этой теме следует остановиться, на сущности и области применения гравиметрического анализа, последовательности операций. Усвоить расчеты весового аи ал из а, изучить правила взвешивания на аналитических весах. Важно знать весовой метод определения содержания кремния в чугуне, стандартные образцы для определения содержания кремния, отклонения, допускаемые по ГОСТу при данном методе. Следует изучить и руководствоваться правилами охраны труда, техники безопасности и противопожарной защиты при работе в хим. лаборатории, мероприятия по охране окружающей среды. В гравиметрическом (весовом) анализе количественный достав анализируемого вещества определяют путей прямого измерения массы взвешиванием. Наиболее распространен вариант весового анализа, по которому последовательно проводят следующие операции: взвешивание анализируемого вещества, его растворение,осаждение, промывка осадка, высушивание, прокаливание, взвешивание, расчет.-л Разберем расчет результатов весового анализа, Осадок, взвешенный после прокаливания на аналитических весах до 0,0002, называется весовой формой и обозначается а. Часто химическая формула весовой формы не соответствует 24 формуле определяемого вещества. Для пересчета применяют аналитический множитель (фактор пересчета) - F(f), Фактор пересчета - это отношение эквивалентных масс определяемого компонента и его весовой формы
где
п, m - коэффициенты.
Пример 3.1.1. Определить фактор пересчета для определения железа Fе по FегО3.
Пример 3.1.2. Из навески магнезита получено 0,2164 г осадка МgгРгОг. Найти массу магния в навеске. Решение Определим фактор пересчета из формулы (3, 1.1)
Находим содержание магния по формуле
где а. - масса весовой формы тMg = 0,2164-0,2185 = 0,04729 г Пример 3.1.3. При анализе 0,8105г сплава получен осадок .А{гО-, масса которого равна 0,05008г.Определить массовую долю (в %) алюминия в сплаве. Р е ш е н и е Весовая форма * АlеО,. определяемый компонент - алюминий; масса навески, т.= 0,8105г. Находим фактор пересчета из формулы (3.1.1)
Подставим в формулу (3.1.2) и найден массу алюминия
Составим пропорцию:
Ответ: 32,69. Для решения подобных задач проще воспользоваться формулой для определения процентного содержания определяемого компонента
3.2. Титриметрический (объемный) анализ Титриметрический анализ основан на точном измерении объема раствора реагента известной концентрации, израсходованного на реакцию. В титрометрическом анализе устанавливают момент окончания реакции (точку эквивалентности) путем постоянного прибавления реагента известной концентрации к анализируемому раствору. Такая операция называется титрованием, а реагент известной концентрации - титрантом, стандартней или рабочим раствором. В титриметркческом анализе ваяло точно определить объем рабочего раствора и его концентрацию. Способы выражения концентрации рабочего раствора Процентная концентрация показывает, сколько граммов растворенного вещества находится в 100г его раствора. Например, 10% раствор Молярная концентрация, или молярность, показывает, сколько молей растворенного вещество находится в литре раствора. Обозначается Ся или М. Например: Сн «0,2 моль/л означает, что в I литре этого раствора содержится 0,2 моля растворенного веществе. Молярная концентрация эквивалентов (нормальная концентрация) также выражается моль/л. Например, для серной кислот» С(1/2 Н2S0.4) = I моль/л. Означается С(1/*А). Растворы с молярной концентрацией эквивалентов называют нормальными. Например, Титр раствора (Т) показывает, сколько граммов растворенного вещества находится в I миллилитре раствора, размерность г/мл. Например: Т Иногда выражает титр в граммах определяемого вещества. Такой титр называют титром по определяемому веществу. Например, В титрометрическом анализе широко пользуются эквивалентной массой. Поэтому полезно не вспомнить, как находят эквивалентные массы некоторых веществ. Эквивалентом называют такую формульную единицу (честь атома, молекуле, иона), которая равноценна по химическому действию одному атому водорода в данной реакции.
Для некоторого вещества А формула эквивалента имеет вид % А, где '/а называют фактором эквивалентности, а г - числом эквивалентности, "например. эквивалент серной кислоты записывается так: М('/1 ^Щ) = '/г М(Н,ЗЦ)= — - «г- ноль. Если происходит окислительно-восстановительная реакция, тогда эквиваленты окислителей и восстановителей находя? делением мольной массы на число электронов, отданных или приобретенных в процессе реакции, т.е.,2 - число эквивалентности совпадает с числом электронов. Пример 3.2.1.0пределить эквиваленты окислителя и восстановителя в реакции Напишем электронные уравнения
Напишем электронные уравнения. Окислительно-восстановительные реакции
Две молекулы тиосульфата
Эквивалент иода равен Пересчет концентрации раствора из одних единиц в другие
Пересчет концентрации раствора из одних единиц в другие
Пример 3.2.2. Нормальность Решение Мольная масса Подставляем в формулу (3.2.1),
Пример 3.2.1. Титр соляной кислоты по соде Решение Из формулы выведем С(НСl, Z=1
Мольная масса соды 106. Тогда
Расчеты по результатам титрования Во всякой химической реакции в точке эквивалентности число грамм-эквивалентов одного из реагирующих веществ (п) всегда равно числу грамм-эквивалентов другого na =nb Отсюда, зная число грамм-эквивалентов одного вещества, легко определить и число граммов другого вещества, реагирующего о первым. Расчет числа грамм-эквивалентов
Пример 3.2,4. Ни нейтрализацию 25 мл раствора КОН израсходовано 20,5 мл 0,2н //С/".Чему равна нормальность раствора КОН? Решение Запишем уравнение реакции: KOH+HCl = KCl+H2O По закону эквивалентов nKOH=nHCl Для расчета числа грамм-эквивалентов применим формулу (3.2.2)
Ответ: нормальность раствора КОН равна 0,1640 моль/л. Пример 3.2.5, Определить массу гидрооксида натрия содержится в 1 л его 0,1н раствора. Решение Используем формулу (3.2.2)
Отсюда найдем массу NаОН, учитывая, что V = 1000 мл
Пример 3.2.6. На нейтрализацию раствора КОН израсходовано 25 мл 0,1н HCl. Сколько по массе КОН содержалось в растворе? Решение Можно решить двумя способами. 1-й способ. Но закону эквивалентов nKOH=nHCl Применим формулу (3.2.2)
2-й способ. Найдем титр по определяемому веществу КОН:
Значит, I мл рабочего раствора НСl оттитровывает 0,00056 г КОН, а по условию израсходовано 25 мл HCl
К наученной теме относятся вопросы контрольной работы № 73-90. Литература: [3], с. 247, 254-263; [4], 0.92-96,114-119; [7], с. 112-122;[10],раздел 5.2. 3.2.1. Метод нейтрализации 3,2,1 Метод нейтрализации Изучите следующие вопросы: сущность метода, особенности установления точки эквивалентности, стандартные растворы метода нейтрализации. Вычисление концентраций ионов водорода и рН в водных растворах сильных кислот и оснований. Теория индикаторов. Кривая титрования сильной кислоты сильной щелочью. Выбор индикатора. Расчёты в методе нейтрализации аналогичны примерам, приведённым в темах 2.1 и 3.2. Пример 3.2.1.1. Найти рОН 0,02н раствора Н2SO4
Решим уравнение диссоциации: Н2SO4=2H++SO42- Предел находим рН. Для этого необходимо найти молярную концентрацию раствора Н2SO4 (см. тему 3.2)
Находим рН по формуле (2. 4), тема 2.1, [H+ ]=2CM
В контрольной работе I r этой теме относятся вопросы № 91-100. Литература: [З],с.269-282; [4], ч. 2,c.167-171, 179-184, 191-202; [7]. с.122-127;[8],c.190-201. 3.2.2. Метод онсидиметрии Окислительно-восстановительный анализ основан на применении окислительно-восстановительных реакций (см. тема 2.2). Количественной мерой окислительной способности, т.е. то, какой восстановитель (окислитель) сильнее или слабее, служат окислительно - восстановительные потенциалы, Е, измеряемые в вольтах Стандартные потенциалы найдены экспериментально для большинства окислительных и восстановительных процессов и сведены в таблицы, Система о большим стандартным потенциалом будет окислителем, с меньшим - восстановителем.
Решение Ориентируясь на пример 2.2.2, составим уравнение реакции и уравняем ионно-электронным методом:
Реакция может протекать в прямом к обратном направлении. Чтобы установить направление, находим стандартные потенциалы для двух систем: Мn7+. /Мл2+ в среде H+ и 2Br-/Br2 по таблице 7 [6] или таблице 9 приложение [10]. Е Мл'/Мп' = + 1,52В и Е1&/Ь1= 1,065В, Потенциал системы Е Мn7+. /Мл2=+1,52В и Е 2Br-/Br2 =1,065В Потенциал системы Мn7+. /Мл2+ больше, значит в дайной реакции перманганат будет являться окислителем, а KBr -востоновителем. Реакция протекает в прямом направлении. Пример 3,2.2.2. Какую массу KМпO4 следует взять при приготовлении 1,5 л 0,2 H раствора в кислой среде? Решение Массу KМпO4 найдем по формуле (3.2.2)
Определим эквивалент KMnO4 в кислой среде аналогично примеру 3.2.1, тема 3.2
В контрольной работе на знание этой темы рассчитаны вопросы № 101-114. Литература: [3],с. 299-303, 306-310;[4],ч. 2,с. 119-124, 138 145-159; [5],с.178-183;[7],с. 132-140; [8],с. 217-222, 226-230, 340;[10]раздел 5.2.5. Метод комплексонометрии Изучите следующие вопросы: "комплексные и внутрикомплексные соединения - комплексоны. Трилон Б и трилонометрические определения. Комплексонометрические индикаторы. Промышленное значение метода. Ппкмер.3.2.3.1. Рассчитать общую жесткость воды, если на 200 мл анализируемой воды расходуется 10 мл 0,05Н раствора трилона Б. Решение Общую жесткость вычисляют по формуле
где С(1/2Т)-нормальность раствора трилона Б, VT- расход раствора трилона Б, мл
Вопросы № 115-120 контрольной работы предполагают знание данной темы. Литература: [3],с.321-325;[ 4],о.237-241, 243;[7],с. 144-146; [8], с. 204-208. КОНТРОЛЬНАЯ РАБОТА I 1. Что изучает предмет "Химические и физико-химические методы анализа"? 2. Охарактеризуйте химические, физико-химические и физические методы анализе как методы аналитического контроля сталей, чугунов, металлургических порошков и газов. 3. Какие мероприятия по технике безопасности в противопожарной защите проводятся в лабораториях аналитического контроля? 4. Какие меры предпринимаются по защите окружающей среды при проведении анализов влабораториях аналитического контроля? 5. Что такое измерение? Методы измерений. Что такое точность и единство измерений? 6. В ней причина ошибок, допущении в измерениях? Охарактеризуйте типы ошибок. 7. Объясните, что такое сходимость, воспроизводимость и правильность измерений. Какой величиной можно охарактеризовали воспроизводимость метода? 8. Охарактеризуйте статистические оценки ошибок; среднее и среднее квадратичное отклонения. 9. Объясните, что такое дисперсия и что она характеризует. 10. 0бьясните, что такое стандартное отклонение единичного измерения и среднего значения. Что характеризует эта величины? 11. Как и по неким критериям можно выявить грубые ошибки, допущенные в измерениях? 12. Объясните, что означает коэффициент Студента и почему его применяют в методах математической статистики? 13. Что такое точность измерений? Как можно рассчитать точность? 14. Объясните понятие "доверительный интервал"; что он означает, как можно рассчитать его. 15. Дня чего применяют метод математической статистики при обработке результатов измерений? Приведите схему метода. 16. Как можно выявить систематические ошибки, допущенные в измерениях? Приведите схему обработки результатов измерений методом математической статистики. 17. При испытании партии каолина на содержание SiO2, получены результаты (%): 42,2; 41,9; 42,4; 43,5; 42,4; 42,0.0пределите наличие грубых ошибок по критерию Q при α = 0,95 и вычислите среднее арифметическое содержания диоксида кремния в каолине. 18. При определении содержания хрома в стали получены результаты (г): 0,635; 0,632; 0,636; 0,639; 0,634, Определите наличие грубых ошибок по критерию Qпри α = 0,95 и вычислите дисперсию для ограниченного числа измерении. 19. Определение влаги в навеске 2,500г силикатов методом высушивания показало потерю в массе для шести проб (г): 0,1722; 0,1734; 0,1730; 0,1720; 0,1725 и 0.1724. Вычислите среднее квадратическое отклонение. 20. При анализе каменного угля получили массу золы (г): 0.5122; 0.5136; 0;5120; 0,5123; 0,5150; 0,5124. Определите наличие грубых ошибок в полученных результатах по критерию Q и вычислите среднее арифметическое. 21. При определении серы в виде ВаSО4 в каменном угле гравиметрическим методом были получены результаты (%): 3,14; 3,20; 3,22; 3,16; 3,12. Вычислите дисперсию определения и точность определения при α = 0,95% 22. Не титрование 20,00 мл NaOH было израсходовано раствора H2SO4(мл): 20,42; 20,46; 20,40; 20,55; 20,45; 20,40;20,45.
Определите наличие грубых ошибок по критерию Qпри α = 0,95% вычислите дисперсию, стандартное отклонение единичного определения и стандартное отклонение от среднего арифметического. 23. Определение олова в бронзе проводили гравиметрическим методом в виде SпОг, Маccа SпО2 составляла (г): 0,04856; 0,04651; 0,04853; 0,04852; 0.04850; 0,04851; 0,04856 и 0,04855. Вычислите стандартное отклонение и точность определения массы SnО2, α = 0,95 24. Содержание серы в каменном угле, определяемое гравиметрическим методом, составило (%) г 3,14; 3,20; 3,22; 3,16; 3,12; 3,18 и 3,20. Вычислите стандартное отклонение единичного определения и доверительный интервал определения серы при α = 0,95. 25. Результаты определения молибдена в стали фотоколориметрическим методом составили (%): 0,49; 0,48; 0,48; 0,47; 0,50; 0,49; 0,47; 0,50; 0,49; 0,47; 0,48; 0,47; 0,46. Рассчитайте стандартное отклонение единичного определения и доверительный интервал определения при α = 0,95% 26.Температура плавления органического вещества (0С):73,25; 73,50; 73,35; 73,25; 73,40; 73,50, Вычислите среднее квадратическое отклонение и доверительный интервал определения при α = 0,95% 27.Объясните, что означает унификация и стандартизация аналитического контроля. 28.Приведите и объясните производственную классификацию методов технического анализа. 29. Охарактеризуйте маркировочные виды анализов. Привадите примеры. 30. Охарактеризуйте и приведите примеры экспрессных видов анализов. 31. Охарактеризуйте контрольные и арбитражные виды анализов, 32. Стандартные образцы в их назначение. Виды стандартных образцов. 33. Объясните, как производится отбор пробы сыпучих материалов (руда, концентрат) для анализа. 34..Объясните, как производится отбор пробы металлов или сплавов для анализа. 35. Охарактеризуйте: метод переведения в раствор сырья (руды, концентрата) для дальнейшего анализа. 36. Охарактеризуйте методы растворения металлов к сплавов для дальнейшего анализа 37. Стандарты (ГОСТы) на методы анализа и их назначение. 38. От чего зависит скорость реакции? Как влияет на скорость реакции концентрация? 39. Объясните закон действующих масс и запишите выражение скорости реакции. 40. Что такое константа равновесия химической реакции? Как она выражается? 41. Что такое электролитическая диссоциация, степень электролитической диссоциации? Какие электролиты называют сильными, какие слабыми? 42. Что такое водородный и гидроксильный показатели? Что характеризует, и от чего они зависят? 43. Что назевается произведением растворимости? Как его выражают? 44. Как изменится скорость прямой реакции 45. Как изменится скорость прямой реакции 46. Вычислите степень диссоциации 0,5М раствора уксусной кислоты, если концентрация ионов водорода в нем 2,5×104 г-ион/л. 47. Вычислите концентрацию ионов водорода в 0,1М раствора угольной кислоты, если степень диссоциации равна 0,3% 48. Вычислите рН раствора, содержащего ноны гидроксила ОН- в количестве 5,4 ∙ 10-4 г-ион/л. 49. Вычислите рН раствора, содержащего ионы водорода в количестве 7,4∙10-5г-ион/л 50. Вычислите концентрацию Н+- ионов водорода в водном растворе, если ОН- равна 2∙10-4 г -ион/л. 51. Уравняйте, составьте электронные схемы, укажите окислитель и восстановитель в реакциях:
52. Закончить уравнение реакции: уравняете, составьте электронные схемы: 53. Уравняйте помощью ионно-электронного метода, укажите восстановитель и окислитель в реакциях:
54. Уравняйте, составьте электронные схемы, укажите восстановитель и окислитель в реакциях:
55. Составьте в молекулярной иионной формах уравнения следующих реакций и укажите окислитель и восстановитель:
56. Составьте уравнения следующих окислительно-восстановительных реакций: 1. Реакция окисления сульфита натрия перманганатом калия в нейтральной среде. 2. Реакция взаимодействия сульфата хрома (III) хлорной водой в щелочном растворе. 57. В чем состоит основная задача качественного анализа? Охарактеризуйте методы качественного анализа. 58. Охарактеризуйте методы качественного анализа по количеству исследуемой пробы. 63. Что такое специфичность и чувствительность реакции? Чем характеризуется чувствительность? 60. Объясните сероводородную классификацию катионов в качественном анализе. 61. Охарактеризуйте дробный и систематический качественный анализ. 62. Объясните, в чем заключается сущность гравиметрического (весового) анализа; его точность, область применения. 63. Что такое фактор пересчета весового анализа? Что он означает, и как его рассчитывают? 64. Кратко охарактеризуйте последовательность операций гравиметрического анализа (взвешивание, растворение, осаждение, промывание, прокаливание). 65. При анализе серебра гравиметрическим методом получено 0,3652 г. AgCl. Определите содержание серебра в граммах. 66. Взята навеска 1,0150 г каменного угля. После анализа гравиметрическим методом прокаленный осадок BaSO4 составил О,289 г.Вычислите процентное содержание серы в образце. 67. Из навески алюминиевого сплава получен, в результате гравиметрического анализа осадок Al 2O3 0,0984 г. Вычислите (в %) содержание Al. в сплаве, если навеска была 0,4524г. 68. Гравиметрическому анализу подвергался красный железняк. После прокаливания масса осадка Fe2O3 равна 0,5390 г. Каково (в %) содержание железа и Fe2O3 в образце, если навеска, взятая для анализа, составила 0,6582 г.? 69. Вычислите фактор пересчёта в весовом анализе для определения Al, Al2(SO4)3, AlCl3, по Al2O3. 70. Вычислите фактор пересчета для определения Fе, FeО, FeCl3 по Fe2O3 71. Для гравиметрического анализа магнитного железняка взята навеска 0, 6012 г. Железняк превращен в осадок Fe2O3 массой 0,4520г. Вычислите массовую долю (в %) Fе и Fе3O4 в образце- 72. Сущность титриметрического анализа. классификация методов. 73. Охарактеризуйте способы выражения концентрации рабочего раствора в титриметрическом анализе. 74. Охарактеризуйте требования к реакциям, применяемым в титриметрическом анализе. 75. Охарактеризуйте способы приготовления рабочих растворов в титриметрическом анализе. 76. Определите эквиваленты кислот и оснований в реакциях: 77. Определите эквиваленты исходных солей в реакциях:
78. Определите эквиваленты кислот, оснований и солей в реакциях:
79. Титр серной кислоты равен 0,00245 г/мл. Каково нормальность и титр по гидроксиду калия? 80. Титр фосфорной кислоты по соде 81. Титр HNO3 = 0,00315 г/мл. Какова нормальность и титр по гидроксиду кальция? 82. Нормальность раствора серной кислоты Н2SO4 равна 0,1н. Каков титр Н2SO4 и титр по гидрооксиду натрия? 83. 50 мл раствора Н2SO4 реагируют нацело с 46,65 мл 0,1н Nа ОН. Каковы нормальность и титр раствора Н2SO4 84. К 25,6 мл соляной кислоты прибавлено 25 мл 0,1200н NаОН от чего среда стала нейтральной. Каковы нормальность и титр раствора HCl? 85. Какая масса NаОН содержится в растворе, на нейтрализацию которого израсходовано 15,5 мл 0,5н НСl? 86. Какая масса Н2SO4 содержится в растворе, на нейтрализацию которого израсходовано 17,2 мл 0,3н КОН? 87. На нейтрализацию навески 1,0 г технической серной кислоты расходуется 10 мл 2н NаОН. Вычислите процентное содержание Н2SO4 в образце. 88. На нейтрализацию раствора, содержащего 1,0 г каустической соды, израсходовано 20 мл 1н HС1. Вычислите процентное содержание NаОН в образце. 89. Сколько грамм-эквивалентов содержится: 1) в навеске 1,1 г Н3PO4 2) в 15 мл 0,2н растворе Са(ОН)2. Дайте определение понятия "грамм-эквивалент". 90. В чем сущность метода нейтрализации? Как устанавливают в этом методе точку эквивалентности (момент окончания реакции)? 91. Какие рабочие растворы и индикаторы применяются в методе нейтрализации? Что такое показатель титрования индикатора? 92. Объясните основные положения ионной теории индикаторов, ее достоинства и недостатки. 93. Постройте и объясните кривую титрования сильной кислоты сильной щелочью. Как по кривой титрования можно подобрать индикатор? 94. Объясните, как готовят рабочие растворы кислот и щелочей при применении метода нейтрализации. Как можно определить нормальность этих растворов? 95. Что такое рН раствора? Определите рН 0,01н раствора КОН. 96. Вычислите рН следующих растворов: 1) 0,015н раствора Н2SO4 2) 0,02н раствора NаОН. 97. Чему равны нормальность и титр раствора НNО3, если на титрование 25,0 мл этого раствора израсходовано 15 мл 0.12Н раствора NаОН? Какой индикатор следует выбирать для определения точки эквивалентности при титровании? 98. Какая масса Н3PO4 содержится в данном растворе, если при титровании его до полной нейтрализации израсходовано 25 мл 0,200н растворе NаОН? Какой индикатор следует выбирать в данной подаче для установления момента окончания титрования? 99. Какая масса NН4ОН содержится в 20 мл его раствора, если на титрование затрачено 15,2 мл. 0,1н раствора НCl. Какой следует выбрать индикатор для определения точки эквивалентности при данном титровании? 100. В чем сущность метода пермангонатометрии? Укажите достоинства и недостатки этого метода. 101. В чем сущность метода йодометрии? Перечислите и объясните его достоинства, недостатки, применение. 102. Охарактеризуйте реакции окисления перманганатом в различиях средах. Рассчитайте эквивалент КМпО4 в этих реакциях. 103. Как готовят титрованный раствор КМnО4? По каким веществам устанавливают нормальность КМпО4. Приведите реакции. 104. Что такое окислительно-восстановительный потенциал? Его применение в окислительно-восстановительном методе. 105. Как проводятся перманганатометрические определения восстановителей? Объясните на примере. 106. Как проводятся йодометрические определения окислителей и восстановителей? Объясните на примерах. 107. В каком направлении должна протекать реакция. Уравнять электронным методом.
108. Уравнять электронным методом реакцию и указать, в каком направлении она будет протекать.
и указать, в каких направлениях будет протекать эта реакция. 109. Уравнять ионно-электронным методом реакцию
указать, в каких направлениях будет протекать эта реакция. 110. Какую массу химически чистого (х.ч.) йода следует взять для приготовления 500 мл 0,1н раствора? Но каким веществам можно установить нормальность иода? 111. Какая масса KMnO4 потребуется для приготовления I л раствора, титр которого равен 0,00161 г/мл? По каким веществам можно устанавливать нормальность перманганата? 112. Какую массу KMnO4 следует взять для приготовления 500 мл раствора, у которого И уравнять ионно-электронным методом, 113. Записать и объяснить реакции, протекающие при определении содержания марганца персульфатно-серебряным методом. 114. В чем сущность метода комплексонометрии? Область применения. 115. Охарактеризовать определение общей жесткости воды методом комплексонометрии. Какое значение имеет в этом методе величина рН раствора? 116. Какими свойствами обладают индикаторы, применяемые в комплексонометрии? Приведите примеры индикаторов. 117. Что такое общая жёсткость воды? Рассчитайте общую жесткость, если на 100 мл анализируемой воды расходуется 25 мл 0,05 н раствора трилона Б. 118. В каких единицах измеряется общая жесткость воды? Рассчитайте общую жесткость воды, если не титрование 100 мл воды пошло 15,5 ни 0,1н раствора трилона Б. 119. Что представляет собой Трилон Б? Рассчитайте общую жесткость воды, если для анализа взяли 200 ил воды, а на титрование израсходовано 10 мл 0,1н раствора трилона Б. 120. Определите произведение растворимости ПРAgBr если концентрации ионов Аg+ и Вr- в насыщенном растворе равны 5.3*10-7 г -ион/л. 121. ОпределитеПРAg2с2О4 если концентрации ионов Аg+ и С2О42- равны соответственно 2,15-10-4 г-ион /л;1,076-10-4 г-ион/л.
ТАБЛИЦА ВЫБОРА ВАРИАНТОВ КОНТРОЛЬНОЙ РАБОТЫ 1.
ЗАДАНИЕ II КРАТКИЕ МЕТОДИЧЕСКИЕ УКАЗАНИЯ 4.1. Общая характеристика физико-химических методов анализа В начале распространенных физико-химических методах определяются оптические или электрические свойства, зависящие от концентрации искомого вещества в растворе, К оптическим методам относятся фотометрические методы анализа: фотоколориметрия, спектрофотомерия и др. К электрохимическим относятся, в частности, потенциометрический, полярографический (вольт-амперометрический), кондуктометрический, кулонометрический методы анализа. Следует изучить преимущества физико-химических методов по сравнению с химическими методами анализа, область применения в контроле металлургического производства, их роль в службе защиты окружающей среды. Обратите внимание на соблюдение правил техника безопасности и противопожарной защиты при проведении физико-химических методов анализа. Литература:[2],с.4-б;1;[7],с.;194-196;[4],Ч,П.о.245;[9],о,7-10. 4.2. Фотометрические методы анализа 4.2.1. Фотоколориметрический метод В колориметрическом анализе измеряют поглощение видимой области (т.е.белого спета) окрашенными растворами. О поглощении света судят визуальным (т.е. нашими глазами) сравнением интенсивности окраски. В спектрофотометрическом анализе измеряют поглощение не широкого участка видимой области, как в колориметрии, а поглощение монохроматического излучения, т.е. изучения определенной длины волны. Такое излучение получает в приборах-спектрофтометрах и в фотоэлектроколориметрах. Основной закон фотометрии Когда световой поток проходит через раствор, поглощение света зависит от двух факторов - концентрации раствора и толщины слоя, через который проходит световой поток. Эту зависимость выражает закон Вугера-Лаиберта-Бера,называемый также объединенным законом фотометрии: оптическая плотность растворов при прочих равных условиях прямо пропорциональна концентрации веществ и толщине поглощающего слоя.
4,3. Электрохимические методы анализа 4.3.1. Потенциометрический метод анализа и рН- метрия Потенциометрический метод анализа основание измерении потенциала электроде, погруженного в анализируемый раствор. Значение потенциала, возникающего на электродах. зависит от составе раствора.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 790; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.0.240 (0.228 с.) |

 - атомная (мольная) маccа определяемого компонента;
- атомная (мольная) маccа определяемого компонента; - мольная масса весовой формы;
- мольная масса весовой формы;
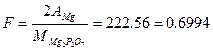


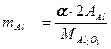
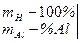


 раствор означает, что в 100 граммах раствора содержится 10 граммов
раствор означает, что в 100 граммах раствора содержится 10 граммов 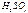 - 0,0049 означает. что 0.0049 безводной серной кислоты находится в I мл раствора.
- 0,0049 означает. что 0.0049 безводной серной кислоты находится в I мл раствора. означает, что I ил данного раствора соляной кисло™ равноценен (эквивалентен) 0, 0053г
означает, что I ил данного раствора соляной кисло™ равноценен (эквивалентен) 0, 0053г 

 восстановитель
восстановитель окислитель
окислитель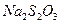 отдают два электрона, следовательно, эквивалент совпадает с молярной массой
отдают два электрона, следовательно, эквивалент совпадает с молярной массой = 158.
= 158.

 Рассчитать
Рассчитать 
 = 98. Эквивалент равен
= 98. Эквивалент равен

 в 0,0265 г/мл. Найти молярную концентрацию эквивалента (нормальность).
в 0,0265 г/мл. Найти молярную концентрацию эквивалента (нормальность).




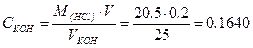
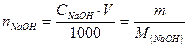 т.е.
т.е.  .
.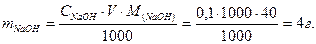
 ; отсюда
; отсюда 
 г/мл.
г/мл. г.
г. моль/л.
моль/л.

 Пример 3,2.2.1. В каком направлении будет протекать реакция КВr.+ КМпО4 + Н2SO4
Пример 3,2.2.1. В каком направлении будет протекать реакция КВr.+ КМпО4 + Н2SO4


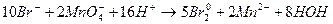



 г-моль
г-моль г.
г. ,
, ;
;
 , если концентрацию SO2 и О2 увеличить в 3 раза?
, если концентрацию SO2 и О2 увеличить в 3 раза? , если концентрация Н2 увеличилась в 2 раза?
, если концентрация Н2 увеличилась в 2 раза?




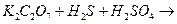



 равен 0,00265 г /мл. Какова нормальность и титр раствора H3PO4?
равен 0,00265 г /мл. Какова нормальность и титр раствора H3PO4?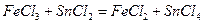


 =0,0033 г/мл? Записать уравнение реакции
=0,0033 г/мл? Записать уравнение реакции 



