
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Окисно-відновний потенціал, його визначення
Окисно-відновні процеси належать до найбільш розповсюджених хімічних реакцій і мають величезне значення в теорії та практиці. Окисно-відновні реакції протікають при багатьох технологічних процесах. Окисно-відновні реакції супроводжуються переміщенням електронів, вони об’єднують два протилежних процеси – окиснювання і відновлення. Ступінь відновлення чи окиснення середовища характеризується окисно-відновним потенціалом (ОВП). ОВП – це електричний потенціал, який виникає на електроді зануреного в розчин в якому проходить окисно-відновна реакція. Він характеризує інтенсивність притягування електронів до окисника, активність окисника і інтенсивність протікання окисно-відновної реакції.
ОВП залежить від потенціалу стандартного електроду (Ест), концентрації окисника (Сок) і відновника (Свід); виду хімічної реакції: виду речовин та середовища, де протікає реакція, кислотності. Його можна розрахувати за рівнянням Нернста. Визначають ОВП за допомогою потенціометра (рН-метра). Як вимірювальний електрод використовують платиновий типу ЭТПЛ-01М, електрод порівняння – хлор-срібний типу ЭВЛ-1МЗ. Потенціал на індикаторному електроді гальванічного елемента називається окисно-відновним потенціалом, позначається Еh і виражають у вольтах або через від’ємний десятковий логарифм парціального тиску молекулярного водню rH2. Показник rH2 дає уявлення про сумарний окисно-відновний стан середовища. Він характеризує в межах від 0 до 40 всі ступені відновлення чи окиснення середовища (від насичення його воднем чи киснем). rH2 = 0 відображає повне насичення середовища киснем, а rH2 = 40 відображає повне насичення його воднем. Від’ємний логарифм концентрації молекулярного водню rH2 вираховують за формулою:
де rH2 – від’ємний логарифм концентрації іонів водню; Еh – потенціал, який виникає у даному середовищі на платиновому електроді; 201 – поправка на потенціал хлор-срібного електроду по відношенню до водневого; 29 – коефіцієнт перерахунку, взятий з формули Нернста.
ПИТАННЯ ДЛЯ САМОПЕРЕВІРКИ 1. З якою метою визначають кислотність харчових продуктів? 2. Як впливає кислотність на якість харчових продуктів? 3. Що таке загальна та активна кислотність? 4. В яких одиницях виражається загальна кислотність?
5. Які джерела помилок існують при визначенні загальної кислотності? 6. Як розрахувати величину кислотності, що визначається за бовтанкою та водною витяжкою? 7. Яке значення має активна кислотність в харчових продуктах? 8. Якими методами визначають активну кислотність в харчових продуктах? 9. Що таке окисно-відновний потенціал? Його визначення. 10. Визначення активної кислотності за допомогою рН-метра рН-340. [1, с. 134-149, 3, с. 86-88] ЛЕКЦІЯ 3. МЕТОДИ ВИЗНАЧЕННЯ ВУГЛЕВОДІВ В ХАРЧОВИХ ПРОДУКТАХ План лекції 1. Теоретичні основи визначення вуглеводів в продуктах харчування. 2. Класифікація методів визначення вуглеводів. Сутність поляриметричного методу. 3. Хімічні методи визначення вуглеводів. 4. Визначення сахарів колориметричним та ферментативними методами.
|
|||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 220; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.74.54 (0.006 с.) |
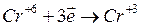 (2-3)
(2-3) (2.5)
(2.5)


