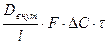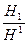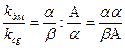Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Фізико-хімічні основи харчових технологій
1. Масообмінні процеси харчових технологій Процес екстрагування продовольчої сировини Екстрагування – найбільш поширений спосіб вилучення корисних речовин з харчової сировини за допомогою розчинника. Екстракція заснована на законі розподілу – вилучення речовини тим повніше, чим більше коефіцієнт його вилучення відрізняється від одиниці. Екстракція може бути однократною, коли екстрагент додається один раз, і дробною – додання екстрагенту проводиться порціями в декілька прийомів. У харчових виробництвах екстрагуванню піддають частіше сировину рослинного походження – фрукти, насіння олійних культур, цукровий буряк та ін. За фізичними властивостями ця сировини відноситься до твердих тіл. Перед екстрагуванням, рослинну сировину подрібнюють, при цьому частина рослинних клітин ушкоджується і внутрішньоклітинна речовина переходить у екстрагент. Але більшість клітин залишається неушкодженими, і речовина вилучається із сировини крізь клітинні мембрани у екстрагент за рахунок дифузії. Процес екстрагування можна здійснювати, зануривши підготовлену сировину у рідкий екстрагент. В цьому випадку концентрація речовини у сировині буде постійно зменшуватись, а у екстрагенті – збільшуватись. Процес екстрагування закінчиться, коли концентрація речовин у сировині і у екстракті зрівняється. При перемішуванні швидкість екстрагування зростає. Процес екстрагування можна проводити також шляхом пропускання екстрагента крізь нерухомий шар сировини тобто за рахунок фільтрації. Процес екстрагування може відбуватися шляхом протиточного надходження сировини і екстрагенту і їх незупинного переміщення. Взагалі процес екстрагування можна поділити на 4 стадії: – проникнення екстрагента у пори рослинної сировини; – розчинення вилучаємої речовини екстрагентом; – дифузійний перенос вилучаємої речовини до поверхні частинки сировини; – перенос вилученої сировини з поверхні сировини у рідку фазу, тобто екстрагент. При екстрагуванні соковитої рослинної сировини враховують швидкість переносу у середині частинки сировини – внутрішня дифузія, та швидкість переносу з поверхні твердого тіла у рідину екстрагенту – зовнішня дифузія. В залежності від величини опору процес дифузії може протікати по-різному.
У випадку, коли зовнішня дифузія перевищує швидкість внутрішньої дифузії. Тоді швидкість внутрішньої дифузії, яка обмежує швидкість екстрагування, визначається рівнянням М = де Dзов – коефіцієнт внутрішньої дифузії, м2/с; l – визначальний розмір часточок, м; F – сумарна поверхня сировини, м2; ΔС – різниця між середньою концентрацією речовини усередині сировини і середньою концентрацією речовини у розчині, який оточує сировину, кг/м3; τ – тривалість процесу, с. Цей процес здійснюється в апаратах активним перемішуванням фаз. Перенос речовини з внутрішньо - клітинної рідини за межі клітини здійснюється за рахунок молекулярної дифузії через багатошарову оболонку, яка складається з двох мембран, між яким знаходиться протоплазма. Рослинні клітини щільно оточені іншими клітинами і речовина з внутрішніх клітин повинна дифундувати через ці клітини, що свідчить про великий опір внутрішній дифузії. Для зменшення опору подрібнену сировину піддають тепловій, хімічній, ферментативній обробці або електроплазмолізу, що призводить до денатурації протоплазми і зростанню проникності оболонок рослинних клітин. У зв’язку з малим розміром клітин (5-50 мкм) і ще менших розмірів пор, по яких переноситься речовина, швидкість молекулярної дифузії навіть після попередньої обробки сировини набагато менша, ніж швидкість молекулярної дифузії цієї ж речовини у чистій речовині. Тому D називають коефіцієнтом масопровідності, який входить у дифузійний критерій Біо. У випадку, коли швидкість внутрішньої дифузії перевищує швидкість зовнішньої дифузії, рівняння масопередачі для зовнішнього переносу, який обмежує швидкість екстрагування, має вигляд М = де Dзов – коефіцієнт зовнішньої дифузії, м2/с; δ – товща граничної плівки, м; ΔС – різниця концентрації вилученої речовини на межі твердого тіла і рідини та середньої концентрації у оточуючій рідині, кг/м3. 2. Сорбційні процеси та їх застосування Процес сорбції, тобто поглинання газів або розчинених речовин твердими матеріалами або рідинами може протікати за різними механізмами. Як вам уже відомо, сорбція може бути 4 типів – абсорбція, адсорбція, хемосорбція і капілярна конденсація.
Різниця між процесами абсорбції і адсорбції в тому, що при абсорбції речовина поглинається усім об’ємом рідини, а при адсорбції – тільки поверхнею поглинача, тобто адсорбенту. Найбільше практичне значення мають поглинання і віддача продуктами води. Зволоження продукту, тобто сорбція водяних парів продуктом, відбувається тоді, коли тиск водяних парів у поверхні перевищує тиск водяних парів на його поверхні, який виникає в результаті випаровування частини вільної води самого продукту. Поглинання вологи продуктом у цьому випадку відбувається як за рахунок утворення тонкого шару на його поверхні (адсорбція) і шляхом об’ємного поглинання (абсорбція) гідрофільними речовинами, так і в результаті капілярної конденсації (при наявності макро- і мікро капілярів). Віддача вологи (десорбція) продуктом відбувається при більшому тиску водяних парів на поверхні продукту у порівнянні з тиском водяного пару у повітрі. Процес зволоження і віддачі продуктом відбувається до рівноважної вологості, при якій тиск водяного пару у повітрі і на поверхні продукту становиться рівним. У харчових виробництвах процеси абсорбції і адсорбції займають значне місце. Наприклад, процес абсорбції має місце при насиченні мінеральної води та різних напоїв двоокисом вуглецю, адсорбції – при очищенні соків і вин. В якості адсорбентів використовуються тверді пористі матеріали з великою питомою поверхнею – активне вугілля, силікагель, целюлозна маса, кізельгур, різні активовані глини та ін. Розрізняють фізичну адсорбцію і хімічну, яка називається хемосорбцією. Фізична адсорбція обумовлена взаємним притягненням молекул адсорбенту і адсорбату під дією сил Ван-дер-Ваальса і не супроводжується хімічною взаємодією адсорбованої речовини з поглиначем. При хімічній адсорбції в результаті хімічної реакції між молекулами поглиненої речовини і поверхневими молекулами поглинача виникає хімічний зв'язок. Внаслідок сорбції продукти при зберіганні набувають небажаного стороннього запаху, зволожуються за рахунок пари води із повітря. Печиво, вафлі, сухарі розм’якшуються, втрачають крихкість, а такі продукти як розчинний кофе, борошно, сіль і цукор злежуються, карамельні вироби – втрачають форму. Десорбція вологи із продуктів також несприятливо впливає на їх якість. В результаті випаровування змінюється форма, консистенція продукту, відбувається втрата маси, наприклад, усушка сиру, м’яса, яєць та ін. Випаровування вологи характерно для плодів і овочів. Воно призводить до зів’янення, ослаблення тургору клітин, порушення обміну речовин і псування. Величина втрат вологи продуктами залежить від температури, відносної вологості повітря, швидкості руху повітря, тари і способу укладення товару. 3. Процеси розчинення та кристалізації Методи підготовки сировини різноманітні і залежать від виду сировини. фізичного стану і способів наступної обробки. Сировина, що розчиняється у воді або здатна утворювати з нею емульсії чи суспензії, дозується при безперервному способі виробництва за об’ємом. Підготовка сухої сипучої сировини – кухонна сіль, цукор, зернові продукти, борошняні вироби та ін., проводиться у спеціальних підготовчих приміщеннях, де готують цукрові сиропи, заливу з використанням солі, проводять попередню обробку круп та ін. У зв’язку з цим, такі компоненти як сіль розчиняють у солерозчинниках, які мають пристрої для фільтрування і відстоювання розчинів, для очищення від нерозчинних домішок. Концентрацію розчину кухонної солі або цукру виражають у відсотках, тобто в г на 100 г води. Для визначення концентрації солі у розчині, визначають щільність розчину ареометром-солеміром, або за допомогою певних таблиць, при використанні звичайного ареометра, по показнику щільності розчину визнають, якій концентрації солі відповідає визначена щільність, і корегують доданням солі або води.
Цукор кристалічна речовина. У харчових продуктах цукор знаходить в аморфному стані. Для перетворення кристалічної речовини у аморфну, необхідно зруйнувати кристалічну решітку шляхом розчинення або розплавлювання, а потім розплавлену масу швидко охолонути. Молекули цукру не встигають зібратися в структуровану решітку, внаслідок чого маса здобуває однорідну аморфну структуру. Цукор, що має в молекулі 8 гідроксильних груп, легко перетворюється в аморфну речовину, однак це перетворення можливо лише при умові уповільненого руху молекул. Для цього, наприклад, при виробництві карамелі підвищують в’язкість цукрового сиропу шляхом уварювання його до вологості 1-3 %. Аморфний стан нестійкий і з часом кристалічна решітка відновлюється, а вироби оцукрюються. Особливо швидко оцукрюються карамель та ін. вироби з поверхні навіть при незначному їх зволоженні. Зовнішньо оцукрювання карамелі проявляється в утраті прозорості. Сахароза може виділятися у вигляді кристалів тільки у пересичених розчинів. Щоб довести розчин сахарози до пересиченого стану, необхідно створити умови для утворення центрів кристалізації і здійснити ріст кристалів шляхом відкладення на їх поверхні нових кількостей сахарози, для цього застосовується уварювання. Вміст сахарози в розчині залежить від коефіцієнта пересичення, який зростає з підвищенням температури, і виражається масовим відношенням розчиненого цукру до чистої води у розчині. В присутності нецукрів розчинність цукру значно збільшується і визначається коефіцієнтом насичення α1 = де Н – коефіцієнт розчинності сахарози в даному розчині, що містить нецукри;
Н1 – розчинність чистої сахарози. Розчин, що містить цукру більше, ніж у насиченому розчині, називаються пересиченими. Ступінь пересичення розчину вимірюється коефіцієнтом пересичення, що показує, в скільки разів у даному розчині на одиницю води припадає цукру більше, ніж у насиченому розчині при тій же температурі α = де α – коефіцієнт пересичення Н1 – кількість розчиненого цукру в даному розчині на одиницю маси води; Н1 – розчинність цукру на одиницю маси води при тій же температурі і в дистильованій воді. Якщо α = 1 – розчин насичений, при α < 1 – розчин ненасичений, при α > 1 – розчин пересичений. Ріст кристалів відбувається не миттєво, а з деякою швидкістю, що називається швидкістю кристалізації, яка характеризується коефіцієнтом, що визначає кількість сахарози в міліграмах, що відкладається з пересиченого розчину в секунду на 1 м2 поверхні кристала. g = k1Fτ де g – маса цукру, що викристалізовується, мг; k1 – коефіцієнт швидкості кристалізації, мг/(м2 ·c); F – площа поверхні кристала, м2; τ – час кристалізації, с. Кристалізація цукру зв’язана з переміщенням маси і відноситься до дифузійного процесу, рушійною силою якого є різниця концентрації сахарози в розчині і на поверхні кристалів. Звичайно кристали рухаються у між кристальній рідині. На їхній поверхні утворюється прикордонний шар, швидкість якого стосовно поверхні кристалів близька до нуля, і масообмін у граничному шарі може відбуватися тільки шляхом дифузії. Очевидно, що граничний шар і чинить опір при кристалізації. Перехід цукру з граничного шару безпосередньо до кристалу також пов'язаний з подоланням деякого опору. Таким чином, швидкість кристалізації є функцією двох процесів, що протікають одночасно – розчинення і росту кристалів цукру шляхом сумісних перетворень. 4. Процеси перегонки та ректифікації Існує 2 види перегонки – проста і фракційна. Проста перегонка заснована на постійному нагріванні рідини з відводом пари. У перегінному апараті у рівновазі з рідиною знаходиться тільки частина утвореної пари. Простою перегонкою отримати чистий компонент неможливо., тому її застосовують у тих випадках, якщо не вимагається повне розділення суміші на чисті компоненти. Вона можлива у тих випадках, коли температури кипіння компонентів сильно розрізняються. Фракційна перегонка – процес, що складається з декількох стадій: 1/ нагрівання вихідної рідини до кипіння і отримання деякої кількості пари визначеного складу; 2/ конденсація отриманої пари; 3/ випаровування конденсату для отримання пари нового складу. Більш багатої легко летючим компонентом. Розподілення сумішей проводять безперервно фракційною перегонкою, які називають ректифікація. В технологіях виробництва етилового спирту застосовуються процеси перегонки і ректифікації. Вилучення етилового спирту з бражки і його очищення здійснюються ректифікацією. Ректифікацією називають процес розділення бінарної або багатокомпонентної рідини суміші на компоненти фракції, що розрізняються між собою летючістю. Вилучення спирту засновано на різній летючості спирту та його домішок. Летючість домішок залежить від концентрації в середовищі етанолу.
Для оцінки летючості домішок по відношенні до летючості етанолу використовують таке поняття, як коефіцієнт випаровування і ректифікації. Коефіцієнтом випаровування є співвідношення k = A/Q де k – коефіцієнт випаровування; А – вміст етанолу в парах Q – вміст етанолу в рідині. Для домішок відповідно приймаємо позначення α і β. В цілому kдм= α / β. Коефіцієнтом ректифікації називається відношення коефіцієнту випаровування домішок до коефіцієнту випаровування етанолу k1 = Він показує збільшення, або зменшення вмісту домішок по відношенню до етилового спирту. Процес перегонки використовують також в коньячному виробництві. Дезодорація масел являє собою дистиляційний процес, метою якого є видалення з масла речовин – низькомолекулярних жирних кислот, альдегідів, кетонів та ін. летючих продуктів, які визначають запах і смак масла, а також виділення з рослинних масел небажаних чужорідних сполук. На початку процесу олію підігрівають глухою парою до температури 100-120 оС, а потім подають гостру пару і поступово доводять температуру до 150-170 оС. Тривалість процесу 4-6 годин.
5. Утворення дисперсних систем та структура харчових продуктів 5.1 Утворення харчових емульсій та їх властивості Емульсії – це дисперсні системи, що складаються з рідкої дисперсної фази і рідкого дисперсійного середовища. Обов’язкова умова утворення емульсії – нерозчинність речовини дисперсної фази в дисперсійному середовищі. Звичайно емульсії одержують методом механічного диспергування. Для цього використовують різні мішалки, змішувачі, гомогенізатори, колоїдні млини і ультразвук. Рідини, з яких одержують емульсії, нерозчинні одна в одній і відрізняється своїми властивостями. Однією з рідин є вода, іншою – нерозчинна у воді рідина, звичайно це масло. В залежності від полярності фаз розрізняють 2 типи емульсій: 1 / прямі, які складаються з полярного дисперсійного середовища (води) і неполярної дисперсійної фази (масла), м/в і 2/ зворотні, які мають неполярне дисперсійне середовище (масло) і полярну дисперсну фазу (вода), в/м. В залежності від концентрації дисперсної фази емульсії розділяють на три групи: 1/ розбавлені – з концентрацією дисперсної фази не більше 0,1 % від об’єму емульсії; 2/ концентровані – з концентрацією дисперсної фази від 0,1 до 74 % об’єму; 3/ висококонцентровані – з вмістом дисперсної фази вище Висококонцентровані емульсії, в яких досягнута максимально можлива концентрація дисперсної фази, називають граничними або гранично концентрованими. Емульсії – нестійкі системи, що пов’язано з самоплинному злитті крапельок дисперсної фази – коалесценції, що приводить до руйнування емульсії і розділення її на 2 шари. Стійкість емульсії може додати тільки третій компонент – стабілізатор або емульгатор. Емульгатори – це розчинні поверхнево активні речовини (ПАР) і високомолекулярні речовини (ВМР) або нерозчинні порошкоподібні речовини, додання яких до емульсії робить їх стійкими. Емульгатор адсорбується на межі розділення фаз масло-вода і знижує міжфазний поверхневий натяг, а також концентруючись на поверхні крапельок дисперсної фази, емульгатор утворює механічно міцний шар (плівку), який перешкоджає їх злиттю дисперсної фази. Емульгатори, які розчинні у воді, сприяють утворенню прямих емульсій, а розчинні у неполярних рідинах, тобто маслі, дають зворотні емульсії. До емульсій відноситься молоко, вершки, вершкове масло, сметана, майонез. Жири краще засвоюються у емульсованому стані. При виробництві маргарину, в нього в якості емульгатора додають органічні сполуки з класу складних ефірів, молекули яких складаються з полярної (гідрофільної) частини і неполярної (ліофільної або гідрофобної). 5.2 Харчові суспензії, їх утворення та властивості Суспензії представляють собою дисперсні системи з твердою дисперсною фазою і рідким дисперсійним середовищем з розмірами часточок вище, ніж у колоїдних системах, тобто у діапазоні 10-6 – 10-4. До них відносяться фруктові і овочеві пасти, помадні цукеркові маси, терте какао та ін. Способи отримання і стабілізації суспензій багато в чому схожі з подібними для колоїдних розчинів – золів. Різка відмінність суспензій від колоїдів проявляється в молекулярно-кінетичних і оптичних властивостях. Явища дифузії і осмосу не властиві суспензіям. Проходження світла через суспензії не викликає опалесценції, тому що світлові проміні не розсіюються, а заломлюються і відбиваються частинками суспензії. Седиментаційна стійкість суспензії дуже мала внаслідок великих розмірів часточок. У суспензіях тверді часточки можуть знаходитися у завислому стані нетривалий час, потім вони осідають під силами тяжіння. Процесам агрегації частинок у суспензіях сприяють сили притягнення і утримування різної природи – гідрофобні, сили Ван-дер-Ваальса, електростатичні сили зв’язування часточок макромолекулами та ін.
|
|||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 267; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.27.232 (0.031 с.) |