
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основные законы идеальных газов
Основные законы идеальных газов были определены в основном экспериментальным путем. 1 Закон Бойля-Мариота (например, был открыт в 1662-1676 г.), по которому произведение давления на удельный объем величина постоянная при одинаковой температуре: p·v =const или p1v1 = p2v2 при T = const. 2 Закон Гей-Люссака выведенный им в 1882 г.: v/T = const или v1/v2 = T1/T2 при p = const. В 1811 г. А Авогадро установил, что в равных объемах разных идеальных газов при одинаковых давлениях и температурах находится одинаковое количество молекул. Отсюда возникло два следствия. Следствие 1. Массы газов в одинаковых объемах (V1 = V2) при p = idem и T = idem относятся друг к другу как их молекулярные массы:
Следствие 2. Количество разных газов, находящихся при одинаковых давлениях и температурах, относящиеся между собой как молекулярные массы этих газов, должны иметь одинаковый объем Vµ = idem / Это позволяет определить, что объем одного киломоля при нормальных условиях одинаков для любых идеальных газов и равен 22,4 м3/кмоль. Нормальные физические условия: р= 0,1014 МПа, Т= 273,15 0К. Тогда в соответствии с уравнением Клапейрона:
Rµ =8314,33 Дж/(кмоль К) – универсальная газовая постоянная. Газовая постоянная, R, Дж/(кг К), любого газа определяется из соотношения
Первое начало термодинамики
Первое начало термодинамики (основной закон термодинамики) является выражением закона сохранения энергии для термодинамических систем. Энергия не исчезает и не возникает вновь, она лишь переходит из одного вида в другой. Согласно первому началу термодинамики теплота Q, сообщаемая системе, расходуется на изменение внутренней энергии системы ΔU и совершение системой работы против внешних сил
или в удельных величинах на единицу массы,
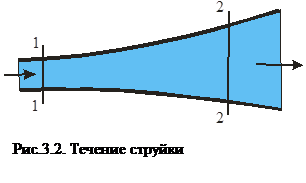
Первый закон термодинамики был установлен опытным путем Д Джоулем в XIX веке. Он определил закон так, что при совершении какой-либо работы A выделяется одно и то же количество тепла Q. Справедливо и обратное: за счет затраты тепла Q получается всегда одно и то же количество работы А. Эквивалентность работы и тепла не зависит от способа получения тепла, вида работы, температуры тела и т.д. Еще одно определение первого закона термодинамики звучит так: Если тело совершает работу большую, чем то количество теплоты, которое к нему подведено, то внутренняя энергия убывает. Отсюда получается, что нельзя создать вечный двигатель первого рода (перпетум-мобеле невозможен). Если система находится в движении и, например, в сечении 1-1 (рис.3.2) газ обладал внутренней u1, потенциальной (p1v1) и кинетической (
или отсюда
где d(pv) - изменение работы проталкивания. Таким образом, внешняя работа это сумма изменений работы проталкивания и кинетической энергии.
Это уравнение после дифференцирования можно представить в виде:
В теплоэнергетике параметры и и pv объединяются в общий калорический параметр называемый энтальпией, Дж/кг: h = u + pv. Энтальпия – функция, характеризующая состояние потока (функция состояния). Первый закон термодинамики без учета движения можно представить через энтальпию:
За начало отсчета энтальпии для воды и водяного пара принята тройная точка (Т = 273,16 К, р = 0,0006 Па), в которой возможно существование трех фаз одновременно. Для газов (воздуха) точкой отсчета энтальпии принято Т = 0 К. Удельное количество теплоты может быть также определено из уравнения
Из последнего уравнения видно, что удельная теплоемкость сх зависит от характера процесса, поскольку она характеризуется постоянством параметра х и зависит от параметра состояния Т. Для определения связи между количеством тепла и температурой Клаузиус в 1850 г. предложил особую функцию, названную им энтропией, Дж/кг:
Учитывая уравнение (3.1) изменение энтропии можно связать с изменением температуры:
Значение энтропии определяется только параметрами точек 1 и 2 и не зависит от характера процесса. Поэтому энтропия является параметром процесса. Началом отсчета энтропии принята точка с температурой Т = 0 К.
|
||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 444; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.14.141.228 (0.005 с.) |
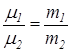 .
.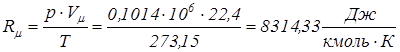
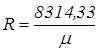 .
. :
: ,
,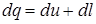 .
. ) энергиями, а в сечении 2-2 соответственно и2, (p2v2) и (
) энергиями, а в сечении 2-2 соответственно и2, (p2v2) и ( ) в удельных единицах, то по закону сохранения энергии
) в удельных единицах, то по закону сохранения энергии ,
,
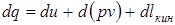 ,
, = с2/2 – удельная кинетическая энергия,
= с2/2 – удельная кинетическая энергия,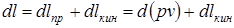
 .
. Работы
Работы  зависят от направления процесса 1-2 (рис.3.3) и не являются параметрами состояния. В противоположность этому связанная с движением работа проталкивания
зависят от направления процесса 1-2 (рис.3.3) и не являются параметрами состояния. В противоположность этому связанная с движением работа проталкивания 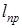 зависит только от состояния рабочего тела и не зависит от вида процесса.
зависит только от состояния рабочего тела и не зависит от вида процесса.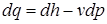 .
. . (3.1)
. (3.1)
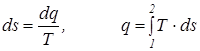
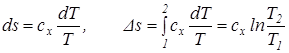 .
.


