
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Глава 3. Теоретические основы теплотехники.Содержание книги
Поиск на нашем сайте
Глава 3. Теоретические основы теплотехники. Что такое термодинамика Термодинамика это наука, изучающая физические свойства макроскопических систем (тел и полей) на основе анализа возможных в этих системах превращений энергии без обращения к их микроскопическому строению. Основное содержание термодинамики – рассмотрение общих свойств физических систем в состоянии термодинамического равновесия, а также общих закономерностей процессов изменения состояния [энцикл.]. Термодинамика вместе с тепломассообменом является составной частью теоретических основ теплотехники, которая в свою очередь является фундаментальной базой всей теплоэнергетики. Она базируется на двух экспериментально установленных законах – началах термодинамики, а также на философской теореме Нернста (третье начало термодинамики), имеющей ограниченную область применения. В инженерной практике различают: - общую или физическую термодинамику; - химическую термодинамику, занимающуюся приложениями законов термодинамики к химическим и физико-химическим процессам (изучение тепловых эффектов химических реакций, химического равновесия, фазового равновесия и др.); - техническую термодинамику, занимающуюся приложениями законов термодинамики в теплотехнике (разработка теории теплосиловых установок, двигателей и др.); - термодинамику необратимых процессов, в которой изучаются необратимые процессы с помощью термодинамических законов (например, определяются их скорости в зависимости от внешних условий). Термодинамическая система это совокупность тел (субстанций), могущих обмениваться между собой и с другими телами (внешней средой) энергией и веществом. Для термодинамической системы справедливы законы термодинамики. Термодинамической системой является любая система, обладающая очень большим числом степеней свободы (например, система, состоящая из большого числа молекул, атомов, электронов и других частиц вещества). Термодинамическая система может быть физически однородной, если ее состав и все физические свойства одинаковы в любых, произвольно выбранных частях, равных по объему (например, химически однородный газ или смесь газов, находящихся в состоянии термодинамического равновесия при отсутствии внешнего силового поля). Термодинамическая система является химически однородной, если она состоит из одного химического вещества (например, жидкая вода со льдом). Примером химически неоднородной системы является воздух. Материальные тела термодинамической системы разделяются на источники тепла и рабочие тела, которые совершают механическую работу под воздействием источников тепла.
Термодинамический процесс это всякое изменение, происходящее в термодинамической системе и связанное с изменением хотя бы одного из ее параметров. Существуют обратимые, необратимые и квазистатические процессы; Помимо этого термодинамические процессы могут быть: адиабатными, изобарическими, изотермическими, изохорическими, изоэнтальпийными и изоэнтропийными. Обратимым процессом является процесс перехода системы из одного состояния в другое, с которым можно сопоставить реально возможный обратный переход, последовательно повторяющий все промежуточные состояния рассматриваемого процесса. Процесс обратим только в том случае, если он является квазистатическим процессом. Многие задачи в теплоэнергетике решаются на основе обратимости процессов, т.е. процессов без учета сил трения – потерь. Все реальные процессы необратимы. Квазистатический процесс это процесс, скорость распространения которого в какой-либо ограниченной системе столь велика, что за время распространения процесса вдоль всей системы ее состояние не успевает заметно измениться. При этом изменение состояния всех частей системы происходит по одному и тому же закону без запаздывания. Термодинамическое равновесие это состояние, в которое, в конце концов, приходит термодинамическая система, находящаяся при неизменных внешних условиях. При этом система находится в состоянии механического равновесия, а параметры состояния не изменяются с течением времени, т.е. могут совершать малые колебания около неизменных средних значений, что называется флуктуацией. Разновидностью термодинамического равновесия является тепловое равновесие, при котором все части системы имеют одну и ту же температуру. В химической термодинамике используется понятие химического равновесия. Химическое равновесие это состояние реакционной системы, характеризующееся тем, что химическая реакция идет одновременно в двух противоположных направлениях с одинаковой скоростью. В результате состав системы (например, O2+N2=2NO) остается постоянным, пока сохраняются условия ее существования (температура, давление). Каждая химическая реакция в состоянии равновесия характеризуется соотношением между концентрациями участвующих в ней веществ – константой равновесия. Определяя положение равновесия для различных температур и давлений, можно судить, какое их сочетание наиболее благоприятно для практических целей.
Уравнения состояния газов
Основным уравнением состояния идеальных газов, связывающим термодинамические параметры, является уравнение Клапейрона:
где R – газовая постоянная, Дж/(кг К); µ - молекулярная масса вещества. Последнее уравнение применимо для иднальных газов, когда: - силы сцепления между молекулами отсутствуют; - молекулы рассматриваются как материальные точки приложения сил, создающих движение молекул; - молекулы совершают только поступательные движения. Для реальных газов используется уравнение Ван-дер-Ваальса:
где а - постоянный коэффициент, учитывающий межмолекулярные силы; b - собственный объем молекул. Известны и другие уравнения состояния реальных газов, которые могут быть более точными в определенных пределах. Любое вещество может находиться в газообразном, жидком и твердом состоянии. Переход из одной фазы в другую связан с изменениями параметров при подводе или отводе тепла. Процесс перехода воды из жидкого состояния в газообразное называется парообразованием, а обратный процесс конденсацией. На рис.3.1 показаны линии постоянных температур и линия насыщения; области жидкого, пароводяного и парового состояния выделены различным цветом. На рисунке представлена критическая точка К. Параметры критической точки: давление - 22,115 МПа; температура – 374,12 0С; удельный объем – 0,003147 м3/кг; удельная энтальпия – 2095,2 кДж/кг; удельная энтропия – 4,4237 кДж/кг.
Для большинства случаев реальных газов можно применять уравнение Клапейрона. Уравнение Ван-дер Вальса описывает свойства паров приблизительно особенно в области близкой к критической точке. Поэтому для определения свойств газов в этой области рекомендуется использовать табличные данные и эмпирические зависимости. В энергетике известны таблицы воды и водяного пара [ ].
Первое начало термодинамики
Первое начало термодинамики (основной закон термодинамики) является выражением закона сохранения энергии для термодинамических систем. Энергия не исчезает и не возникает вновь, она лишь переходит из одного вида в другой. Согласно первому началу термодинамики теплота Q, сообщаемая системе, расходуется на изменение внутренней энергии системы ΔU и совершение системой работы против внешних сил
или в удельных величинах на единицу массы,
Первый закон термодинамики был установлен опытным путем Д Джоулем в XIX веке. Он определил закон так, что при совершении какой-либо работы A выделяется одно и то же количество тепла Q. Справедливо и обратное: за счет затраты тепла Q получается всегда одно и то же количество работы А. Эквивалентность работы и тепла не зависит от способа получения тепла, вида работы, температуры тела и т.д.
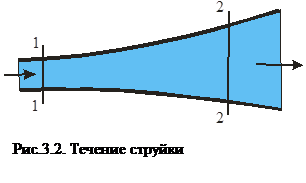
Еще одно определение первого закона термодинамики звучит так: Если тело совершает работу большую, чем то количество теплоты, которое к нему подведено, то внутренняя энергия убывает. Отсюда получается, что нельзя создать вечный двигатель первого рода (перпетум-мобеле невозможен). Если система находится в движении и, например, в сечении 1-1 (рис.3.2) газ обладал внутренней u1, потенциальной (p1v1) и кинетической (
или отсюда
где d(pv) - изменение работы проталкивания. Таким образом, внешняя работа это сумма изменений работы проталкивания и кинетической энергии.
Это уравнение после дифференцирования можно представить в виде:
В теплоэнергетике параметры и и pv объединяются в общий калорический параметр называемый энтальпией, Дж/кг: h = u + pv. Энтальпия – функция, характеризующая состояние потока (функция состояния). Первый закон термодинамики без учета движения можно представить через энтальпию:
За начало отсчета энтальпии для воды и водяного пара принята тройная точка (Т = 273,16 К, р = 0,0006 Па), в которой возможно существование трех фаз одновременно. Для газов (воздуха) точкой отсчета энтальпии принято Т = 0 К. Удельное количество теплоты может быть также определено из уравнения
Из последнего уравнения видно, что удельная теплоемкость сх зависит от характера процесса, поскольку она характеризуется постоянством параметра х и зависит от параметра состояния Т. Для определения связи между количеством тепла и температурой Клаузиус в 1850 г. предложил особую функцию, названную им энтропией, Дж/кг:
Учитывая уравнение (3.1) изменение энтропии можно связать с изменением температуры:
Значение энтропии определяется только параметрами точек 1 и 2 и не зависит от характера процесса. Поэтому энтропия является параметром процесса. Началом отсчета энтропии принята точка с температурой Т = 0 К.
Термодинамические циклы Цикл (круг, от греч.) совокупность процессов в системе периодически повторяющихся явлений, при которых объект, подвергающийся изменению в определенной последовательности, вновь приходит в исходное положение.
Непрерывность действия тепловой машины обеспечивается тем, что рабочее тело с параметрами p, V, T, пройдя последовательно ряд состояний процесса расширения на пути 1а2, а затем ряд состояний сжатия 2б1 вновь возвращается в исходную точку и цикл может быть повторен. Процесс расширения:
работа сжатия:
Поскольку При процессе расширения работа (тепло) подводится к рабочему телу и тогда:
Для осуществления процесса сжатия тепло отводится:
Так как внутренняя энергия является функцией состояния, т.е. величиной не зависящей от пути процесса, то для любого кругового цикла: Таким образом, полезная работа равна разности количеств тепла, подведенного и отведенного при совершении цикла. Второй закон термодинамики Для осуществления термодинамического цикла необходимо иметь не только источник тепла (теплоотдатчик) qподв, но и холодильник (теплоприемник) qотв, без которого невозможен возврат рабочего тела в исходную точку. Это условие и составляет содержание второго начала термодинамики. В то время как первый закон термодинамики характеризует процессы превращения энергии с количественной стороны, второй закон определяет качественную сторону этих процессов. Существует ряд формулировок второго начала (закона) термодинамики. 1. Теплота горячего источника в круговом процессе (цикле) не может быть полностью превращена в работу, так как часть подведенного тепла должна быть передана более холодному источнику (холодильнику). 2. Для совершения любого кругового процесса (цикла) необходимо иметь как минимум два источника тепла – горячего и холодного и, Следовательно, для этой цели в термодинамической системе необходимо наличие разности температур. 3. Любой самопроизвольный термодинамический процесс является необратимым. 4. Теплота не может сама собой переходить от более холодного тела к более нагретому (эта формулировка Клаузиуса). 5. Невозможно построить периодически действующую машину, все действие которой сводилось бы к поднятию некоторого груза и охлаждению теплового источника (формулировка Планка). Второй закон термодинамики обычно записывается уравнением
Равенство в последнем уравнении возможно только для идеальных процессов. Если процессы расширения располагаются выше процессов сжатия (
Цикл Карно
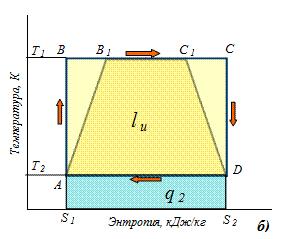
Цикл Карно состоит в преобразовании тепла в работу при наличии только двух источников тепла: верхнего с температурой Т1 и нижнего с температурой Т2 (Т2< Т1). Цикл Карно используется как эталонный цикл. Он имеет наивысший для данной разности температур термический к.п.д. На рис.3.9 показан цикл Карно в pv - и Ts- диаграммах. Он состоит из двух изотерм и двух адиабат.
Рис.3.9. Цикл Карно в pv- диаграмме (а) и Ts- диаграмме (б).
Оценкой совершенства прямых циклов является термический коэффициент полезного действия
где lц – полезная работа цикла, определяемая площадью АВСDA (рис.3,9, б) для идеального (обратимого) цикла и площадь АВ1С1DA для необратимого цикла, q1 – тепло, подведенное от теплого источника, равное площади s1BCs2s1 (рис 3.9, б); q2 – тепло, отданное холодному источнику, равное площади s1ADs2s1 (рис 3.9, б). Для обратимого цикла Карно можно записать следующие соотношения
Таким образом, для обратимого цикла, учитывая уравнение (3.5) термический к.п.д. равен
Для необратимых циклов при наличии потерь на дросселирование термический к.п.д. определяется из уравнений
где q1н – тепло, подведенное от теплого источника при необратимом цикле, равное площади s1 АB1C1D s2s1 (рис 3.9, б); q2н – тепло, отданное холодному источнику в необратимом цикле, равное площади s1ADs2s1 (рис 3.9, б); q2 = q2н. В энергетике реально достижимый термический к.п.д. не превышают 60-62 %.
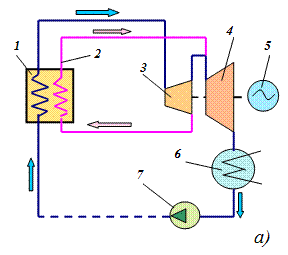
Цикл Ренкина На всех тепловых и атомных электростанциях активно используется цикл, открытый шотландским инженером-физиком У.Ренкином в Х1Х веке. Цикл Ренкина применяется как для докритических, так и сверхкритических давлений. На рис.3.10 представлена конструктивная схема и Тs – диаграмма такого цикла.
Рис. 3.10. Конструктивная тепловая схема ТЭС (а) и цикл Ренкина в Тs - диаграмме Обратимый докритический цикл Ренкина описывается в Тs –диаграмме процессами abcdefa, необратимый цикл – ab1cdef1a, где процессы аb осуществляются в насосах (7, рис.3.10, а); bcde – в котле (1, последовательно в водяном экономайзере, испарительных поверхностях нагрева и пароперегревателе); ef – в паровой турбине (3, 4); fa – в конденсаторе (6). Сверхкритический цикл Ренкина представляется процессами aghklfa, которые осуществляются в насосе - ag (7, рис.3.10, а); в котле – gh и в промежуточном пароперегревателе - kl (1); в паровой турбине – hk (часть высокого давления, 3), в частях среднего и низкого давлений lf (4) и в конденсаторе - fa (6).
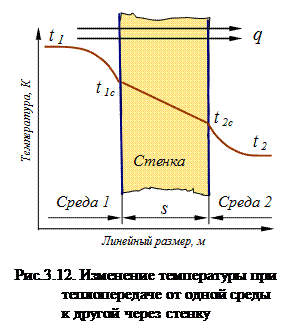
Теплопроводность Теплопроводность – это теплообмен, при котором перенос тепловой энергии в неравномерно нагретой среде имеет атомно-молекулярный характер (не связан с макроскопическим движением среды). В газах перенос энергии осуществляется хаотически движущимися молекулами, в металлах – в основном электронами проводимости, в диэлектриках – за счет связанных колебаний частиц, образующих кристаллическую решетку. При одинаковости физических свойств тела (среды) по всем направлениям (изотропность среды) справедлив закон Фурье, согласно которому вектор плотности теплового потока (
где λ – коэффициент теплопроводности, Вт/(м·К). Наибольшие значения λ имеют металлы, а наименьшие газы. Например: - сталь – 63 Вт/(м·К); - латунь – 100 Вт/(м·К); - алюминий – 200 Вт/(м·К); - медь – 392 Вт/(м·К); - серебро - 455 Вт/(м·К); - вода (жидкость)– 0,53 Вт/(м·К); - воздух (газ) – 0,025 Вт/(м·К); Уравнение (3.6) с учетом однослойной стенки можно представить в следующем виде:
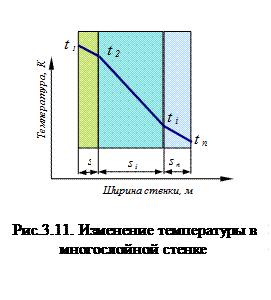
где s/λ=Rλ – термическое сопротивление материала стенки; обратная величина 1/Rλ называется тепловой проводимостью. Для многослойных стенок тепловой поток определяется по выражению
На рис.3.11 графически показано изменение температуры в многослойной стенке при воздействии теплового потока с лева на право. Конвективный теплообмен Конвективный теплообмен – это процесс переноса теплоты в неравномерно нагретой жидкой, газообразной или сыпучей среде, осуществляющейся вследствие движения среды и ее теплопроводности. Конвективный теплообмен, протекающий на границе раздела двух фаз называется конвективной теплоотдачей. Конвективный теплообмен зависит от физических свойств среды и характера ее движения. Различают: - конвективный теплообмен при естественной (свободной) конвекции, когда движение среды обусловлено только действием силы тяжести на неравномерно нагретую и, следовательно, неоднородную по плотности среду; - конвективный теплообмен при вынужденной конвекции, когда движение среды вызывается действием на нее насосов, вентиляторов, мешалок и т.п. Если конвективный теплообмен сопровождается переходом среды из одного агрегатного состояния в другое, то его называют конвективным теплообменом при изменении агрегатного состояния (например, при кипении жидкости или при конденсации пара). Конвективный теплообмен осуществляется в различных теплообменных и теплосиловых установках. Для определения теплового потока q, Вт/м2, передаваемого путем конвективного теплообмена, используется уравнение Ньютона:
где tcm, tж – температуры на поверхности тела (стенки) и жидкости (или газа); Δt = tcm - tж – температурный напор, К; α – коэффициент теплоотдачи, Вт/(м2К); это количество теплоты, передаваемой через единицу поверхности твердого тела в единицу времени при разности температур в один градус. Коэффициент теплоотдачи колеблется в широких пределах и зависит от многих факторов движущейся среды (табл.3.2): агрегатного состояния, вязкости, сжимаемости, давления, температуры, теплоемкости, теплопроводности и т.д. Коэффициент α определяется в основном экспериментальным путем, и поэтому применим только при тех же условиях, в которых проводился эксперимент. При аналитическом определении коэффициента α в некоторых условиях используется теория подобия физических процессов и теория моделирования. Таблица 3.2 Коэффициент теплоотдачи
Режим движения при расчете конвективного теплообмена определяется критерием Рейнольдса:
где с – скорость движения среды, м/с; l – линейный размер, м;
Считается, что при Re < 2320 движение среды ламинарное; при больших значениях Re движение турбулентное. В теории подобия коэффициент теплоотдачи определяется с учетом критерия Нуссельта
где λ - – коэффициент теплопроводности движущейся жидкости или газа, Вт/(м·К).
Теплопередача через стенку Рассмотрим процесс теплообмена между двумя средами, разделенными промежуточной стенкой. Такой процесс теплопередачи можно представить поэтапно следующим образом (рис.3.12). 1. Теплопередача от более горячей движущейся среды к поверхности стенки, осуществляемая конвективным теплообменом. 2. Теплопроводность через твердую стенку. 3. Теплопередача от поверхности стенки к более холодной движущейся среде.
Преобразовав и сложив последние уравнения получим
где k – коэффициент теплопередачи, Вт/(м2К);
Полное количество теплоты, передаваемого через стенку в единицу времени, определяется по уравнению:
где Температурный напор при расчете теплопередачи в теплообменниках определяется как осредненное значение от входного до выходного сечений подогревателя.
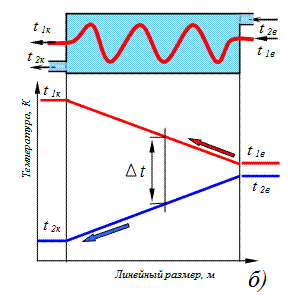
Рис.3.13. Изменения температур при противоточном (а) и прямоточном (б) движении теплоносителей в подогревателе
На рис.3.13 показано изменение температур от входных до выходных сечений теплообменника в греющей и обогреваемой средах, разделенных стенкой трубы при прямоточном и противоточном движении теплоносителей. При расчете теплообмена в подогревателях используется уравнение теплового баланса, которое имеет следующий вид:
где Q – количество теплоты, передаваемое одним теплоносителем другому в единицу времени, кг/с; с1, с2 – теплоемкость одного и второго теплоносителей, проходящих через теплообменник, Дж/(кг·К); G1, G2 – массовые расходы теплоносителей, кг/с; t1в, t2в – температуры 1-го и 2-го теплоносителей на входе в теплообменник, К; t1к, t2к - температуры 1-го и 2-го теплоносителей на выходе из теплообменника, К; η – к.п.д. подогревателя, учитывающий потери тепла при теплообмене. С другой стороны количества тепла отданное одним теплоносителем и принятое другим может быть определено через температурный напор по уравнению (3.7). Примерами бытовых теплообменников, в которых происходят процессы теплопередачи, являются батареи отопления, различные нагревательные элементы и т.д.
Теплообмен излучением В природе все тела способны излучать в окружающую среду электромагнитные волны различной длины. Электромагнитное излучение с длиной волны от 8·10-10 до 8·10-4 м создает тепловое воздействие. Такой теплообмен возникает за счет хаотического движения молекул одного тела, которое передается другому телу, вызывая в нем аналогичные колебания молекул. Количественно тепловое излучение любого тела определяется его температурой. Равенство температур двух тел свидетельствует о равенстве энергий теплового излучения этих тел. Неравенство температур создает небаланс в обмене энергий излучений обоих тел. Одной из основных характеристик лучистого теплообмена является излучательная способность тел, Вт/м2,
где Q – суммарное излучение тела с поверхности F (м2) в единицу времени, Вт. Для практических расчетов процесса лучистого теплообмена используется теория Стефана-Больцмана (1884 г.), согласно которой энергия излучения абсолютно черного тела пропорциональна абсолютной температуре в четвертой степени
где σ0 – постоянная излучения абсолютно черного тела; σ0 = 5,67·10-8, Вт/(м2К4). Для практических расчетов используется уравнение:
где Для любого серого тела
где ε = С/С0 – степень черноты тела; С – коэффициент излучения серого тела; С = 0÷5,67 Вт/(м2К4). Однако лучистый теплообмен зависит не только от излучательной способности тел, но и от поглощательной способности. Кирхгоф установил связь между излучательной и поглощательной способностями тела. Поглощательная способность тела оценивается коэффициентом поглощательной способности А. При температурном равновесии отношение излучательной и поглощательной способностей тела не зависит от природы тела и равно излучательной способности абсолютно черного тела при той же температуре, т.е.
Учитывая уравнение (3.8), получим: ε = А.
Если рассматривать лучистый теплообмен между двумя серыми телами, то происходит многократное взаимное переотражение двух основных падающих потоков Е1 и Е2. По закону Стефана-Больцмана можно записать следующие зависимости:
В результате действия двух потоков излучения получаем результирующее излучение, которое является разностью двух встречных лучистых потоков, падающих с противоположных сторон на некоторую воображаемую поверхность:
или где Спр – приведенный коэффициент излучения (приведенная излучательная способность), Вт/(м2К4), который определяется по уравнению:
Полная тепловая энергия, полученная телом при лучистом теплообмене, определяется по уравнению
где F – площадь взаимной поверхности облучения, м2, которая определяется в зависимости от площадей F1 и F2, участвующих в теплообмене поверхностей тел 1 и 2. Если обменивающиеся лучистой энергией тела занимают произвольное пространство по отношению друг к другу, то в уравнение (3.9) вводится коэффициент, учитывающий угловое расположение излучательных поверхностей
где φ1,2 – средний угловой коэффициент облучения. Этот коэффициент показывает, какая часть поверхности излучения, испускаемого одним телом, падает на другое. Примером теплового излучения является тепло, которое попадает на поверхность земли от солнца; при прямом излучении в полдень и при угловом на закате или восходе солнца. Стоит только спрятаться в тень как прекращается действие солнечной радиации. Другим примером является лучистое тепло, действующее от костра.
Контрольные вопросы 1. Дайте определение термодинамики? 2. Какие виды термодинамики Вы знаете? 3. Дайте определение термодинамической системы? 4. Что такое «термодинамический процесс» и какие они бывают? 5. Дайте определение термодинамического равновесия? 6. Охарактеризуйте основные термодинамические параметры? 7. Напишите основные уравнения состояния идеального и реального газа? 8. Покажите в координатах «давление – объем» состояние пароводяной среды? 9. Что обозначают параметры критической точки; представьте их для воды и водяного пара? 10. Назовите основные законы идеального газа? 11. Определение и уравнения первого начала термодинамики? 12. Какие преобразования можно показать в pv - Ts - диаграммах? 13. Свойства термодинамических процессов? 14. Какие термодинамические процессы Вы знаете? 15. Покажите изменение тепловой энергии в изохорном, изобарном и изотермическом процессах? 16. Напишите изменения параметров в адиабатном и политропном процессах? 17. Термодинамические свойства воды и водяного пара? 18. Покажите изменения параметров воды и водяного пара в hs - и Ts - диаграммах? 19. Дайте определение термодинамического цикла? 20. Дайте определение второго закона термодинамики? 21. Что такое цикл Карно, покажите его в pv - Ts - диаграммах? 22. Что такое цикл Ренкина, покажите его в pv - Ts - диаграммах? 23. Что такое тепломассообмен? 24. Какие виды тепломасообмена Вы знаете; объясните их на примерах? 25. Что такое теплопроводность? 26. Как изменяется температура в многослойной стенке? 27. Что такое конвективный теплообмен? 28. Покажите теплопередачу через стенку при конвективном теплообмене и теплопроводности? 29. Что такое температурный напор. Покажите его при противоточном и прямоточном движении теплоносителей в теплообменнике? 30. Что такое теплообмен излучением? Глава 3. Теоретические основы теплотехники. Что такое термодинамика Термодинамика это наука, изучающая физические свойства макроскопических систем (тел и полей) на основе анализа возможных в этих системах превращений энергии без обращения к их микроскопическому строению. Основное содержание термодинамики – рассмотрение общих свойств физических систем в состоянии термодинамического равновесия, а также общих закономерностей процессов изменения состояния [энцикл.]. Термодинамика вместе с тепломассообменом является составной частью теоретических основ теплотехники, которая в свою очередь является фундаментальной базой всей теплоэнергетики. Она базируется на двух экспериментально установленных законах – началах термодинамики, а также на философской теореме Нернста (третье начало термодинамики), имеющей ограниченную область применения. В инженерной практике различают: - общую или физическую термодинамику; - химическую термодинамику, занимающуюся приложениями законов термодинамики к химическим и физико-химическим процессам (изучение тепловых эффектов химических реакций, химического равновесия, фазового равновесия и др.); - техническую термодинамику, занимающуюся приложениями законов термодинамики в теплотехнике (разработка теории теплосиловых установок, двигателей и др.); - термодинамику необратимых процессов, в которой изучаются необратимые процессы с помощью термодинамических законов (например, определяются их скорости в зависимости от внешних условий). Термодинамическая система это совокупность тел (субстанций), могущих обмениваться между собой и с другими телами (внешней средой) энергией и веществом. Для термодинамической системы справедливы законы термодинамики. Термодинамической системой является любая система, обладающая очень большим числом степеней свободы (нап
|
||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 614; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.89.181 (0.015 с.) |

 или
или 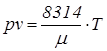 ,
, ,
, На рис.3.1. на диаграмме pv показаны фазовые состояния воды, пароводяной смеси и острого пара, критическая точка К, линия насыщения ОКВ. Линия ОК является линией насыщения воды, а КВ – линией сухого насыщенного пара.
На рис.3.1. на диаграмме pv показаны фазовые состояния воды, пароводяной смеси и острого пара, критическая точка К, линия насыщения ОКВ. Линия ОК является линией насыщения воды, а КВ – линией сухого насыщенного пара. :
: ,
,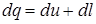 .
. ) энергиями, а в сечении 2-2 соответственно и2, (p2v2) и (
) энергиями, а в сечении 2-2 соответственно и2, (p2v2) и ( ) в удельных единицах, то по закону сохранения энергии
) в удельных единицах, то по закону сохранения энергии ,
,
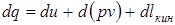 ,
, = с2/2 – удельная кинетическая энергия,
= с2/2 – удельная кинетическая энергия,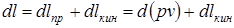
 .
. Работы
Работы  зависят от направления процесса 1-2 (рис.3.3) и не являются параметрами состояния. В противоположность этому связанная с движением работа проталкивания
зависят от направления процесса 1-2 (рис.3.3) и не являются параметрами состояния. В противоположность этому связанная с движением работа проталкивания 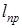 зависит только от состояния рабочего тела и не зависит от вида процесса.
зависит только от состояния рабочего тела и не зависит от вида процесса.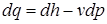 .
. . (3.1)
. (3.1)
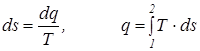
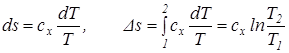 .
.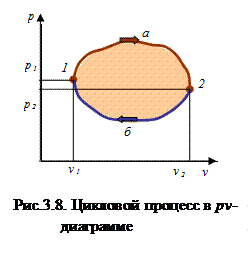 Величина термодинамической работы и тепла в каком-либо политропном процессе зависит от показателя политропы; знак работы (положительный или отрицательный) зависит от направления процесса (расширение или сжатие). Если между точками 1 и 2 (рис.3.8) рабочее тело осуществляет последовательно ряд процессов расширения и сжатия и в результате возвращается в исходную точку, то в итоге рабочее тело совершает так называемый круговой процесс или термодинамический цикл. Такой цикл описывает изменение термодинамических параметров тела и преобразование тепла в работу в тепловых машинах.
Величина термодинамической работы и тепла в каком-либо политропном процессе зависит от показателя политропы; знак работы (положительный или отрицательный) зависит от направления процесса (расширение или сжатие). Если между точками 1 и 2 (рис.3.8) рабочее тело осуществляет последовательно ряд процессов расширения и сжатия и в результате возвращается в исходную точку, то в итоге рабочее тело совершает так называемый круговой процесс или термодинамический цикл. Такой цикл описывает изменение термодинамических параметров тела и преобразование тепла в работу в тепловых машинах.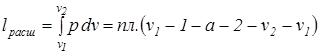 ;
;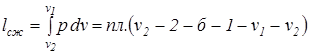 .
. , а также процесс в машине замкнут и повторяется, то можно получать непрерывно некоторую полезную работу
, а также процесс в машине замкнут и повторяется, то можно получать непрерывно некоторую полезную работу  .
.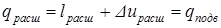 .
.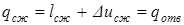 .
.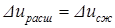 . Следовательно
. Следовательно 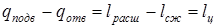 .
. .
.
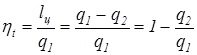 , (3.5)
, (3.5) .
. .
.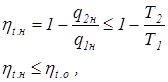

 , Вт/м2) пропорционален и противоположен по направлению градиенту температуры
, Вт/м2) пропорционален и противоположен по направлению градиенту температуры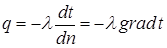 ( 3.6)
( 3.6) ,
,
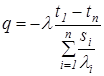 .
.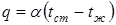 ,
,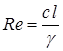
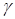 - коэффициент кинематической вязкости среды, м2/с.
- коэффициент кинематической вязкости среды, м2/с.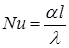 ,
, Для каждого этапа теплопередачи тепловой поток q будет одинаковым и равным:
Для каждого этапа теплопередачи тепловой поток q будет одинаковым и равным: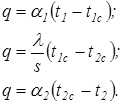
 ,
, .
.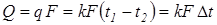 , (3.7)
, (3.7)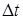 - температурный напор, К;
- температурный напор, К; 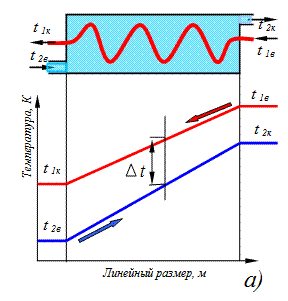

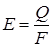 ,
,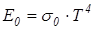 ,
,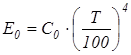 ,
,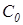 = 5,67, Вт/(м2К4) – коэффициент излучения абсолютно черного тела.
= 5,67, Вт/(м2К4) – коэффициент излучения абсолютно черного тела.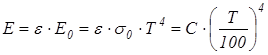 (3.8)
(3.8)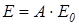
 Предположим, что тело 2 (рис.3.14) является абсолютно черным телом. Тепловой баланс для абсолютно черного тела можно представить уравнением:
Предположим, что тело 2 (рис.3.14) является абсолютно черным телом. Тепловой баланс для абсолютно черного тела можно представить уравнением: .
.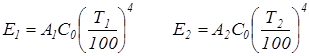 .
.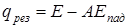
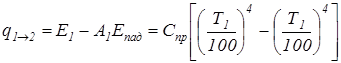 ,
,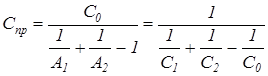 .
. , (3.9)
, (3.9) ,
,


