
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Равновесные (статические) изотермы адсорбции. Основные уравнения.
Анализ накопленного экспериментального материала позволил Брунауэру, Демингу, Теллеру выделить 5 основных типов изотерм (см. рис. выше). Первая изотерма отображает мономолекулярную, четыре остальных — моно- и полимолекулярную адсорбцию: 1 — кривая Лэнгмюровского типа, II — s-образная кривая, III — вогнутая кривая без перегибов с монотонным ростом da/dp, IV, V — кривые типов II, III, осложненные капиллярной конденсацией, сопровождающей полимолекулярную адсорбцию. Такая классификация охватывает подавляющее большинство описанных в литературе изотерм. Рассмотрим изотерму I (СЛАЙД 9), как наиболее распространенную для мономолекулярной адсорбции. По характеру зависимости величины адсорбции от давления на ней можно выделить три области: 1 —низких, 2 — средних, и 3 — высоких давлений (концентраций). В области 1 соотношение между давлениями и величиной адсорбции выражается прямой пропорциональностью — уравнением Генри (СЛАЙД 10): α= kP (1) К нему можно подойти, рассматривая процесс адсорбции из газовой фазы с динамической точки зрения. При соударении частиц адсорбата с поверхностью твердого тела они могут либо упруго отразиться, либо оставаться на поверхности в течение некоторого времени, а затем десорбироваться в объемную фазу. В результате такой задержки увеличивается концентрация частиц адсорбата на поверхности адсорбента. В условиях равновесия объемной фазы с адсорбированными молекулами концентрация частиц на поверхности твердого тела будет определяться выражением а = nτ (2) где а — число молекул на 1 смэ поверхности, п — число молекул, ударяющихся об 1 см2 поверхности за 1 с, τ — среднее время жизни молекулы на поверхности твердого тела. Для определения величины а надо знать n и τ. Величину п можно найти, исходя из кинетической теории газов (СЛАЙД 11): n = где Р — давление, М — молекулярный вес, Т — температура, R — газовая постоянная. Величина τ зависит от природы поверхности и адсорбирующегося газа. Френкелем была предложена зависимость τ от Т τ = τ0 exp(q / RT) где τ 0—период колебания адсорбированной молекулы в направлении, перпендикулярном к поверхности, q — теплота адсорбции. Объединяя уравнения (1), (2), (3), получаем
α = 2-я область изотермы, отвечающая средним давлениям и напоминающая по своему виду параболу, удовлетворительно описывается эмпирическим уравнением Бедекера — Фреиндлиха (молекулярная адсорбция за счет сил Ван-дер-Ваальса) (СЛАЙД 12): a = x / m = kP где m — масса адсорбента, Р — равновесное давление газа над адсорбентом, s — удельная поверхность, к и 1/nконстанты. Для адсорбции из раствора уравнение Бедекера — Фреиндлиха принимает следующий вид: a= x / m = βC где С — равновесная концентрация, β — константа. Данное уравнение, представляя собой уравнение параболы, не может дать прямолинейного нарастания адсорбции с давлением или концентрацией (область 1) и предельного значения адсорбции (область 3). В целом, адсорбционная изотерма I удовлетворительно описывается уравнением Лэнгмюра (мономолекулярная адсорбция) (СЛАЙД 13) a = где ат — емкость монослоя, т. е. максимальное количество вещества, которое может быть адсорбировано в виде монослоя па поверхности твердого тела, k = τ /
При этом считается что: 1) поверхность однородна с одно и той же теплотой адсорбции 2) сорбируемые молекулы остаются на своих местах в течении всего времени сорбции 3) соударение с чистой поверхностью приводит к сорбции, а с сорбируемой молекулой к отталкиванию 4) при сорбции устанавливается равновесие между концентрацией вещества в объеме растворе и поверхностью с ее свободными и занятыми участками.
Для обработки экспериментальных данных уравнение Лэнгмюра удобно выразить в виде P/a = 1/kam+P/am Откладывая Р/а от Р, получают прямую линию, из параметров которой находят ат и k. Наиболее универсальным уравнением, с помощью которого можно описать все виды изотерм, является уравнение БЭТ a = где aт — величина адсорбции, отвечающая мономолекулярному покрытию, С = ехр (E1 — E L )/RT, E1, —теплота адсорбции в первом слое, EL — теплота конденсации, (E1 — EL) — чистая теплота адсорбции.
Это уравнение было выведено Брунауэром, Эмметом и Теллером (1940 г.), исходя из теории полимолекулярной адсорбции и известного уравнения Лэнгмюра. Если E1>EL тогда С>>1, и уравнение (5) приводит к кривым типа II и IV. При E1<EL получаем кривые типа III и I. Таким образом, форма кривой изотермы меняется в зависимости от соотношения E1 и EL что и подтверждает универсальность данного уравнения. При малом значении Р/Рs оно переходит в уравнение Лэнгмюра. Уравнение БЭТ хорошо применимо ко многим адсорбентам в интервале P/Ps от 0,05 до 0,35 и обусловливает учет всех равноценных мест на поверхности адсорбента.
|
||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 513; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.95.38 (0.008 с.) |
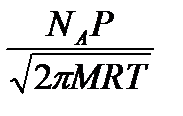 (3)
(3)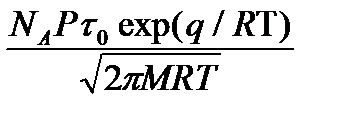 = kP - уравнение Генри
= kP - уравнение Генри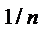 илиα = a / s = kP
илиα = a / s = kP 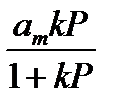 (4)
(4) . Действительно, при очень малых Р kР << 1 и уравнение (4) переходит в (1). В области высоких давлений kP> > 1, в результате уравнение (4) принимает вид а = ат и показывает, что количество адсорбированного газа не изменяется более с изменением давления.
. Действительно, при очень малых Р kР << 1 и уравнение (4) переходит в (1). В области высоких давлений kP> > 1, в результате уравнение (4) принимает вид а = ат и показывает, что количество адсорбированного газа не изменяется более с изменением давления. (5)
(5)


