Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Схема анаэробного циклического фосфорилирования.Содержание книги
Поиск на нашем сайте
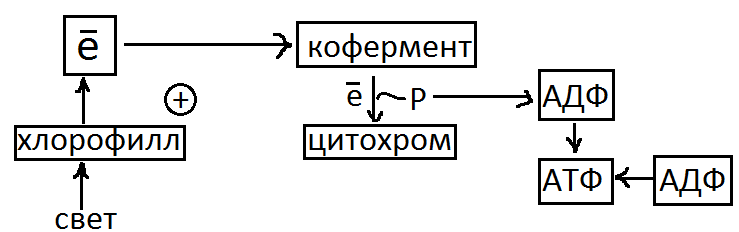
Фотосинтетическая электронно-транспортная цепь состоит из цитохромов, кофакторов (витамин К, ФМН). Под влиянием энергии света электронов из хлорофилла А передается коферменту А, который восстанавливается. Затем восстановленный кофермент переносит электроны к цитохрому, а от него обратно к хлорофиллу А. Таким образом электрон включается в цикл единственным продуктом которого является АТФ. Вторая реакция фотофосфорилирования называется нециклическим фосфорилированием. Суммарное уравнение реакции 2НАДФ + Схема нециклического фосфорилирования.
При нециклическом фосфорилировании электроны, выделенные хлорофилом А поглащаются НАДФ, который получает ионы водорода из воды и переходит в восстановленную форму. При этом выделяется кислород как побочный продукт использования воды в качестве донора электронов. Нециклическое фосфорилирование в хлоропластах делят на 2 отдельные фотохимические реакции: 1. Фотоокисление воды с выделением кислорода
2. Фотофосфорилирование, в котором восстановление НАДФ связано с образованием АТФ.
А – промежуточный продукт, который является акцептором электронов для одной и донором электронов для другой световой реакции. В фотоокислении воды участвует пигмент хлорофил В. 4. В качестве акцептора углекислого газа в фотосинтезе функционирует рибулозодифосфат это темновая фаза реакции. Химизм фиксации углекислого газа можно представить в виде цепи реакций называемых циклом Кальвина.
Рибулозо-1,5-дифосфат может присоединять новую молекулу углекислого газа и цикл повторяется снова.
Обмен жиров. 1. Биосинтез жиров 2. Распад жиров 3. Глиоксилатный цикл 1. Основные вещества, которые участвуют в синтезе жиров – углеводы. Прежде чем использоваться для синтеза жиров углеводы подвергаются структурным превращениям. Жиры состоят из глицерина и жирных кислот. Жирные кислоты при биосинтезе соединяются с фосфорилированным производным глицерол-3-фосфатом. Исходным веществом для его образования служит 3 фосфоглицериновый альдегид, который представляет собой промежуточный продукт синтеза, анаэробного распада углеводов и других процессов.
Синтез жирных кислот происходит более сложным путем, внем принимает участие ацетил кофермент А (один из промежуточных продуктов распада углеводов).
2. Жиры под действием фермента липаза, под действием воды расщепляются на глицерин и жирные кислоты.
Образовавшийся глицерин может подвергаться различным превращениям. Под действием фермента глицерол-киназы глицерин с участием АТФ фосфорилируется в глицерол-3-фосфат, затем под действием фосфатдегидрогиназы окисляется и образуется фосфодиоксиацетон, который изомеризуется превращается в 3фософоглицериновый альдегид. Эти соединения могут претерпевать окислительные превращения в цикле Кребса или из них может синтезироваться фруктозо-1,6-дифосфат, который может превращаться в разные углеводы. Жирные кислоты подвергаются окислению по следующей схеме.
Кроме этого основного пути многие высокомолекулярные жирные кислоты могут подвергаться α окислению (но оно не является основным).
Общая схема превращения жиров в упрощенном виде:
При биосинтезе из углеводов ацетил СоА включается в глиоксилатный цикл. 3. Глиоксилатный цикл -этот цикл представляет собой видоизмененный цикл Кребса.
При сравнении цикла Кребса с глиоксилатным циклом наблюдаются существенные различия между ними. Суммарное уравнение цикла Кребса можно записать упрощенно:
Суммарное уравнение глиоксилатного цикла:
Янтарная к-та Биологическое значение глиоксилатного цикла в том, что глиоксиловая кислота может служить исходным соединением для образования аминокислот, а также образование янтарной кислоты приводит к тому, что становиться возможным процесс превращения жирных кислот в углеводы.
Обмен аминокислот. 1. Путь превращения аммиачного азота в органических соединениях. 2. Реакция прямого аминирования. 3. Реакция переаминирования 4. Общие пути превращения аминокислот 5. Орнитиновый цикл 1. Человек и животные не способны усваивать минеральные соединения азота, и не могут синтезировать некоторые аминокислоты. В отличие от животных растительные организмы способны синтезировать все необходимые им азотистые соединения из аммиака, который поступает из почвы или образуется в результате восстановления нитратов, распада белков и т.д. Исходным веществом для синтеза органических соединений является аммиак. Процесс восстановления нитратов до аммиака схематически:
Этот процесс идет ступенчато через промежуточные стадии и катализируется несколькими ферментами
Нитраты быстро восстанавливаются в растениях. Для их восстановления необходимы фосфор, магний, молибден, железо. Интенсивность восстановления нитратов связано с дыханием и фотосинтезом. При нормальных условиях основным путем превращения аммиака в органических соединениях азота является образование аминокислот. Чаще всего этот процесс происходит в результате реакции между аммиаком и кетокислотами. Эта реакция прямого аминирования кетокислот, основной путь синтеза аминокислот в растениях. 2. Реакция синтеза аминокислот происходит в 2 стадии:
Основными процессами, которые приводят к образованию кетокислот цикл Кребса и реакция анаэробного распада углеводов. Аммиак является ядом для растений и при накоплении большого его количества может наблюдаться отравление тканей. Одна из основных реакций, приводящих к связыванию аммиака, это использование его для синтеза аминокислот. Избыточный аммиак обезвреживается при образовании амидов: аспарагина и глутамина. Исходными веществами являются аспарагиновая и глутаминовая кислоты.
Синтез аминокислот путем прямого аминирования возможен для ограниченного числа аминокислот, у которых в растениях имеются кетоаналоги. Образование большинства других аминокислот происходит в результате реакции переаминирования. 3. Реакция переаминирования была открыта в 1938г. Советским исследователем Браунштейном. В настоящее время изучено большое число реакций переаминирования приводящих к образованию различных аминокислот, их известно более 100. Наиболее известны следующие реакции переаминирования 1) Глутаминовая к-та + щавелевоуксусная к-та→α-кетоглутаровая к-та+аспарагиновая к-та 2) Глутаминовая к-та + пируват→α-кетоглутаровая к-та + аланин 3) Аспарагиновая к-та + пируват→щавелево-уксусная к-та + аланин Реакция переаминирования катализируется аминотрансферазами (двухкомпонентными ферментами). Их активной группой является фосфорилированная производная витамина В настоящее время общепринятым механизмом действия аминотрансфераз является теория Браунштейна и Шемякина. В соответствии с этой теорией механизм можно представить следующим образом: На I стадии аминокислота 1 реагирует с аминотрансферазой, которая представляет собой комплекс передоксаль фосфата со специфическим белком, в результате образуется соединение аминокислоты с ферментом и выделяется вода. В комплексном соединении такого типа понижена электронная плотность у α-углеродного атома соответствующего остатку аминокислоты. Водород легко подвергается диссоциации и это соединение переходит в свою таутомерную форму с соответствующей перегруппировкой двойных связей. Затем таутомерная форма комплекса подвергается гидролизу, образуется кетокислота-1 соответствующая исходная аминокислота, а аминогруппа переносится на аминотрансферазу.
На следующем этапе идет взаимодействие ПМФ с кетокислотой-II, образуется соответствующий комплекс, затем происходит его распад с переносом аминогруппы на кетокислоту-II образуется аминокислота-II и исходный перидоксаль фосфат (ПЛФ). ПЛФ + АК-I ПМФ + кетокислота-II 4. Аминокислоты подвергаются непрерывному обмену в биологических системах. Основные процессы превращения аминокислот это6 · Участие в обмене синтеза белка · Дезаминирование · Декарбоксилирование Аминокислоты также могут окисляться и служить источником энергии для организма. Дезаминирование – процесс распада на аммиак и соответствующие кислоты. Оно может происходить тремя основными путями: 1) Восстановительное дезаминирование
2) Гидролитическое дезаминирование
3) Окислительное дезаминирование
Декарбоксилирование – процесс отщипления углекислого газа. Если декарбоксилированию дикарбоновые кислоты то образуется соответствующая монокарбоновая кислота.
Если процессу подвергается монокарбоновая аминокислота, то образуются амины.
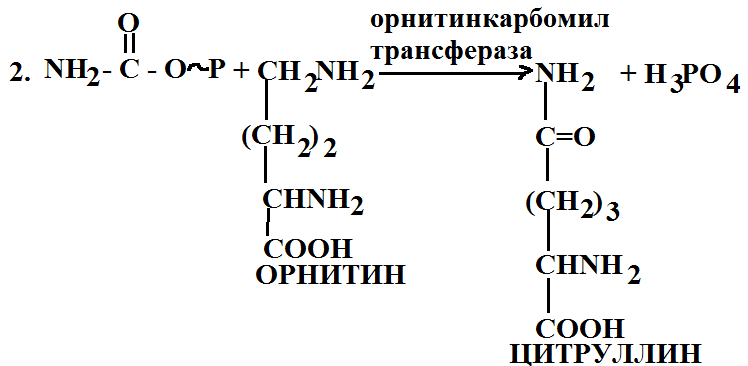
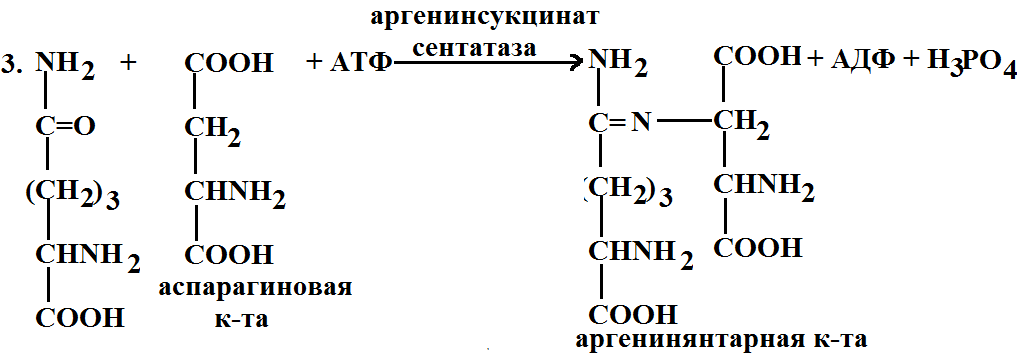
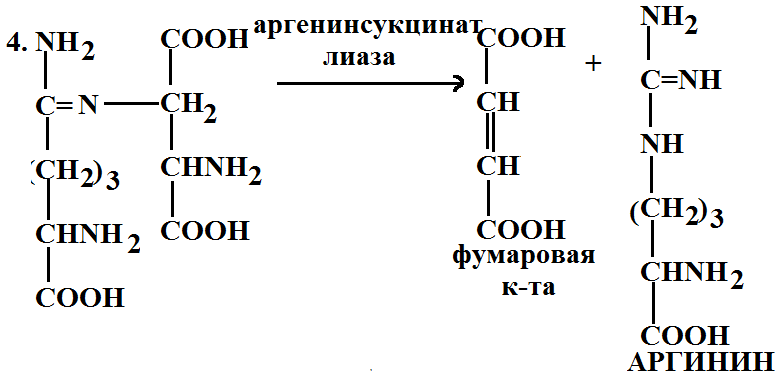
5. Орнитиновый цикл. В процессе жизнедеятельности организма белки распадаются, образуются аминокислоты, конечным продуктом распада белков является мочевина. Процесс ее образования происходит через орнитиновый цикл.
Фумаровая кислота может присоединять молекулу аммиака и превратиться в аспарагиновую кислоту, которая участвует в этом цикле.
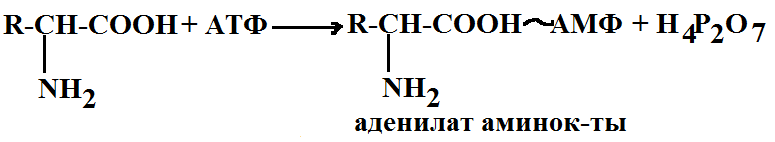
Обмен белков. 1. Биосинтез белков 2. Распад белков 1. В зависимости от возраста и состояния клетки интенсивность процесса обмена белков может быть сдвинута в ту или другую сторону. В молодых органах биосинтез преобладает над распадом старых, и наоборот. Для синтеза белков требуется большое количество энергии. Основными источниками энергии является дыхание (окислительное фосфорилирование) и фотосинтез (фотосинтетическое фосфорилирование). Каждый вид живых организмов синтезирует специфические белки, характеризующиеся определенным аминокислотным составом, молекулярным весом и последовательностью аминокислот. Резервуаром аминокислот является фракция свободных аминокислот (небелковая фракция). Процесс биосинтеза белка универсален для всех живых организмов земли. При синтезе белка в клетке реализуются 2 фундаментальных принципа: 1) Матричный принцип 2) Принцип комплементарности Матричный состоит в том, что взаимодействие происходит между пространственно-организованными фиксированными молекулами или системами. Одно из этих веществ обязательно является полимером. Матричный принцип является основным если необходимо обеспечить заранее заданную последовательность во вновь синтезируемом полимере. Такая закономерность биосинтеза наблюдается в процессе репликации (удвоения) ДНК при клеточном делении, а также при синтезе РНК на матрице ДНК (транскрипция). Принцип матричного синтеза реализуется через принцип комплементарности, который позволяет выбрать матрице необходимый мономер или полимер и установить его в нужном месте на матрице. Матричный синтез белка Этот синтез протекает в несколько этапов и катализируется многочисленными ферментами. Синтез белка состоит из четырех основных этапов: 1) активирование аминокислот На этом этапе происходит реакция между аминокислот и АТФ образуется комплексное соединение аминокислоты с адениловой кислотой.
Образование аденилатов катализируется особыми активирующими ферментами. В состав белков входит чуть более 20 аминокислот для каждой из них имеется свой активирующий фермент. Все эти ферменты относятся к классу лигаз и представляют собой аминоацил-РНК-синтетаза. Все эти ферменты отличаются субстратной специфичностью и эта специфичность так высока, что сводит к минимуму ошибки в биосинтезе белка.
2) Взаимодействие АК с транспортной РНК Транспортное РНК характеризуется низким молекулярным весом. В клетках имеется столько ТРНК сколько аминокислот участвующих в биосинтезе белка. У всех молекул ТРНК полинуклеотидная цепь заканчивается группировкой в состав которой входит 2 молекулы цитозина и 1 молекула аденазина. Т-РНК-Ц-Ц-А Присутствие на конце полинуклеотидной цепи ТРНК этих трех нуклеотидов говорит о том, что ТРНК активирована и к ней могут присоединяться аденилаты аминокислот. Присоединение катализируется тем же активирующим ферментом.
Таким образом аминокислоты соединяются с молекулами ТРНК. В молекуле ТРНК имеется другой конец состоящий также из трех нуклеотидов он называется адапторным участком или антикадоном. Этот участок имеет специфический для каждого ТРНК нуклеотидный состав и определяет к какому участку ИРНК (информационное РНК) может присоединяться данное ТРНК несущее АК. 3) Перенос аминокислот на информационную РНК в рибосоме и образование пептидных связей. Каждая рибосома состоит из двух молекул РНК и белков, обладающих щелочными свойствами. В реакционной среде должны присутствовать ионы магния, если нет, то рибосомы распадаются на 2 субъединицы. Синтез белка происходит только в стабильных рибосомах, их обычно 5-10% от общего количества рибосом в клетке ИРНК синтезируется на молекуле ДНК и имеет подобный ей нуклеотидный состав. Молекула ТРНК переносит аминокислоту на молекулу ИРНК в рибосому и происходит образование пептидных связей после процесса трансляции. Трансляция – это перевод с четырехбуквенного алфавита ИРНК на 20 буквенный алфавит полипептидных цепей. Этот перевод осуществляется при участии ТРНК, которая своим антикодоном может соединяться со строго определенным комплементарным ей участком РНК. Процесс биосинтеза требует больших затрат энергии. Синтез полипептидной цепи идет со скоростью 1-2 АК в секунду. 4) Высвобождение полипептидной цепи из рибосом. После удаления из рибосомы полипептидная цепь приобретает пространственную структуру, она скручивается в соответствии с расположением в ней активных аминокислотных остатков. Комплементарный Кроме основного пути синтез белков может происходить с использованием не свободных АК, а пептидов. Этот процесс происходит в результате реакции транспептидации, процесс катализируют ферменты транпептидазы. В результате реакции остаток пептида переносится с одной молекулы белка на другую. При этом образуются новые молекулы белков или пептидов.. реакции транспептидации можно разделить на 2 типа: 1) 2) В первой реакции переносится остаток пептида со свободной аминогруппой, а во второй пептид имеющий свободный гидроксил. В результате реакции транспептидации синтезируются белки специфичные для данного организма, т.к. исходные вещества также были продуктами биосинтеза данного организма.Этот путь синтеза более энергетически выгоден. 2. Распад белков может происходить 2 путями: · Под действием протеолитических ферментов · При окислении Преобладает гидролитический путь. Распад белков начинается с воздействия на них протеиназ. При этом белки расщепляются не полностью, а до полипептидов имеющих более низкий молекулярный вес. Некоторые белки под действием протеиназ не гидролизуются а только дезагрегируются переходя в более растворимое состояние. Затем на полипептиды действуют пептидазы и пептидгидролазы. Известны 3 группы ферментов этого типа, различающихся по характеру действия. 1) Аминопептидазы
2) Карбоксипептидаза – катализирует гидролиз пептидной связи у свободной карбоксильной группы.
3) Дипептидазы – катализирует гидролиз пептидной связи в дипептидах
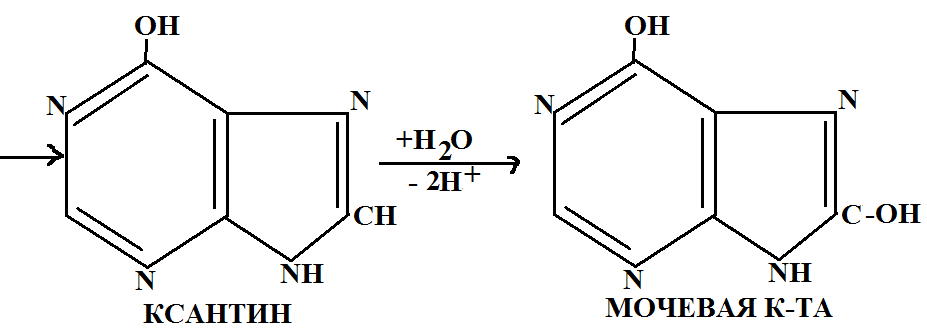
При распаде белков выделяется некоторое количество энергии. Для распада не является необходимым сохранение целостности клеточных структур. Обмен нуклеиновых веществ. 1. Биосинтез нуклеиновых кислот 2. Распад нуклеиновых веществ 1. Нуклеиновые кислоты на ряду с белками определяют главнейшие звенья обмена веществ, явления роста, размножения организмов и передачу наследственной информации. Основными структурными элементами молекул ДНК и РНК являются нуклеотиды, поэтому синтезу нуклеиновых кислот предшествует синтез нуклеотидов. Синтез пуриновых нуклеотидов происходит из рибозы-5-фосфата к которому последовательно присоединяются отдельные группы атомов и из них строится гетероциклический скелет. В образовании э Того скелета участвуют некоторые АК атомы N и С муравьиной и уксусной кислот, а также фолиевая кислота. Синтез перемединовых нуклеотидов отличается тем, что исходным веществом являются простые соединения аммиак и углекислый газ, рибозофосфат присоединяется на заключительных стадиях синтеза. Синтез ДНК. Молекула ДНК представляет собой две комплементарные полинуклеотидные цепи. Каждая цепь ДНК это спецефическая структура, которая может соединяться только с комплементарной структурной цепью. В период клеточного деления водородные связи между молекулами ДНК разрываются, цепи раскручиваются и расходятся. Затем под действием соответствующих ферментов к каждой из одиночных цепей присоединяются новые нуклеотиды. На каждой образовавшейся цепи строится комплементарная цепь прежнего состава. Способность ДНК давать строго определенные подобные себе новые молекулы играет определяющую роль в явлении наследственности и передачи генетической информации. Синтез нуклеиновых кислот катализируют ферменты ДНК нуклеотидилтрансферазы. Синтез РНК Содержание РНК во всех клетках не постоянно, оно зависит от возраста и физиологического состояния организма, а также от вида. Существует 4 типа синтеза молекул РНК: 1) Действие полинуклеотидилфосфорилазы В качестве источников дифосфата используются АДФ, УДФ, ГДФ, ЦДФ. Для синтеза РНК необходимо некоторое количество затравки полимера. Ее состав не влияет на состав синтезируемого продукта. Состав РНК зависит от количества и соотношения нуклеозиддифосфатов в реакционной среде. 2) Наращивание имеющихся полинуклеотидных цепей В клетках имеются ферменты отличные от предыдущего, которые катализирует присоединение трифосфата, АТФ, УТФ, ГТФ, ЦТФ к цепи нуклеиновых кислот. Трифосфаты присоединяются или к концу полинуклеотидной цепи или включаются между отдельными звеньями при этом отщепляется пирофосфатная кислота. 3) ДНК зависимый Это синтез РНК на участке молекулы ДНК как на матрице. Этим путем синтезируется и РНК. Такой синтез происходит в ядре и исходными веществами являются АТФ, ГТФ, ЦТФ, УТФ. ??????????????????????????????????????????????????????????????????????????????????????????????????????????????????? Синтез катализируется ферментом РНК нуклеотидилтрансферазой. Такой перенос информации называется транскрипцией. 4) РНК зависимый синтез РНК Этим путем синтезируются РНК вирусов, у которых в качестве наследственного материала содержится РНК. Этот синтез происходит на РНК как на матрице. Катализируется ферментом РНк зависимой РНКполимиразой. Синтез происходит из молекул рибонуклеозид-3-фосфат. 2. Распад ДНК и РНК происходит по фосфорноэфирным связям. Расщепление происходит до мононуклеотидов и фосфорной кислоты под действием фермента рибонуклеазы или дезоксирибонуклеазы. Образовавшиеся нуклеотиды расщепляются под действием фосфотаз до нуклеозидов, а они в свою очередь подвергаются расщеплению гликозидной связи между основанием и пентозой. Образуются пуриновые, перемидиновые основания и углеводы. Распад пуриновых оснований. Конечным продуктом пуринового обмена в животном организме служит мочевая кислота, у растений аммиак, глиоксиловая кислота, углекислый газ.
|
||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 920; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.20.30 (0.011 с.) |

 + 2АДФ +
+ 2АДФ + 

 +
+  + 2 АТФ
+ 2 АТФ





 Образовавшееся соединение реагирует с новой молекулой Со-А, приведенный цикл реакций повторяется снова и из четырех углеродного соединения синтезируется шестиуглеродное. Число атомов в образующихся кислотах всегда будет четным.
Образовавшееся соединение реагирует с новой молекулой Со-А, приведенный цикл реакций повторяется снова и из четырех углеродного соединения синтезируется шестиуглеродное. Число атомов в образующихся кислотах всегда будет четным.
 После преведенного цикла реакций кислота может вновь подвергаться таким же превращениям и отщеплять новые молекулы ацетил Со-А, в конечном итоге вся углеродная цепочка будет расщеплена на двухуглеродные фрагменты. Такой путь распада называется β окислением жирных кислот.
После преведенного цикла реакций кислота может вновь подвергаться таким же превращениям и отщеплять новые молекулы ацетил Со-А, в конечном итоге вся углеродная цепочка будет расщеплена на двухуглеродные фрагменты. Такой путь распада называется β окислением жирных кислот.














 перидоксина (перидоксальфосфат-ПЛФ)
перидоксина (перидоксальфосфат-ПЛФ)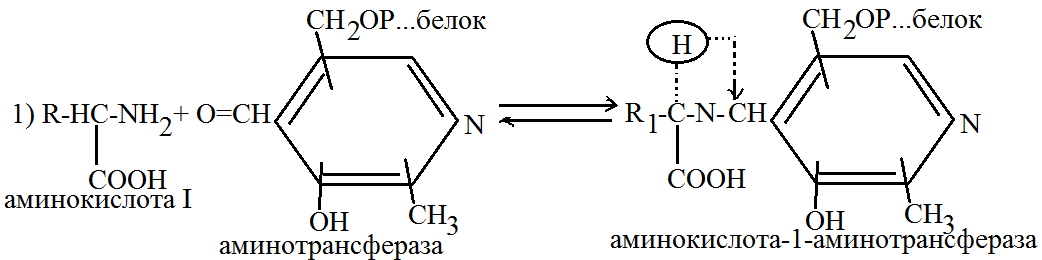
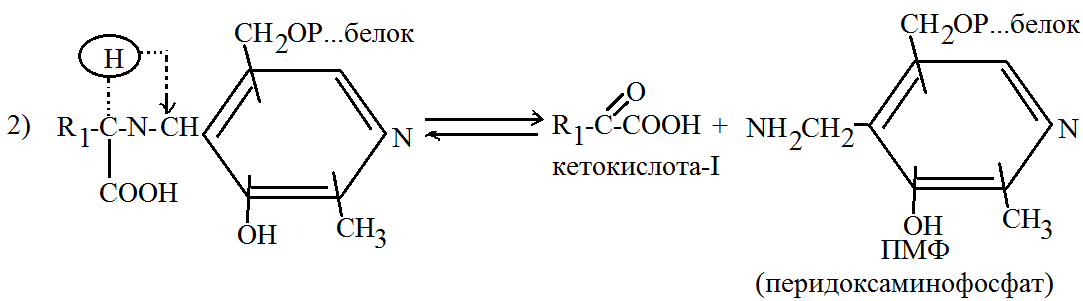
 ПМФ + кетокислота-I
ПМФ + кетокислота-I