Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лекция 18. Периодическая система элементов Менделеева.
18.1 Принцип Паули. 18.2 Периодическая система элементов Менделеева. Принцип Паули. На первый взгляд представляется, что в атоме все электроны должны заполнить уровень с наименьшей возможной энергией. Опыт же показывает, что это не так. Действительно, в соответствии с принципом Паули, в атоме не может быть электронов с одинаковыми значениями всех четырёх квантовых чисел. Совокупность электронов атома с одинаковыми значения квантового числа п образует так называемую оболочку. В соответствии с номером п
Таблица 18. 1 Оболочки подразделяются на подоболочки, отличающиеся квантовым числом l. Число состояний в подоболочке равно 2(2 l + 1).
Таблица 18. 2
Понимание периодической системы элементов основано на идее об оболочечной структуре электронного облака атома. Каждый следующий атом получается из предыдущего добавлением заряда ядра на единицу (е) и добавлением одного электрона, который помещают в разрешённое принципом Паули состояние с наименьшей энергией. Периодическая система элементов Менделеева. В 1869 году Д.И.Менделеев сформулировал фундаментальный закон природы - закон периодичности. "Свойства простых тел, также формы и свойства соединений элементов, находятся в периодической зависимости от величины атомных вевов элементов" На основании этого закона и была построена периодическая система химических элементов. (рис 18.1)
Рис. 18. 1
Лекция 19. Радиоактивность. Закон радиоактивного распада. 19.1 Опыт Резерфорда
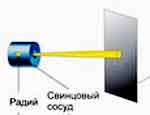
19.2 Опыт Резерфорда по рассеянию альфа-частиц. 19.3 Состав радиоактивного излучения 19.4 Типы радиоактивных распадов. 19.5 Закон радиоактивного распада. В 1896 г. французский физик А. Беккерель, изучая явление люминесценции солей урана, установил, что уран испускает лучи неизвестного типа. Опыт Резерфорда.
Рисунок 19. 1 В магнитном поле поток радиоактивного излучения распадается на 3 составляющих: альфа- лучи, бета-лучи и гамма-лучи.
Рисунок 19. 2 Явление радиоактивности свидетельствовало о сложном строении атома.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 111; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.116.40.177 (0.005 с.) |