Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
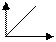
Вкажіть залежність оптичної густини від довжини хвилі. Позначте осі. ⇐ ПредыдущаяСтр 5 из 5
МОДУЛЬ № 2 Включає матеріал лекцій з дисципліни за темами 1. Мас-спектрометрія. Прилади та техніка виконання аналізу. 2. Радіометричні методи аналізу: теоретичні основи, класифікація. Види випромінювання. Методи визначення інтенсивності та засоби реєстрації радіаційних випромінювань. Техніка безпеки при роботі з радіаційними речовинами. Прилади та техніка виконання аналізу. 3. Електрохімічні методи аналізу. 3.1.Кондуктометрія. Теоретичні основи методу. Пряма кондуктометрія та кондуктометричне титрування. Визначення моменту еквівалентності. Пристрої та техніка виконання аналізу. 3.2. Потенціометрія: пряма та потенціометричне титрування. Електроди: індикаторні, порівняння, йон-селективні. Техніка потенціометричного титрування: окисно-відновного, з утворенням комплексної сполуки, осаду. рН-метрія. 3.3. Кулонометрія: теоретичні основи методу. Кулонометричне титрування, техніка виконання аналізу. 3.4. Полярографія: теорія методу, електродні системи, якісний та кількісний аналіз.
Питання контрольних завдань
1. Теоретичне обґрунтування мас-спектрального методу аналізу. Зобразіть схему мас-спектрометра, позначте основні вузли приладу. 2. Радіометрія: види випромінювання, період напіврозпаду, класифікація нуклідів. Інтенсивність та енергія випромінювання. Природний радіаційний фон. 3. Прямий та активаційний методи радіометричних вимірювань. Радіометричне титрування. 4. Зобразіть схему радіометру та поясніть процеси, які відбуваються в лічильнику Гейгера-Мюлера. 5. Пряма потенціометрія. Електроди І та ІІ роду у потенціометрії. Розрахунок потенціалу. 6. Індикаторні електроди та електроди порівняння в потенціометричному методі аналізу. Розрахунок потенціалу. 7. Потенціометричне титрування окисно-відновних систем. Індикаторні електроди. 8. Потенціометричне титрування малорозчинних сполук. 9. Потенціометричне титрування на основі реакцій комплексоутворення. 10. рН-метрія. Зобразіть схему скляного електроду. 11. Техніка потенціометричних вимірювань. 12. Теоретичне обґрунтування та види кондукто-метричного методу аналізу.
13. Зобразіть схему та позначте основні вузли приладу для кондуктометричних вимірювань – реохордного мосту. 14. Пряма кондуктометрія. Техніка аналізу. 15. Кондуктометричне титрування сильних та слабких кислот. Зобразіть криві титрування та поясніть їх напрямок. 16. Теоретичні основи високочастотного кондукто-метричного титрування. Еквівалентна схема комірки. 17. Теоретичне обґрунтування кулонометричного методу аналізу. Зобразіть схему приладу для кулонометричних вимірювань, позначте основні вузли. 18. Процеси на генераторних та індикаторних електродах у йод-йодидному кулонометричному титруванні. 19. Полярографія: теорія методу, електродні системи, якісний та кількісний аналіз. Розрахункові задачі 1. Обчисліть масову частку Калію в досліджуваному зразку, якщо активність чистого калій хлориду склала 1800 імп/хв., а активності досліджуваних зразків (Ах) наступні:
Зразки 1 2 3 Ах, імп/хв. 220 616 480. 2. При кондуктометричному титруванні 50 мл розчину хлоридної кислоти розчином з молярною концентрацією еквівалентів натрій гідроксиду 0,01 моль/л отримані наступні дані:
VNaOH,мл 0 2,0 4,0 6,0 8,0 10,0 χ, См · см–1 1,50 1,09 0,67 0,63 0,99 1,35
Обчисліть концентрацію хлоридної кислоти за даними кондуктометричного титрування.
3. Суміш HCl і CH3COOH, що аналізується, вмістили у мірну колбу місткістю 50,00 мл і довели водою до мітки. При кондуктометричному титруванні 10,00 мл розчину розчином з молярною концентрацією NaOH 0,1 моль/л (стала посудини k = 1,104) отримали результати:
V(NaOH), мл 7,00 8,00 9,00 10,00 11,00 χ, Cм 2,50 2,20 1,90 1,93 1,96
V(NaOH), мл 12,00 13,00 14,00 15,00 16,00 χ, Cм 2,00 2,20 2,50 2,85 3,20 Побудуйте криву титрування і визначте масу HCl і CH3COOH у вихідному розчині. 4. Обчисліть концентрацію натрій хлориду в розчині (моль/л та г/л), якщо при потенціометричному титруванні 20,0 мл розчину розчином з молярною концентрацією Hg(NO3)2 0,1000 моль/л одержані наступні результати:
V(Hg(NO3)2), мл 10,0 18,0 19,0 19,5 19,9 20,0 20,1 20,5 Е, мВ 501 552 570 589 629 704 737 757. 5. Кальцій у розчині відтитрували етилендіамін-тетраацетатом, який генерували із відповідного ртутного комплексу. Кінець реакції встановили потенціометрично. Обчисліть вміст кальцію (мкг) у розчині, якщо титрування проводили при силі струму 4 мА впродовж часу 59 с (в генеруванні 1 йону етилендіамінтетраацетату приймало участь 2 електрона).
6. Визначте масову частку алюмінію в зразку вольфрамової присадки масою 4,7 г, якщо кулонометричне біамперометричне бром-бромідне титрування алюмінію у вигляді оксихінолінату проводили при силі струму 9 мА протягом 20 хвилин 15 секунд. Вихід за струмом дорівнює 100 %. 7. Скільки часу треба, щоб з розчину калій хлориду силою струму 2 А виділити хлор об’ємом 11,2 л (н.у.), якщо вихід за струмом становить 80 %. Запишіть електродні процеси. 8. Визначте молярну концентрацію еквівалентів розчину ферум (ІІ) сульфату, якщо на кулонометричне титрування 10 мл розчину з генерацією титранту I2 пішло 8 хвилин при силі струму 300 мА. 9. Визначте концентрацію (мг/л) водного розчину сірководню, якщо для титрування 20 мл генерували йод на протязі 6 хвилин 5 секунд при силі струму 50 мА. І2 + Н2S = 2І– + S + 2Н+. 10. На повне відновлення цинку в кулонометрі знадобилося 26 хвилин при силі струму 100 мА. Визначте масу та молярну концентрацію цинку в розчині, якщо для кулонометричного аналізу взяли 10 мл розчину.
11. Якої сили повинен бути струм, щоб електролізом з розчину AgNO3 виділити срібло масою 1,08 г за 6 хвилин? Запишіть електродні процеси. 12. Обчисліть масу та молярну концентрацію Fe3+-йонів у розчині, якщо при прямій кулонометрії на повне відновлення 10 мл розчину пішло 18 хвилин при силі струму 300 мА. 13. Обчисліть масу та молярну концентрацію Cu2+-йонів у розчині, якщо при прямій кулонометрії на повне відновлення 10 мл розчину пішло 28 хвилин при силі струму 200 мА. 14. Кулонометричне йод-йодидне титрування тіосульфату натрію кількістю речовини 2·10–5 моль проводили 3 хвилини 12 секунд. Обчисліть силу струму та кількість електрики. 15. Наважку сплаву масою 0,8743 г розчинили і через розчин протягом 30,0 хвилин пропускали струм силою 0,200 А, внаслідок чого на катоді повністю виділилася мідь. Обчисліть масову частку міді в сплаві, якщо вихід за струмом становив 90,0 %.
НАВЧАЛЬНІ ТЕСТИ До модулю № 2 1) Метал, який занурений у розчин однойменних йонів, відноситься до електродів: а) І роду; в) ІІІ роду; б) ІІ роду; г) ІV роду. 2) Формула Нернста для електродів І роду: а) б)
а) генераторному катоді; в) індикаторному аноді; б) генераторному аноді; г) індикаторному катоді. 4) Хлоридсрібний електрод переважно заповнений розчином: а) конц. НСl; в) 0,1 моль/ л НСl; б) 1 моль/л НСl; г) насиченим КСl.
а) б) в) г) 6) При кулонометричному йод-йодидному титруванні з біамперометричною індикацією точки еквівалентності на індикаторному катоді відбувається процес: а) Cr – 3 б) 2Н2О + 2 в) 2І– – 2 г) І2 + 2 7) Потенціал для електродів ІІ роду розраховується за формулою:
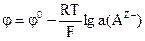 ; в) ; в) 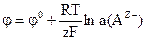 ; ;
б) 8) Кондуктометричний метод аналізу заснований на вимірюванні: а) електропровідності електроліту; б) сорбції та десорбції речовини; в) природної радіоактивності;
г) потенціалу електроду. 9) Мембрана скляного електроду для вимірювання рН містить йони: а) Н+; в) Li+; б) Cs+; г) Fe2+. 10) При кулонометричному титруванні кількість титранту визначають за формулою: а) б) 11) Прилад для вимірювання електропровідності: а) йономір; в) кулонометр; б) мікроамперметр; г) реохордний міст. 12) Основна вимога до кількісного кулонометричного титрування: а) застосування електродів з благородних металів; б) сталість напруги;
г) 100-% вихід за струмом.
а) б)
а) невідтворюваність; б) неселективність; в) неточність визначення; г) низька чутливість до йонів, що визначають. 15) При кулонометричному йод-йодидному титруванні на генераторному аноді відбувається процес: а) 2Н2О + 2 б) І2 + 2S2O32– = 2I– + S4O62– ; в) 2І– – 2 г) І2 + 2 16) При кондуктометричному титруванні сильної кислоти сильною основою питома електропровідність: а) спочатку падає, потім зростає; в) зростає; б) спочатку зростає, потім падає; г) не змінюється.
а) б) в) г) 18) Стандартні розчини не потрібні у: а) фотоколориметрії; в) потенціометрії; б) кулонометрії; г) нефелометрії. 19) Питома електропровідність сильних електролітів в розбавлених розчинах з ростом концентрації: а) спочатку зменшується, потім зростає; б) спочатку зростає, потім зменшується; в) зростає; г) зменшується. 20) Перевагами високочастотного кондуктометричного титрування не є: а) можливість вимірювання в агресивних середовищах; б) висока чутливість; в) доступність апаратури; г) висока точність. 21) Недоліки кондуктометричного методу аналізу: а) неможливість титрування забарвлених розчинів; б) недоступність вимірювальних приладів; в) низька селективність; г) повільність вимірювань. 22) При кулонометричному йод-йодидному титруванні на генераторному катоді відбувається процес: а) Cr – 3 б) І2 + 2S2O32– = 2I– + S4O62–; в) 2Н2О + 2 23) Недоліком потенціометричного титрування окисно-відновних систем є: а) повільність встановлення потенціалу; б) зниження чутливості з часом; в) низька точність; г) складність апаратури. 24) Метод аналізу, заснований на вимірюванні електрорушійної сили:
а) кондуктометричний; в) поляриметричний; б) потенціометричний; г) кулонометричний. 25) Переваги мас-спектрометричного методу: а) можливість визначення майже всіх елементів періодичної системи; б) похибка визначення менше 1 %; в) доступність обладнання; г) невисока вартість. 26) В електростатичному полі конденсатора мас-спектрометру змінюється траєкторія польоту заряджених часток в залежності від: а) маси частки; в) часу польоту; б) заряду частки; г) кількості проби. 27) Інтегральна крива – графічне зображення: а) функції потенціалу від об’єму титранту; б) функції відношення ∆ Е/∆V від об’єму титранту; в) функції відношення V/∆ Е від об’єму титранту; г) функції відношення ∆Е 2/∆V2 від об’єму титранту. 28) Диференційна крива являє собою графічне зображення: а) функції відношення ∆Е/∆V от об’єму титранту; б) функції потенціалу від об’єму титранту; в) функції відношення V/∆Е від об’єму титранту; г) функції відношення ∆Е2/∆V2 від об’єму титранту.
а) б) в) г) 30) При визначенні рН розчину в якості електроду порівняння застосовують: а) каломельний; в) ртутний; б) платиновий; г) мідний. 31) Метод аналізу, що заснований на вимірюванні кількості електрики, що витрачається на електроліз певної кількості речовини: а) кулонометрія; в) амперометрія; б) потенціометрія; г) полярографія.
а) б) в) г)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-25; просмотров: 173; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.135.203 (0.09 с.) |



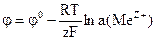 ; в)
; в) 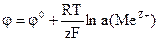 ;
;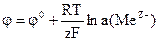 ; г)
; г) 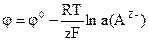 .
. 3) При кулонометричному йод-йодидному титруванні титрант виділяється на:
3) При кулонометричному йод-йодидному титруванні титрант виділяється на:





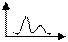
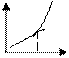
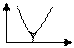 5) Вкажіть диференційний графік потенціометричного титрування. Позначте осі.
5) Вкажіть диференційний графік потенціометричного титрування. Позначте осі.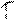
 = Cr3+ , Ni – 2
= Cr3+ , Ni – 2 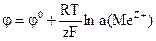 ; г)
; г) 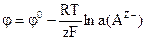 .
.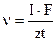 ; в)
; в) 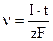 ;
;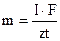 ; г)
; г) 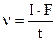 .
.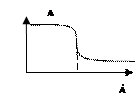 в) сталість сили струму;
в) сталість сили струму; 13) Потенціал скляного електроду визначають за формулою:
13) Потенціал скляного електроду визначають за формулою: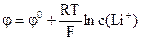 ; в)
; в) 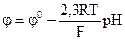 ;
;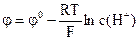 ; г)
; г) 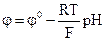 .
. 14) Недоліками йон-селективних електродів є:
14) Недоліками йон-селективних електродів є:


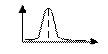
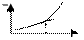

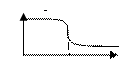
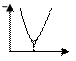 32) Вкажіть графік кондуктометричного титрування сильної кислоти розчином лугу. Позначте осі..
32) Вкажіть графік кондуктометричного титрування сильної кислоти розчином лугу. Позначте осі..