Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лекции по физической химии – 3 курс, I частьСтр 1 из 6Следующая ⇒
ЛЕКЦИИ ПО ФИЗИЧЕСКОЙ ХИМИИ – 3 курс, I часть Теория электролитической диссоциации электролитов Для количественной оценки процесса диссоциации введено понятие степени диссоциации α. Под степенью диссоциации понимают отношение числа распавшихся молекул к общему их количеству. Таким образом, в общем случае только некоторая часть молекул распадается на ионы. Согласно этому определению, α = n / N, где n – число диссоциированных молекул; N – общее число молекул. Величины n и N можно заменить соответствующими концентрациями. Величина α зависит от концентрации. Переносчики электричества – ионы образуются уже при растворении электролита, независимо от прохождения через раствор электрического тока. Вещества по их способности к диссоциации Аррениус классифицировал следующим образом:
Эту классификацию с возможными оговорками используют и в настоящее время, хотя некоторые вещества не вполне ей соответствуют: например, хлорная кислота HСlO4 является сильным электролитом, но при повышении концентрации степень ее диссоциации сильно падает. Кроме того, существуют немногочисленные электролиты средней силы.
Недостатки теории Аррениуса. Физические причины, которые приводят к диссоциации электролитов, в теории Аррениуса не рассматриваются. Предполагается, что ионы в растворе ведут себя подобно молекулам идеального газа, т. е. не взаимодействуют друг с другом. Не обсуждался также и вопрос о том, почему заряженные частицы, на которые должны были бы распространяться законы электростатики, не взаимодействуют друг с другом в растворах. Позднее пришлось пересмотреть и некоторые количественные выводы из теории Аррениуса в ее первоначальной форме. Возникла необходимость внести поправки при описании свойств концентрированных растворов слабых электролитов. Вместе с тем, самые основы теории остались неизменными.
Теория Аррениуса наиболее точно выполняется в присутствии избытка постороннего электролита (фона), не принимающего участия в изучаемых ионных равновесиях. Это показывает, что основной причиной неточного выполнения положений теории является взаимодействие ионов друг с другом и с молекулами растворителя. Для сильных электролитов процесс диссоциации является полным, и закон действующих масс неприменим. Попытки Аррениуса найти следы недиссоциированных молекул в сильных электролитах и использовать свою теорию для описания их свойств оказались безуспешными. Термодинамическая теория растворов сильных электролитов
Растворы электролитов содержат ионы – заряженные частицы, которые взаимодействуют как между собой (ион-ионное взаимодействие), так и с молекулами растворителя (сольватация, гидратация). Поэтому в растворах электролитов наблюдаются более значительные отклонения от идеальности, чем в растворах неэлектролитов той же концентрации. Для них необходимо вводить понятия активности и коэффициентов активности. Экспериментальные величины коэффициентов активностей Подвижности ионов
слабые: λ = сильные: λ = λ++λ- 9. Закон независимого движения ионов (Кольрауш, 1886г.)
10. Коэффициент электрической проводимости
11. Разбавленные растворы
Подвижности ионов 1. Предельные подвижности (молярные эл-ности) ионов,
2.
Числа переноса ионов 1. Определение: 2. Связь а) б) Классификация электродов Электроды I и II рода, газовые, Ox-Red эл-ды, мембранные Электроды 1го рода 1. Понятие, условная запись и электродный процесс
2. Вывод уравнения Нернста а) условная схема электрохимич. цепи и химическая реакция
б) 2. Примеры: а) б) амальгамный электрод, 4. Неметалл/раствор, Электроды 2го рода 1. Понятие, условная запись и потенциалопределяющая реакция на электроде 2 го рода: 2. Вывод уравнения Нернста а) условная схема электрохимич. цепи и химическая реакция
б) 3. Примеры а) б) в) ртутнооксидный эл-д:
4. Электроды 2го рода – как электроды сравнения а) недостатки водородного электрода 1) неудобен и опасен в эксплуатации (баллон с газообраз-ным водородом, сложность поддержания постоянства давления 2) чувствительность потенциала электрода к загрязнениям и микропримесям в растворе (отравление б) достоинства электродов 2-го рода 1) устойчивое и воспроизводимое от электрода к электроду значение потенциала 2) простота в изготовлении и эксплуатации в)
Газовые электроды 1. Понятие, устройство и функция электрода-катализатора Газовые электроды состоят из металлического проводника, который одновременно контактирует и с газом, пропускаемым через раствор электролита, и с самим раствором, содержащим ионы, природа которых соответствует продуктам окисления или восстановления этого газа на электроде. Металлический проводник, обычно, платиновая проволока, покрытая осадком платиновой черни, сам в электродной реакции участия не принимает, а выполняет лишь функцию инертного проводника и катализирует процесс установления адсорбционного равновесия. 2. Примеры а) водородный электрод,
б) кислородный электрод:
Элементы с переносом Концентрационными элементами с переносом наз. элементы, составленные из одинаковых по химической природе электродов, но с разными по концентрациям растворами электролитов, причем между р-рами имеется непосредственная граница соприкосновения
т.о. в ходе работы элемента происходит перенос потенциал-определяющих ионов из одного полуэлемента в другой и при выравнивании концентраций работа элемента прекращается 2. Элементы без переноса 1) амальгамные,
2) газовые, 3) эл. цепь из двух хим. элементов с одним раствором электролита, включенных навстречу друг другу
+
Применение измерений ЭДC 1. Расчет т/д функций химических реакций, протекающих в г.э.
Химические источники тока 1. Любой хим. г. э. – источник электрического тока а) гальванич. элементы. - автономные источники электропитания б) нет мех частей, бесшумны, способны к длит. эксплуатации б) от карм. фонариков до энергоустановок космич. кораблей 2. Первичные (одноразового действия) источники тока Элемент Лекланше (1868):
Длительность эксплуатации ограничивается - запасом активной массы отрицательного электрода 3. Вторичные источники тока – многократно используемые а) Свинцовый кислотный аккумулятор,
б) в процессе разряда – оба электрода покрываются в) Принцип работы аккумулятора: 4. Топливные элементы а) современные теплосиловые установки:
б) определение топливного эл-та как устройства, в котором химическая энергия топлива путем электрохимического окисления непосредственно преобразуется в электрическую
в) водородно-кислородный элемент,
г) в отличие от обычных гальванических элементов восстановитель (топливо) и окислитель (кислород) не являются его составной частью, а подаются извне и энергия вырабатывается, пока в него поступают топливо и окислитель. Электроды т.э. не вступают в токообразующие реакции и не расходуются в процессе работы. Ресурс работы т.э. определяется запасом топлива и окислителя и не зависит от активной массы анода. д) недостаток – малая скорость процесса: необходим электрокат ализатор!
ЛЕКЦИИ ПО ФИЗИЧЕСКОЙ ХИМИИ – 3 курс, I часть
|
|||||||
|
Последнее изменение этой страницы: 2017-01-25; просмотров: 176; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.14.6.194 (0.044 с.) |

 (λ++λ-),
(λ++λ-), , при
, при  , где
, где 
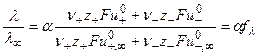 , где
, где 
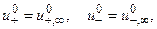 .
. 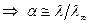


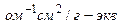 ,
,

 Эстафетный механизм переноса эл-ности ионами
Эстафетный механизм переноса эл-ности ионами 



 _
_


 .
.
 ,
, 


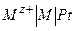 ,
, 






 ,
,  ,
, 
 :
: 
 :
:  ,
, 





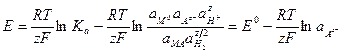
 ,
, 
 ,
, 
 ,
, ,
, 
 , взрывоопасен)
, взрывоопасен) )
) [(насыщ., 0,1н, 1н) каломельный, хлорсеребр.)
[(насыщ., 0,1н, 1н) каломельный, хлорсеребр.)

 ,
, 
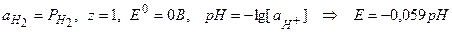
 ;
;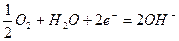
 ,
, 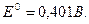
 ,
, 

 ,
, 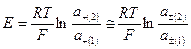
 где
где 

 ,
, 

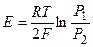



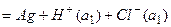

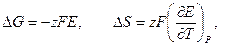
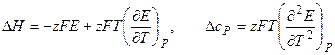
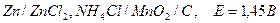
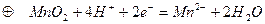 ,
, 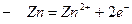
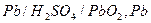

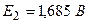
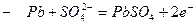

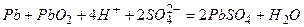
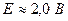


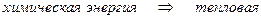
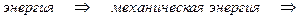
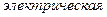
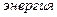 ,
, 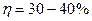 .
.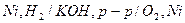 :
: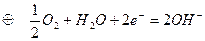

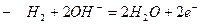
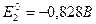
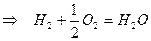
 (реакция горения водорода)
(реакция горения водорода)