Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Дополнительные виды химической связи
Все многообразие биохимических свойств природных белков обусловлено последовательностью соединения аминокислот с различными боковыми радикалами – R-группами в их полипептидной цепи. Схематично боковые цепи полипептидов могут быть представлены следующим образом:
Различие химических свойств R-групп аминокислот ведет к появлению в структуре белковой молекулы химических связей различной прочности – дисульфидных, водородных, ионных связей и гидрофобных взаимодействий.
Дисульфидная связь Пептидные цепочки аминокислот (в белке их может быть одна, две или несколько) могут быть сшиты внутри себя или между собой за счет образования ковалентной дисульфидной связи –S–S– между сульфгидрильными группами –SН, расположенными в полипептидной цепи цистеинов:
Водородная связь Водородные связи возникают в результате дипольных взаимодействий между ковалентно связанным водородным атомом, имеющим положительный заряд, и отрицательно заряженным ковалентно связанным атомом – акцептором. Ниже приведены примеры различных водородных связей (обозначены пунктиром), образующихся в белках. Водородная связь между пептидными группами:
Водородная связь между двумя гидроксильными группами:
Водородная связь между заряженной карбоксильной группой и гидроксильной группой тирозина:
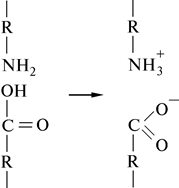
Водородная связь между заряженной аминной группой и заряженной карбоксильной группой:
Водородная связь между гидроксильной группой серина и карбонильной пептидной связи:
Ионная связь Такие кислоты, как лизин и аспарагиновая, могут образовывать солевые или ионные связи:
Гидрофобное взаимодействие Если ионные и водородные связи возникают в результате дипольных взаимодействий полярных атомов или заряженных групп двух или более полярных молекул, то гидрофобные взаимодействия связывают неполярные (гидрофобные) части одной или нескольких молекул в водных растворах. Энергия каждого такого взаимодействия мала, но из-за большого числа таких взаимодействий они способны создавать устойчивые структуры. Под влиянием гидрофобных взаимодействий происходит сближение неполярных участков полипептидной цепи за счет вытеснения молекул воды и ослабления их взаимодействия с водной средой.
Способностью к гидрофобному взаимодействию обладают боковые цепи (R-группы) валина, лейцина, изолейцина, фенилаланина, пролина, триптофана, метионина и цистеина. Ионнные, водородные связи и гидрофобные взаимодействия определяют и стабилизируют специфическую пространственную структуру молекулы каждого белка. Структура белковой молекулы Форма белковой молекулы По форме молекулы и особенностям пространственной структуры белки подразделяют на глобулярные, форма молекулы которых близка к сферической или эллиптической (отношение короткой и длинной осей до 1:50), и фибриллярные, молекула которых имеет более удлиненную форму и может образовывать многомолекулярные нитевидные структуры – фибриллы. Глобулярные белки состоят из одной полипептидной цепи или нескольких, плотно свернутых за счет нековалентных и ковалентных связей в компактную частицу – глобулу. Эти белки, разнообразные по составу аминокислотных остатков и биологическим функциям, обычно хорошо растворимы в воде. Многие глобулярные белки являются ферментами. Почти все их полярные R-группы находятся на поверхности молекулы и гидратированы, гидрофобные R-группы находятся внутри молекулы. Фибриллярные белки состоят из вытянутых или скрученных в спирали полипептидных цепей, расположенных параллельно и связанных многочисленными связями нековалентной и ковалентной природы. Как правило, это белки, образующие прочные жесткие структуры, они нерастворимы в воде и более однородны по составу аминокислотных остатков, преимущественно гидрофобных, в полипептидных цепях.
Структура белка Различают: 7.2.1 Первичную; 7.2.2 Вторичную; 7.2.3 Третичную; 7.2.4 Четвертичную структуру белковых молекул. 7.2.1Первичной структурой белка называют порядок чередования (последовательность) аминокислотных остатков, соединенных ковалентными пептидными связями, в полипептидной цепи белка. За счет внутрицепочечных взаимодействий между белковыми R-группами полипептидная цепь белка свертывается в «нативную» (природную) пространственную структуру самопроизвольно.
7.2.2 Вторичная структура белка – это ориентация в пространстве аминокислотных остатков, соединенных в полипептидную цепь. В формировании вторичной структуры участвуют водородные связи. Различают три основных типа вторичной структуры полипептидных цепей: α-спираль, β-структура (складчатый слой) и беспорядочный клубок. При образовании α-спирали полипептидная цепь закручивается вокруг оси. Наиболее устойчива правая α-спираль. В β-структуре (складчатом слое) пептидные цепи располагаются параллельно друг другу, образуя пространственную фигуру, подобную складчатому листу, сложенному гармошкой. Как правило, такую структуру образуют вытянутые полипептидные цепи. Стабилизация β-структуры достигается за счет образования межцепочечных водородных связей, в которых принимают участие все пептидные связи. Вторичная структура белковой молекулы определяется ее первичной структурой. Поэтому, выяснив аминокислотную последовательность в полипептидной цепи, можно предсказать ее вторичную структуру, так как аминокислоты существенно различаются по способности образовывать α-спираль или β-структуру. При различных технологических процессах α-спирали или β-структуры белков могут переходить друг в друга. Этим, в частности, объясняется уменьшение размеров шерстяных вещей при стирке их в горячей воде. 7.2.3 Третичная структура белка определяет пространственную организацию белковой молекулы. Образуется самопроизвольно и зависит от размера, формы и полярности аминокислотных остатков, их последовательности расположения в полипептидной цепи, т.е. от первичной структуры белка, а также от типа ее вторичной структуры, определяя пространственную организацию белковой молекулы. Она возникает в результате взаимодействия между цепочками полипептидов и поддерживается дисульфидными и ионными связями, гидрофобными и электростатическими взаимодействиями. Третичная структура, так же как и вторичная, обусловлена аминокислотной последовательностью в полипептидной цепи, но если вторичная структура определяется взаимодействием аминокислот в близлежащих участках цепи, то третичная структура зависит от аминокислотной последовательности далеко расположенных друг от друга участков цепи. В результате множества сравнительно слабых связей все части пептидной цепи белка оказываются фиксированными относительно друг друга, образуя компактную структуру. 7.2.4 Четвертичная структура – это ассоциация нескольких полипептидных цепей, которая образуется посредством нековалентных связей (водородных, ионных, гидрофобных взаимодействий, электростатического притяжения). Каждая полипептидная цепь, участвующая в образовании четвертичной структуры, называется субъединицей, или протомером. Молекулы белков, обладающие четвертичной структурой, при определенных условиях могут диссоциировать на субъединицы – протомеры, а при других условиях вновь ассоциировать, образуя димеры, а затем первоначальную олигомерную молекулу. Ошибочное соединение протомеров в олигомерном белке или соединение с другими белками невозможно (комплементарность). Комплементарные взаимодействия лежат в основе практически всех биохимических процессов в живых организмах, включая ферментативные процессы переноса соединений через мембраны, защитные реакции белков и множество других процессов, происходящих с участием белковых молекул. Т.о. белки состоят из аминокислотных остатков, связанных между собой пептидными связями и образующих полипептидные цепи, которые за счет дисульфидных, водородных, ионных связей, а также гидрофобных взаимодействий располагаются в пространстве определенным образом, т.е. имеют при данных условиях определенную конформацию. Нативная конформация возникает при нормальных физиологических условиях.
|
||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 106; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.17.154.171 (0.007 с.) |