Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Белковые вещества и их свойстваСтр 1 из 6Следующая ⇒
БЕЛКОВЫЕ ВЕЩЕСТВА И ИХ СВОЙСТВА Определение Из органических веществ, входящих в состав растений и других живых организмов, наиболее важными в биологическом отношении являются белковые вещества, или белки. Составляя основу цитоплазмы клеток, белки выполняют основную роль в жизни всех организмов. Белками называются высокомолекулярные коллоидные соединения, состоящие из α-аминокислот. Локализация белков Основная масса белков растений концентрируется в семенах и плодах. В других тканях растений их массовая доля относительно невелика по сравнению с тканями животных, где белки составляют до половины и более массы сухого вещества живой клетки. Так, массовая доля белков в вегетативных органах растений – стеблях, листьях, корнях – колеблется от 0,3 до 3,0%, зато в зерне злаков белков от 8 до 15%, в семенах масличных растений - от 18 до 28, в семенах бобовых растений – от 25 до 50% (в пересчете на сырую массу). В мышцах – 18-23%, печень – 17-19%, мозг – 7-9% (в пересчете на сырую массу). Величина массовой доли белковых веществ в зерне и семенах во многом определяет биологическую ценность продуктов, получаемых при технологической переработке; лишь в некоторых случаях наличие белков осложняет технологию переработки растительного сырья и ухудшает качество получаемых продуктов. Повышенное содержание белков в корнеплодах свеклы затрудняет кристаллизацию сахарозы из маточных растворов. При высоком содержании белковых веществ в листьях табака табачный дым приобретает неприятный запах жженных перьев. Такое табачное сырье ценится ниже. В то же время в виноделии присутствие белков в виноградном сусле придает специфический аромат виноматериалам. В хлебопечении повышенное содержание белка в зерне пшеницы во многом определяет высокое качество и хлеба. Функции белков В растениях белки выполняют разнообразные функции, важнейшими из которых являются: 3.1 Каталитическая. Наиболее многочисленная группа белков – это белки-ферменты, катализирующие биохимические реакции. С помощью белков-ферментов в живой клетке достигается закономерная последовательность химических превращений веществ, обеспечивающая жизнедеятельность организмов. 3.2 Запасная. Запасные белки в больших количествах накапливаются в клетках зерна и семян при созревании на растении, а затем при прорастании зерна и семян гидролизуются до аминокислот или молекулярных пептидов, используемых затем клеткой для формирования нового растения на ранних стадиях развития. В животном организме белки в запас не откладываются поэтому должны поступать вместе с пищей ежедневно в необходимых количествах.
3.3 Защитная. Защитные белки предохраняют живой организм от разрушения или способствуют его выживанию при повреждении. Защитная функция белков – токсинов, вырабатываемых растениями, заключается в том, что они защищают растения от поедания их животными, а также ингибируют протеолитические ферменты насекомых-вредителей, повреждающих семена многих растений. 3.4 Структурная. Структурные белки входят в состав покровных тканей растений, в том числе семян и плодов. Они составляют также структурную основу биомембран клеток, обеспечивая сохранение органеллами клетки необходимой последовательности биохимических реакций. 3.5 Сократительная и двигательная. К этим белкам относится миозин мышц. 3.6 Регуляторная. Эти белки участвуют в регуляции обменных реакций. К ним относятся многие гормоны, например инсулин, регулирующий обмен глюкозы. 3.7 Транспортная. Транспортные белки переносят специфические молекулы или ионы. Например, гемоглобин. Связывают кислород и переносят его к периферическим тканям. Незаменимые амминокислоты Растения могут синтезировать все аминокислоты, входящие в состав белков. Организм человека и животных не может синтезировать все аминокислоты, необходимые для синтеза белков. Аминокислоты, не синтезируемые организмом человека и животных, но входящие в состав их белков, получили название незаменимых, или обязательных аминокислот. Для человека такими незаменимыми аминокислотами являются 10 аминокислот: валин, треонин, лейцин, изолейцин, метионин, лизин, аргинин, гистидин, фенилаланин, триптофан. Эти аминокислоты входят в состав белков, но могут также находиться в живых организмах и в свободном состоянии. Остальные 10 аминокислот (заменимые аминокислоты), входящие в состав белка, могут синтезироваться организмом животных и человека из других соединений, в том числе и из незаменимых аминокислот.
Пептидная связь В составе белковой молекулы аминокислоты образуют неразветвленную цепь, в которой они связаны ковалентными пептидными связями:
Свободная карбоксильная группа дипептида может соединяться с аминной группой еще одной молекулы какой-либо аминокислоты, в результате образуется трипептид. В случае соединения пептидными связями четырех остатков аминокислот получается тетрапептид, пяти – пентапептид и т.д. Общее название соединений, состоящих из нескольких аминокислот, - полипептиды – это и есть белки. Многие из полипептидов встречаются в свободном виде в растениях, тканях животных и микроорганизмах и имеют большое значение в качестве промежуточных продуктов обмена веществ и физиологически весьма активных соединений. Примером может служить открытый выдающимся английским биохимиком Ф. Гопкинсом трипептид глютатион, состоящий из остатков гликокола, цистеина и глютаминовой кислоты:
Глютатион содержится во всех живых клетках. Его содержание особенно высоко в зародыше пшеничного зерна и дрожжах. Чрезвычайно важная роль глютатиона в обмене веществ заключается в том, что он является сильным восстановителем и очень легко подвергается окислению. К числу полипептидов принадлежит ряд антибиотиков, образуемых микроорганизмами веществ, убивающих другие микроорганизмы или угнетающих их рост: грамицидин, тироцидин, лихениформин. Некоторые из этих антибиотиков широко применяются в медицине для борьбы с болезнетворными микробами. Аминокислоты – это алфавит белковой молекулы: соединив их в различном порядке, можно получить бесконечное множество разнообразных белков.
Дисульфидная связь Пептидные цепочки аминокислот (в белке их может быть одна, две или несколько) могут быть сшиты внутри себя или между собой за счет образования ковалентной дисульфидной связи –S–S– между сульфгидрильными группами –SН, расположенными в полипептидной цепи цистеинов:
Водородная связь Водородные связи возникают в результате дипольных взаимодействий между ковалентно связанным водородным атомом, имеющим положительный заряд, и отрицательно заряженным ковалентно связанным атомом – акцептором. Ниже приведены примеры различных водородных связей (обозначены пунктиром), образующихся в белках. Водородная связь между пептидными группами:
Водородная связь между двумя гидроксильными группами:
Водородная связь между заряженной карбоксильной группой и гидроксильной группой тирозина:
Водородная связь между заряженной аминной группой и заряженной карбоксильной группой:
Водородная связь между гидроксильной группой серина и карбонильной пептидной связи:
Ионная связь Такие кислоты, как лизин и аспарагиновая, могут образовывать солевые или ионные связи:
Гидрофобное взаимодействие Если ионные и водородные связи возникают в результате дипольных взаимодействий полярных атомов или заряженных групп двух или более полярных молекул, то гидрофобные взаимодействия связывают неполярные (гидрофобные) части одной или нескольких молекул в водных растворах. Энергия каждого такого взаимодействия мала, но из-за большого числа таких взаимодействий они способны создавать устойчивые структуры.
Под влиянием гидрофобных взаимодействий происходит сближение неполярных участков полипептидной цепи за счет вытеснения молекул воды и ослабления их взаимодействия с водной средой. Способностью к гидрофобному взаимодействию обладают боковые цепи (R-группы) валина, лейцина, изолейцина, фенилаланина, пролина, триптофана, метионина и цистеина. Ионнные, водородные связи и гидрофобные взаимодействия определяют и стабилизируют специфическую пространственную структуру молекулы каждого белка. Структура белковой молекулы Форма белковой молекулы По форме молекулы и особенностям пространственной структуры белки подразделяют на глобулярные, форма молекулы которых близка к сферической или эллиптической (отношение короткой и длинной осей до 1:50), и фибриллярные, молекула которых имеет более удлиненную форму и может образовывать многомолекулярные нитевидные структуры – фибриллы. Глобулярные белки состоят из одной полипептидной цепи или нескольких, плотно свернутых за счет нековалентных и ковалентных связей в компактную частицу – глобулу. Эти белки, разнообразные по составу аминокислотных остатков и биологическим функциям, обычно хорошо растворимы в воде. Многие глобулярные белки являются ферментами. Почти все их полярные R-группы находятся на поверхности молекулы и гидратированы, гидрофобные R-группы находятся внутри молекулы. Фибриллярные белки состоят из вытянутых или скрученных в спирали полипептидных цепей, расположенных параллельно и связанных многочисленными связями нековалентной и ковалентной природы. Как правило, это белки, образующие прочные жесткие структуры, они нерастворимы в воде и более однородны по составу аминокислотных остатков, преимущественно гидрофобных, в полипептидных цепях.
Структура белка Различают: 7.2.1 Первичную; 7.2.2 Вторичную; 7.2.3 Третичную; 7.2.4 Четвертичную структуру белковых молекул. 7.2.1Первичной структурой белка называют порядок чередования (последовательность) аминокислотных остатков, соединенных ковалентными пептидными связями, в полипептидной цепи белка.
За счет внутрицепочечных взаимодействий между белковыми R-группами полипептидная цепь белка свертывается в «нативную» (природную) пространственную структуру самопроизвольно. 7.2.2 Вторичная структура белка – это ориентация в пространстве аминокислотных остатков, соединенных в полипептидную цепь. В формировании вторичной структуры участвуют водородные связи. Различают три основных типа вторичной структуры полипептидных цепей: α-спираль, β-структура (складчатый слой) и беспорядочный клубок. При образовании α-спирали полипептидная цепь закручивается вокруг оси. Наиболее устойчива правая α-спираль. В β-структуре (складчатом слое) пептидные цепи располагаются параллельно друг другу, образуя пространственную фигуру, подобную складчатому листу, сложенному гармошкой. Как правило, такую структуру образуют вытянутые полипептидные цепи. Стабилизация β-структуры достигается за счет образования межцепочечных водородных связей, в которых принимают участие все пептидные связи. Вторичная структура белковой молекулы определяется ее первичной структурой. Поэтому, выяснив аминокислотную последовательность в полипептидной цепи, можно предсказать ее вторичную структуру, так как аминокислоты существенно различаются по способности образовывать α-спираль или β-структуру. При различных технологических процессах α-спирали или β-структуры белков могут переходить друг в друга. Этим, в частности, объясняется уменьшение размеров шерстяных вещей при стирке их в горячей воде. 7.2.3 Третичная структура белка определяет пространственную организацию белковой молекулы. Образуется самопроизвольно и зависит от размера, формы и полярности аминокислотных остатков, их последовательности расположения в полипептидной цепи, т.е. от первичной структуры белка, а также от типа ее вторичной структуры, определяя пространственную организацию белковой молекулы. Она возникает в результате взаимодействия между цепочками полипептидов и поддерживается дисульфидными и ионными связями, гидрофобными и электростатическими взаимодействиями. Третичная структура, так же как и вторичная, обусловлена аминокислотной последовательностью в полипептидной цепи, но если вторичная структура определяется взаимодействием аминокислот в близлежащих участках цепи, то третичная структура зависит от аминокислотной последовательности далеко расположенных друг от друга участков цепи. В результате множества сравнительно слабых связей все части пептидной цепи белка оказываются фиксированными относительно друг друга, образуя компактную структуру. 7.2.4 Четвертичная структура – это ассоциация нескольких полипептидных цепей, которая образуется посредством нековалентных связей (водородных, ионных, гидрофобных взаимодействий, электростатического притяжения). Каждая полипептидная цепь, участвующая в образовании четвертичной структуры, называется субъединицей, или протомером. Молекулы белков, обладающие четвертичной структурой, при определенных условиях могут диссоциировать на субъединицы – протомеры, а при других условиях вновь ассоциировать, образуя димеры, а затем первоначальную олигомерную молекулу.
Ошибочное соединение протомеров в олигомерном белке или соединение с другими белками невозможно (комплементарность). Комплементарные взаимодействия лежат в основе практически всех биохимических процессов в живых организмах, включая ферментативные процессы переноса соединений через мембраны, защитные реакции белков и множество других процессов, происходящих с участием белковых молекул. Т.о. белки состоят из аминокислотных остатков, связанных между собой пептидными связями и образующих полипептидные цепи, которые за счет дисульфидных, водородных, ионных связей, а также гидрофобных взаимодействий располагаются в пространстве определенным образом, т.е. имеют при данных условиях определенную конформацию. Нативная конформация возникает при нормальных физиологических условиях. Физические свойства 1. В живых организмах белки находятся в твердом и растворенном состоянии. Многие белки являются кристаллами, однако, они не дают истинных растворов, т.к. молекула их имеет очень большую величину. Водные растворы белков – это гидрофильные коллоиды, находящиеся в протоплазме клеток, и это активные белки. Кристаллические твердые белки – это запасные соединения. Денатурированные белки (кератин волос, миозин мускулов) являются опорными белками. 2. Все белки имеют, как правило, большую молекулярную массу. Она зависит от условий среды (t°, рН) и методов выделения и колеблется от десятков тысяч до миллионов. 3. Оптические свойства. Растворы белка преломляют световой поток, и чем больше концентрация белка, тем сильнее преломление. Пользуясь этим свойством, можно определить содержание белка в растворе. В виде сухих пленок белки поглощают инфракрасные лучи. Они поглощаются пептидными группами.
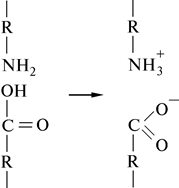
Денатурация белков Нативная конформация глобулярного белка – исключительно лабильная и подвержена изменениям под влиянием химических агентов или энергетических и механических нагрузок. Под влиянием внешних факторов может происходить разрыв большого числа связей, стабилизирующих пространственную структуру белковой молекулы, упорядоченная, уникальная для каждого белка конформация пептидной цепи нарушается, и белковая молекула целиком или большая ее часть принимает форму беспорядочного клубка – происходит его денатурация. Денатурация белка – это внутримолекулярная перегруппировка его молекулы, нарушение нативной конформации, не сопровождающиеся расщеплением пептидной связи. Аминокислотная последовательность белка не изменяется. В результате денатурации происходит нарушение вторичной, третичной и четвертичной структур белка, образованных нековалентными связями, и биологическая активность белка утрачивается полностью или частично, обратимо или необратимо в зависимости от денатурирующих агентов, интенсивности и продолжительности их действия. Изоэлектрическая точка Белки, как и аминокислоты, - амфотерные электролиты, которые мигрируют в электрическом поле со скоростью, зависящей от их суммарного заряда и рН среды. При определенном для каждого белка значении рН его молекулы электронейтральны. Это значение рН называется изоэлектрической точкой белка. Изоэлектрическая точка белка зависит от числа и природы заряженных групп в молекуле. Белковая молекула заряжена положительно, если рН среды ниже величины ее изоэлектрической точки, и отрицательно, если рН среды выше значения изоэлектрической точки данного белка. В изоэлектрической точке белок обладает наименьшей растворимостью и наибольшей вязкостью, в результате чего происходит наиболее легкое осаждение белка из раствора – коагуляция белка. Изоэлектрическая точка – одна из характерных констант белков. Однако если довести раствор белка до изоэлектрической точки, то сам по себе белок все же не выпадает в осадок. Это объясняется гидрофильностью белковой молекулы.
Гидрофильность белка На поверхности белков расположены различные гидрофильные группы, притягивающие дипольные молекулы воды. Гидрофильность различных групп разная.
Пептидная связь связывает одну молекулу воды,
карбоксильная группа –СОО– - 4 молекулы воды, – NН+3-аминная группа – 1 и т.д. Поэтому вокруг белковой молекулы находится так называемая гидратационная оболочка, придающая устойчивость белковым растворам и препятствующая осаждению молекулы белка.
Высаливание белков Если удалить эту водную оболочку у белковой глобулы, т.е. уменьшить ее гидратацию, то молекулы белка начнут агрегировать, образуя более крупные частицы, и под действием собственной силы тяжести начнут оседать из раствора в виде осадка. Удалить водную оболочку можно с помощью органических растворителей (спирта, ацетона) или солей щелочных или щелочно-земельных металлов. Поскольку молекулы солей, спирта или ацетона более гидрофильны, чем белковые глобулы, они снимают с белка водную оболочку, в результате чего он легко выпадает в осадок. Так как осаждение белка из раствора достигается путем добавления к белковому раствору достаточного количества солей, процесс выделения белка из раствора под влиянием солей носит название высаливания. Осаждающая способность соли зависит от химической природы как катиона, так и аниона. По своей осаждающей способности катионы и анионы объединены в так называемые лиотропные ряды, где они размещены по уменьшающейся слева направо осаждающейся способности.
Набухание белков При определенных условиях белковые растворы набухают, превращаются в коллоидные системы – гели. В гелях растворитель и белок образуют одну внешне гомогенную массу, подобную студню. Высушенный гель, помещенный в воду, впитывает ее в очень больших количествах. Это впитывание воды называется набуханием геля. Процессы набухания белков играют важную роль в пищевой промышленности. Набухание зерна при его обработке – замочке, кондиционировании и прорастании, набухание муки при изготовлении теста, образование студней при добавлении желатина к различным кондитерским изделиям – все эти процессы связаны с набуханием белков. Явление, обратное набуханию, т.е. выделение воды из геля, называется синерезисом. Классификация белков Все природные белки (протеины) подразделяют на два больших класса: 10.1 Простые; 10.2 Сложные. 10.1 Простые белки гидролизуются кислотами или щелочами до аминокислот и не дают при гидролизе других органических и неорганических соединений. Они состоят только из остатков α-аминокислот. Классификация простых белков основана на растворимости. 10.1.1 Альбумины – белки, которые растворяются в воде. К этим белкам относятся белок куриного яйца, белки зародыша семян злаковых (однодольных) растений, белки семян двудольных растений. Из водных растворов эти белки хорошо высаливаются, а при кипячении – денатурируют. Название белков обычно связано с ботаническим названием растения, в котором они локализованы. Альбумины у пшеницы и риса называются лейкозинами, гороха – легумелинами, а у клещевины – рицинами. 10.1.2 Глобулины – белки, растворимые в солях. Обычно для их экстракции применяют 10%-ный раствор NaCl. Глобулины составляют большую часть белков семян масличных культур. Многие альбумины и глобулины обладают ферментивными свойствами. Глобулины кукурузы получили название маизин, фасоли – фазеолин, гороха – легулеин, конопли – эдестин, арахиса – арахин, тыквы – кукурбитин. 10.1.3 Проламины – белки, которые растворяются в 60-80%-ном растворе этилового спирта. Название «проламины» они получили вследствие того, что в их состав входит большое количество аминокислоты пролина. Проламины синтезируются только в семенах злаковых растений. Проламины пшеницы называют глиадинами, кукурузы – зеинами, сорго – каферинами. 10.1.4 Глютелины – белки, которые извлекаются из растительных тканей разбавленными растворами щелочей (0,2%-ный NаОН). Глютелины пшеницы – это глютенин, риса – оризенин. Проламины и глютелины составляют основную массу клейковины пшеницы. Качество клейковины, а следовательно и муки, зависит от количества и соотношения глиадина и глютенина. Кроме этих четырех групп белков к простым относят также следующие белки со специфическими свойствами: 10.1.5 Протамины – это белки небольшой молекулярной массы, состоящие на 80% из щелочных аминокислот и не содержащие серу. Эти белки обнаружены только в сперме (молоках) рыб. По величине молекул протамины – самые малые белки. Некоторые из них даже состоят из семи аминоксилот, среди которых аргинин, пролин и серин составляют больше половины молекулы. 10.1.6 Гистоны – низкомолекулярные белки также основного характера, содержатся в хромосомах клеточных ядер и играют важную роль в образовании структуры хроматина. Гистоны – настоящие белки, в их состав входят почти все белковые аминокислоты. Они характеризуются высоким содержанием основных аминокислот: примерно каждая четвертая аминокислота – это аргинин или лизин. Они локализованы у растений в ядре клетки, рибосомах и митохондриях, где играют роль структурных элементов этих органоидов. 10.2. Сложные белки кроме аминокислотных остатков белковой части молекулы содержат также небелковую, или простетическую группу. Простетическая группа может быть представлена химическими веществами различной природы (табл. 1). Сложные белки подразделяются по небелковому компоненту. Связи между полипептидными цепями белка и простетической группой могут быть ковалентными и нековалентными. Таблица 1 Простетические группы некоторых сложных белков
Сложный белок, или холопротеин, в зависимости от химической природы, может диссоциировать на белковую часть, или апопротеин, и простетическую группу:
Среди сложных белков липопротеины и нуклеопротеины различаются очень высокой сложностью строения, образуя в живой клетке надмолекулярные структуры, специфическая организация которых обусловлена биохимическими процессами, протекающими с участием этих белков.
К группе гемопротеинов относятся гемоглобин и его производные, миогло-бин, хлорофиллсодержащие белкии ферменты (вся цитохромная система, каталаза и пероксидаза). Все они содержат в качестве небелкового компонента структурно сходные железо- (или магний)порфирины, но различные по составу и структуребелки, обеспечивая тем самым разнообразие их биологических функций. Далее более подробно рассмотрено химическое строение гемоглобина, наиболее важного для жизнедеятельности человека и животных соединения. Гемоглобин в качестве белкового компонента содержит глобин, а небелкового – гем. Видовые различиягемоглобина обусловлены глобином, в то время как гем одинаков у всех видов гемоглобина. Основу структуры простетической группы большинства гемосодержащих белков составляет порфириновое кольцо, являющееся в свою очередь производным тетрапиррольного соединения – порфирина. Последний состоит из четырех замещенных пирролов:
соединенных между собой метиновыми мостиками (—СН=). Незамещенный порфирин называется порфином. В молекуле гема порфин представлен в виде протопорфирина IX, содержащего четыре метильные группы (—СН3), две винильные группы (—СН=СН2) и два остатка пропионовой кислоты. Протопорфирин, присоединяя железо, превращается в гем.
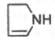
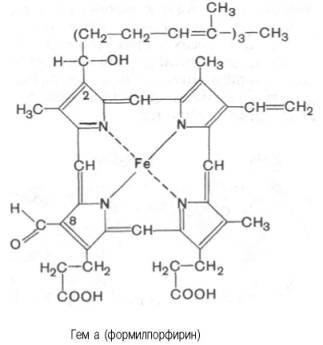
Из формулы видно, что железо связано с двумя атомами азота молекулы протопорфирина ковалентно и с двумя другими – координационными связями, обозначенными пунктирными линиями. В зависимости от химической природы групп, находящихся в боковой цепи, порфирины классифицируют на этио-, мезо-, копро- и протопорфирины. Последние наиболее распространены в природе. Из возможных 15 изомеровпротопорфиринов благодаря наличию трех разных заместителей самым распространенным оказался протопорфирин IX. Гем в виде гем-порфирина является простетической группой не только гемоглобина и его производных, но и миоглобина, каталазы, пероксидазы ицитохромов b, с и c1 (см. главу 9); в то же время в цитохромах а и a3, входящих в состав интегрального комплекса, названного цитохромокси-дазой, содержится гем а, называемый также формилпорфирином:
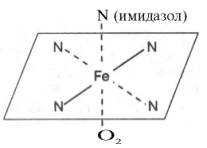
Гем а вместо метильной группы содержит формильный остаток (в 8-м положении) и вместо одной винильной группы (во 2-м положении) – изопре-ноидную цепь. Железо своими четырьмя связями образует комплекс с порфирином, а оставшиеся 5-я и 6-я координационные связи железа вмолекулах гемоглобина и цитохромов связываются с белковыми компонентами по-разному. В частности, в гемоглобинах (и миоглобине) благодаря 5-й координационной связи железо соединяется с атомом азота имидазольной группы гистидина белковой молекулы. Шестая координационная связьжелеза предназначена для присоединения кислорода (с образованием оксигемоглобина и оксимиоглобина) или других лигандов: СО, цианидов и др. (рис. 2.1). В цитохромах, напротив, и 5-я, и 6-я координационные связи железа соединены с остатками гистидина и метио-нина (в цитохроме с обе винильные группы соединены еще и с остатками цистеина) белковой молекулы. Этим, вероятнее всего, могут быть объяснены функции железа вгемоглобине, валентность которого не изменяется при присоединении кислорода (в отличие от валентности железа в цитохромах): в гемоглобинежелезо остается двухвалентным независимо от присоединения или отдачи кислорода. Структурная организация гемоглобина (и миоглобина) была описана в главе 1. Дж. Кендрью и М. Перутц расшифровали конформацию этих молекул(Нобелевская премия 1962 г.). Дыхательная функция гемоглобина крови подробно рассматривается в курсе физиологии. Здесь следует указать на уникальную роль гемоглобина в траспорте кислорода от легких к тканям и диоксида углерода от тканей к легким. Это элементарное проявление жизни – дыхание, хотя и выглядит простым, основано на взаимодействии многих типов атомов в гигантской молекуле гемоглобина. Подсчитано, что в одном эритроците содержится около 340000000 молекул гемоглобина, каждая из которых состоит примерно из 103 атомов С, Н, О, N, S и 4 атомовжелеза. Атом железа расположен в центре гема-пигмента, придающего крови характерный красный цвет. Каждая из 4 молекул гема «обернута» одной полипептидной цепью. В молекуле гемоглобина взрослого человека HbА (от англ. adult – взрослый) содержатся четыре полипептидные цепи, которые вместе составляют белковую часть молекулы – глобин. Две из них, называемые α-цепями, имеют одинаковую первичную структуру и по 141 аминокислотному остатку. Две другие, обозначаемые β-цепями, также идентично построены и содержат по 146 аминокислотных остатков. Таким образом, вся молекула белковой части гемоглобина состоит из 574 аминокислот. Во многих положениях α- и β-цепи содержат разныеаминокислотные последовательности, хотя и имеют почти одинаковые пространственные структуры. Получены доказательства, что в структурегемоглобинов более 20 видов животных 9 аминокислот в последовательности оказались одинаковыми, консервативными (инвариантными), определяющими функции гемоглобинов; некоторые из них находятся вблизи гема, в составе участка связывания с кислородом, другие – в составе неполярной внутренней структуры глобулы.
Рис. 2.1. Координационные связи атома железа в молекуле гема. Все 4 связи с атомами азота пиррольных колец расположены в одной плоскости, 5-я и 6-я координационные связи (с атомом азота имидазольного кольца гистидина и с кислородом соответственно) – по разные стороны перпендикулярно к этой плоскости. В дополнение к основному гемоглобину HbA1в крови взрослого человека доказано существование мигрирующего с меньшей скоростью приэлектрофорезе гемоглобина НbА2, также состоящего из 4 субъединиц: двух α-цепей и двух δ-цепей. На долю НbА2 приходится около 2,5% от всегогемоглобина. Известен, кроме того, фетальный гемоглобин (гемоглобин новорожденных), обозначаемый HbF и состоящий из двух α-цепей и двух γ-цепей. Фетальный гемоглобин отличается от HbA1не только составом аминокислот, но и физико-химическими свойствами: спектральным показателем, электрофоретической подвижностью, устойчивостью к щелочной денатурации и др. Кровь новорожденного содержит до 80% HbF, но к концу 1-го года жизни он почти целиком заменяется на НbА (все же в крови взрослого человека открывается до 1,5% HbF от общего количествагемоглобина). Последовательность аминокислот в γ- и δ-цепях гемогло-бинов окончательно не расшифрована. Установление первичной структуры субъединиц молекулы гемоглобина стимулировало исследования по расшифровке структуры так называемых аномальных гемоглобинов. В крови человека в общей сложности открыто около 150 различных типов мутантных гемоглобинов. Появляются мутантные формы гемоглобинов в крови вследствие мутации генов. Обычно мутации делят на 3 класса в соответствии с топографией измененного участка молекулы. Если замена аминокислоты происходит на поверхности молекулы гемоглобина, то это мутация первого класса; подобныемутации обычно не сопровождаются развитием тяжелой патологии, и болезнь протекает бессимптомно; исключение составляет серповидно-клеточная анемия. При замене аминокислоты вблизи гема нарушается связывание кислорода – это мутация второго класса, сопровождающаяся развитием болезни. И наконец, если замена происходит во внутреннем участке молекулы гемоглобина, говорят о третьем классе мутации; подобныемутации приводят к нарушению пространственной структуры и соответственно функции гемоглобина. Аномальные гемоглобины, различающиеся по форме, химическому составу и величине заряда, были выделены при помощи электрофореза ихроматографии. Передающиеся по наследству изменения чаще всего являются результатом мутации единственного триплета, приводящей к замене одной какой-либо аминокислоты в полипептидных цепях молекулы гемоглобина на другую. В большинстве случаев происходит замена кислойаминокислоты на основную или нейтральную (табл. 2.1). Поскольку это замещение осуществляется в обеих полипептидных цепях одной из пар (α или β), образовавшийся аномальный гемоглобин будет отличаться от нормального величиной заряда и соответственно электрофоретической подвижностью.
В табл. 2.1 представлены некоторые типы аномальных гемоглобинов, составы их полипептидных цепей с указанием известной или вероятной локализации замены либо в α-, либо в β-цепях. Замены необычной аминокислотой в аномальных гемоглобинах имеют место как в α-, так и в β-цепях. Исключение составляет гемоглобин Н, все 4 полипептида которого представлены β-цепями, идентичными по структуре β-цепям нормальногогемоглобина A1. Следует указать, что некоторые мутации, вызывающие существенное изменение структуры и соответственно функции гемоглобина, оказываются летальными, и индивидуумы с подобным гемоглобином умирают в раннем возрасте. Однако при ряде мутаций замена аминокислот не вызывает заметного изменения функции гемоглобина, в этих случаях болезнь протекает бессимптомно. Болезни гемоглобинов (их насчитывают более 200) называют гемогло-бинозами. Принято делить их на гемоглобинопатии, в основе развития которых лежит наследственное изменение структуры какой-либо цепи нормального гемоглобина (часто их относят также к «молекулярным болезням»), и талассемии, обусловленные наследственным нарушением синтеза какой-либо нормальной цепи гемоглобина. Различают также же-лезодефицитные анемии.
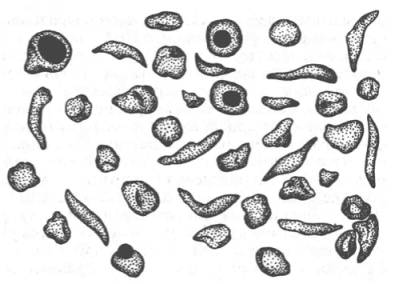
Рис. 2.2. Нормальные и серповидные эритроциты. Классическим примером наследственной гемоглобинопатии является серповидно-клеточная анемия, широко распространенная в странах Южной Америки, Африки и Юго-Восточной Азии. При этой патологии эритроциты в условиях низкого парциального давления кислорода принимают форму серпа (рис. 2.2). Гемоглобин S, как показали Л. Полинг и др., отличается рядом свойств от нормального гемоглобина: в частности, после отдачикислорода в тканях он превращается в плохо растворимую дез-окси-форму и начинает выпадать в осадок в виде веретенообразных кристаллоидов, названных тактоидами. Последние деформируют клетку и приводят к массивному гемолизу. Болезнь протекает остро, и дети, гомозиготные по мутантному гену, часто умирают в раннем возрасте. Химический дефект при серповидно-клеточной анемии был раскрыт В. Ингремом и сводится к замене единственной аминокислоты, а именно глутаминовой, в 6-м положении с N-конца на валин в β-цепях молекулы гемоглобина HbS (см. табл. 2.1, рис. 2.2). Это результат мутации в молекулеДНК, кодирующей синтез β-цепи гемоглобина. Все остальные аминокислоты располагаются в той же последовательности и в таком же количестве, как и в нормальном гемоглобине НbА:
|
|||||||||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 96; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.122.162 (0.086 с.) |


 Образовавшееся соединения, являющееся результатом взаимодействия двух молекул аминокислот, называется дипептидом, а связь – пептидной.
Образовавшееся соединения, являющееся результатом взаимодействия двух молекул аминокислот, называется дипептидом, а связь – пептидной.







 Холопротеин Апопротеин + Простетическая группа
Холопротеин Апопротеин + Простетическая группа