Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема: Організація лабораторії біотехнології рослин.Стр 1 из 6Следующая ⇒
ВСТУП Дисципліна “Біотехнологія рослин та тварин” є важливою в системі підготовки біотехнологів, оскільки на сучасному етапі розвитку науки інтенсивно розвиваються та втілюються у промислове і аграрне виробництво біотехнології, що використовують як об’єкти клітини рослин та тварин. Предметом дисципліни є вивчення біотехнологій, які використовують закономірності клітинної та генетичної інженерії для створення нових сортів рослин та порід тварин, використовуються у виробництві товарної продукції в рослинництві та тваринництві, харчовій, фармацевтичній промисловості та інших галузях. Навчальна дисципліна “Біотехнологія рослин та тварин” базується на знаннях, отриманих студентами при вивченні загальної біології, біології клітини, біохімії, загальної біотехнології, генетики, молекулярної біології та генетичної інженерії. Мета дисципліни – надати майбутнім фахівцям-біотехнологам теоретичні знання та практичні навички із розробки та застосування клітинно-інженерних та генно-інженерних процесів в біотехнології рослин та тварин. В результаті вивчення дисципліни студент повинен знати: – особливості росту та розвитку культур клітин та тканин рослин in vitro; – закономірності калусогенезу та регенерації в культурі клітин та тканин рослин; – механізми зміни плоїдності та утворення сомаклональних варіантів в культурі тканин та клітин; – основи клітинної селекції в суспензійних культурах; – принципи культивування рослинних протопластів та механізми парасексуальної гібридизації; – способи перенесення сторонніх генів до рослинних клітин, регенерації і селекції трансгенних рослин; – технології створення новітніх сортів рослин із застосуванням методів клітинної і генетичної інженерії та ДНК-технологій; – закономірності накопичення вторинних метаболітів в культурі клітин рослин та технології їх промислового отримання; – закономірності культивування тваринних клітин та технологію отримання моноклональних антитіл; – технологію клонування тварин; – технологію трансплантації ембріонів тварин; – технологію отримання химерних та трансгенних тварин; – технології створення нових порід тварин із застосуванням методів клітинної та генетичної інженерії;
– закономірності застосування клітинних технологій у генній терапії; – законодавчі акти та екологічні вимоги до виробництва та застосування результатів розробок у галузі біотехнології рослин та тварин. В результаті вивчення дисципліни студент повинен вміти: – застосовувати основні положення біотехнології рослин та тварин у практичній діяльності; – розробляти склад поживних середовищ, готувати поживні середовища; – отримувати культуру ізольованих клітин та тканин рослин; – отримувати культуру ізольованих клітин та тканин тварин; – застосовувати технології отримання гаплоїдів для прискореного створення гомозиготних ліній у рослин; – здійснювати клональне мікророзмноження та отримання рослинного безвірусного садивного матеріалу; – проводити клітинну селекцію в культурі клітин та тканин рослин; – застосовувати технології клонування тварин та трансплантації ембріонів тварин; – оцінювати рівень генетичної та біологічної безпеки при розробці та застосуванні біотехнологій рослин та тварин у медицині, агропромисловому виробництві тощо.
НАВЧАЛЬНА ПРОГРАМА ДИСЦИПЛІНИ «БІОТЕХНОЛОГІЯ РОСЛИН ТА ТВАРИН» Біотехнологія рослин КЛІТИННА ІНЖЕНЕРІЯ РОСЛИН.Основна мета та проблеми біотехнології рослин. Окремі поняття та термінологія. Завдання біотехнології для рослинництва. Основні етапи розвитку біотехнології рослин.
МЕТОД КУЛЬТУРИ ІЗОЛЬОВАНИХ ТКАНИН, КЛІТИН ТА ОРГАНІВ. Організація лабораторії біотехнології рослин. Перелік обов’язкових приміщень та обладнання для лабораторії біотехнології рослин. Об’єкти культивування. Склад та техніка приготування поживних середовищ. Макросолі, мікросолі. Органічні домішки: вітаміни, амінокислоти та ін. Фітогормони, що використовуються у біотехнології рослин. КАЛУСОГЕНЕЗ ТА РЕГЕНЕРАЦІЯ В КУЛЬТУРІ КЛІТИН ТА ТКАНИН РОСЛИН. Калус, калусна тканина, калусогенез. Типи калусогенезу. Типи калусів. Поняття морфогенезу. Соматичний ембріогенез. Органогенез. Регенерація рослин в культурі клітин та тканин. Пряма та непряма регенерація. Типи регенерації. Сомаклональне варіювання. Застосування сомаклонів в селекційній практиці.
КУЛЬТУРА ГАПЛОЇДНИХ КЛІТИН ТА ТКАНИН. Поняття гаплоїдії. Культура пиляків, пилку та сім’язачатків для отримання гаплоїдів. Отримання гомозиготних ліній на базі гаплоїдів та подвоєних гаплоїдів. Скорочення селекційного процесу за використання гаплоїдів та подвоєних гаплоїдів. Отримання гаплоїдів на базі клітин жіночого гаметофіту. Методи генетичного маркірування при ідентифікації гаплоїдів.
МІКРОКЛОНАЛЬНЕ РОЗМНОЖЕННЯ РОСЛИН ТА ОТРИМАННЯ БЕЗВІРУСНОГО САДИВНОГО МАТЕРІАЛУ. Типи мікроклонального розмноження рослин. Коефіцієнт мікроклонального розмноження. Типи та основні етапи мікроклонального розмноження рослин. Практичне значення методу мікроклонального розмноження. Віруси рослин, які розмножуються вегетативно. Одержання безвірусного садивного матеріалу методами культури in vitro. Ідентифікація вірусів у рослинному матеріалі. ОДЕРЖАННЯ ВТОРИННИХ МЕТАБОЛІТІВ В КУЛЬТУРІ КЛІТИН ТА ТКАНИН РОСЛИН.Класифікація продуктів метаболізму. Культура клітин - продуцентів вторинних сполук. Регуляція синтезу вторинних сполук. Основні процеси культивування клітин як продуцентів. Виробництво рекомбінантних фармацевтичних білків трансгенними рослинами в культурі in vitro. Тканинні та клітинні культури рослин для отримання вторинних метаболітів. Технологія отримання вторинних метаболітів. КЛІТИННА СЕЛЕКЦІЯ ТА ПАРАСЕКСУАЛЬНА ГІБРИДИЗАЦІЯ. Суспензійні культури. Клітинна селекція. Культура протопластів. Регенерація рослин з протопластів. Парасексуальна гібридизація. Типи соматичних гібридів та їх характеристика. Аналіз соматичних гібридів. Практичне застосування соматичної гібридизації. ГЕНЕТИЧНА ІНЖЕНЕРІЯ ТА ДНК-ТЕХНОЛОГІЇ У РОСЛИН. Вектори для перенесення сторонніх генів у клітини рослин. Методи перенесення генно-інженерних конструкцій. Пряме та непряме перенесення. Експресія і успадкування сторонніх генів. Успіхи генетичної інженерії рослин у підвищенні врожайності сільськогосподарських культур та поліпшенні якості врожаю. ДНК-технології, складання ДНК-паспортів сортів рослин. Застовування ДНК-маркерів у селекційному процесі рослин. MAS-селекція.
ГЕНЕТИЧНА ТА БІОБЕЗПЕКА У БІОТЕХНОЛОГІЇ РОСЛИН. Законодавчі акти щодо генетично-модифікованих рослин. Екологічні проблеми біотехнології рослин.
Біотехнологія тварин
КУЛЬТУРА КЛІТИН ТВАРИН.Поживні середовищі для започаткування та підтримання культури клітин тварин на прикладі ссавців. Основні показники культури клітин, що контролюються при культивуванні. Гібридомна технологія отримання моноклональних антитіл. Гібридоми. Антитіла визначеної специфічності. Моноклональні антитіла людини. Обробка В-лімфоцитів людини вірусом Епштейна-Бара. Гібридизація з мієломними клітинами. Застосування моноклональних антитіл у медицині.
Клонування тварин.Клонування ембріонів ссавців. Диссекція ембріонів. Клонування ембріонів методом ізоляції бластомерів. Енуклеація клітин - реципієнтів ядер. Одержання ядер ембріональних клітин. Введення клітинних ядер в цитоплазму. Трансплантація ядер в енуклейовані ооцити. ТЕХНОЛОГІЯ ОТРИМАННЯ ТРАНСГЕННИХ ТВАРИН. Схема отримання трансгенних тварин шляхом мікроін'єкцій. Вибір та клонування генної конструкції. Вилучення яйцеклітин з ембріонів. Мікроін'єкція та пересадка ін'єктованих ембріонів. Докази інтеграції трансгена. Схема трансгенезу тваринних клітин з використанням ембріональних стовбурових клітин. Таргетинг генів. Позитивно-негативна селекція. Використання системи бактеріальних рекомбіназ. Використання трансгенезу тварин у прикладних програмах підвищення продуктивності тварин. Технологія отримання химерних тварин. Проблеми трансгенезу.
ГЕННА ТЕРАПІЯ ТА ЇЇ ВИКОРИСТАННЯ У МЕДИЦИНІ. Трансгенні кластери. Штучні векторні системи. Способи спрямованого введення генних конструкцій. Пряма ін’єкція генетичного матеріалу. Балістична трансфекція. Введення генетичного матеріалу у кровоносні судини, нирки, аерозольне введення генетичного матеріалу у дихальні шляхи. Ембріональні стовбурові клітини. Будова бластоцисти ссавців. Культивування ембріонально-стовбурових клітин. Перспективи використання ембріонально-стовбурових клітин.
ГЕНЕТИЧНА ТА БІОБЕЗПЕКА У БІОТЕХНОЛОГІЇ ТВАРИН. Законодавчі акти щодо використання генетично модифікованих тварин. Етичні проблеми клонування тварин та людини. Етичні проблеми клітинної терапії. БІОТЕХНОЛОГІЯ РОСЛИН Лабораторна робота №1. Порядок виконання роботи
1. Ознайомитися з організацією лабораторії біотехнології на прикладі лабораторії біотехнології Інституту зернового господарства НААН України. 2. Ознайомитися з основними принципами роботи (робота в асептичних умовах, культивування на штучному поживному середовищі, створення необхідних умов культивування) і зразками обладнання. 3. Ознайомитися з правилами техніки безпеки при роботі в лабораторії біотехнології рослин. Результати роботи оформити у вигляді таблиці.
Контрольні питання: 1. Які типи лабораторій біотехнології рослин існують? 2. Які завдання вирішують лабораторії біотехнології рослин? 3. Які умови повинні забезпечувати лабораторії біотехнології рослин? 4. Які відокремлені приміщення повинні існувати в лабораторії біотехнології рослин?
5. Які види робіт виконуються в кожному з приміщень? 6. Яке обладнання повинно знаходитися в кожному з приміщень? 7. Які заходи безпеки обов’язкові в кожному з приміщень? 8. Які приміщення можна об’єднати за нестачею місця, які об’єднувати не можна?
Лабораторна робота № 2. Порядок виконання роботи
1. Приготувати 1л поживного середовища Мурасіге-Скуга з маточних розчинів, розлити його в культуральні посудини, простерилізувати.
Таблиця 2.1 – Склад середовища Мурасіге-Скуга
2. Результати роботи оформити у вигляді таблиці.
Контрольні питання: 1. Охарактеризувати основні групи речовин, які входять до поживних середовищ. 2. Як готувати та зберігати маточні розчини? 3. Наведіть порядок приготування поживного середовища. 4. Як приготувати агаризоване поживне середовище? 5. При якому режимі ведеться автоклавування поживних середовищ? 6. Який обсяг поживного середовища слід наливати в посудину для автоклавування? Лабораторна робота №3. Тема: Стерилізація і посадка експлантатів на штучне поживне середовище. Мета: засвоїти методичні прийоми стерилізації та експлантації рослинних об’єктів на поживне середовище. Матеріали та устаткування: стерильне поживне середовище, ламінар-бокс, стерилізуючий розчин, колбі з стерильною дистильованою водою, хімічний посуд, марля, вата, спирт 960, спиртовки, сірники, чашки Петрі, плівка для чашок Петрі.
Освоєння прийомів стерилізації і посадки експлантатів в умовах ламінар-бокса на штучне поживне середовище проводиться на прикладі посадки сегментів листків тютюну на поживне середовище MS +1мг/л 2,4-дихлорфеноксіоцтової для отримання калусної тканини. Культури калусів можуть бути отримані з багатьох органів рослин (коренів, пагонів, листків) або з певних типів клітин (ендосперм). Вибір експлантату в значеній мірі залежить від поставлених завдань дослідження. Приступати до отримання калусних культур можна після вибору експлантату і підбору поживного середовища. При цьому слід перевірити, чи відібраний експлантат знаходиться у належному біологічному стані та стадії розвитку для отримання калусних культур. Молоді тканини більш придатні для цієї мети, ніж зрілі. Розмір і форма вихідного експлантату також мають певний вплив на проліферацію калусу.
Серед агентів, які використовують для стерилізації, найчастіше застосовують гіпохлорит Ca або Na (профільтрований насичений розчин). До стерилізуючого розчину необхідно додати декілька крапель препарату Tween-80 або іншого детергенту для покращення змочуваності та рівномірного розподілення розчину на поверхні тканини. Після стерилізації матеріал необхідно ретельно промити 5 разів стерильною дистильованою водою і приступити до експлантації його на штучне поживне середовище.
Порядок виконання роботи
1. Підготувати необхідний стерильний посуд, стерильне поживне середовище, стерилізуючий розчин хлорного вапна, стерильну дистильовану воду, необхідні інструменти. 2. Стерильне поживне середовище розігріти до рідкого стану. Всі подальші операції виконувати в стерильних умовах ламінар-боксу! 3. Стерильно розлити поживне середовище в чашки Петрі. 4. Листки опустити в стерилізуючий розчин на 7 хвилин, потім стерильно перенести в посудину зі стерильною дистильованою водою, промити 5 разів, змінюючи стерильну воду. 5. Пінцет і скальпель змочити у спирті і прокалити у полум’ї. 6. Стерильно розрізати листок на сегменти і помістити їх на поверхню поживного середовища. 7. Запечатати чашки Петрі плівкою, підписати. 8. Перенести чашки Петрі в культуральну кімнату із заданим режимом культивування. 9. Результати роботи оформити у вигляді таблиці.
Контрольні питання: 1. Які експлантати краще використовувати для отримання калусної тканини? 2. Які режими стерилізації експлантатів використовують в біотехнології рослин? 3. З якою метою експлантати після стерилізації промивають стерильною дистильованою водою? 4. З якою метою до стерилізуючого розчину додають Tween-80?
Лабораторна робота №4. Порядок виконання роботи Ознайомитися з результатами культивування наступних типів рослинних об’єктів. 1. Калуси, отримані в культурі пиляків кукурудзи. Підтримуються близько 8-місяців на середовищі MS, яке вміщує 1 мг/л 2,4- дихлорфеноксіоцтової кислоти (2,4-Д). Калуси мають різну морфологічну структуру, колір, структуру поверхні. 2. Калуси, отримані в культурі незрілих зародків кукурудзи, підтримуються більше року на середовищі MS, яке вміщує 2,4-Д, пролін, AgNO3. Калуси безкольорові, м’які, здатні до регенерації. 3. Рослини-регенерати в культурі калусної тканини кукурудзи. Утворення зелених проростків і коренів спостерігається при трансплантації калуса на безгормональне середовище. 4. Клітинні культури кукурудзи. 5. Процес мікроклонального розмноження можна спостерігати на прикладі: а) культивування сегментів листка фіалки на середовищі MS з 0,1 мг/л нафтилоцтової кислоти (НОК), 0,5 мг/л 6-бензиламінопурину (6-БАП) для отримання меристематичних і калусних зон поблизу поверхні поранення і мікророзеток на їх основі; б) культивування мікророзеток на середовищі MS з 0,2 мг/л НОК, 0,1 мг/л 6-БАП і 0,1 мг/л ГК3 для росту мікро розеток; в) культивування мікро розеток на без гормональному середовищі MS для утворення кореневої системи. Коефіцієнт розмноження Saunpaulia sp. В культурі in vitro складає 1:400 – 1:600. 6. Результати роботи оформити у вигляді таблиці.
Контрольні питання: 1. Які типи калусної тканини існують? 2. Як утворюються рослини-регенеранти в культурі калусної тканини? 3. Як відбувається ініціація та підтримання клітинних культур рослин? 4. Охарактеризуйте етапи мікроклонального розмноження рослин.
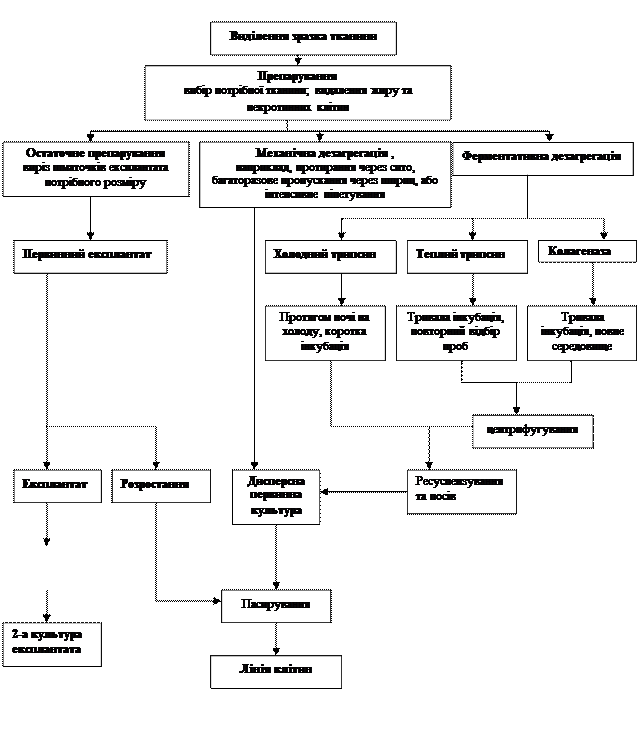
БІОТЕХНОЛОГІЯ ТВАРИН Лабораторна робота № 5 Порядок виконання роботи Визначити особливості тканинного клонування рослинних та тваринних клітин, та записати у вигляді таблиці. Культура клітин (клітинна культура). Культура вже роз'єднаних клітин. В залежності від співвідношення з підтримуючим субстратом розрізнюють два види культур клітин: одношарові та суспензійні. Типи тканин та клітин. Список типів клітин, що можна культивувати дуже великий. Це елементи сполучної тканини (фібробласти), кістки і хрящі, сердечні і гладкі м'язи, епітеліальні тканини, клітини нервової системи, ендокринні клітини. Для того, щоб клітини проліферували (проліферація – це розростання клітини шляхом розмноження), вони повинні походити скоріше від недиференційованих клітин-попередників, ніж від повністю диференційованих клітин, у яких є здібність до проліферації у нормі втрачається. Однак, популяція не обов’язково повинна бути гомогенною й володіти фіксованим фенотипом. Деякі культури, наприклад кератиноцити епідермісу, містять стволові клітини, клітини-попередники та кератинизовані лускаті клітини. В такій культурі відбуваються постійні оновлення за рахунок стволових клітин, проліферація та дозрівання клітин-попередників й термінальне необоротне диференціювання, яке супроводжується «злущуванням» лускатих клітин у культуральне середовище. Культури інших клітин, наприклад, фібробластів, являють собою відносно однорідну популяцію проліферуючих клітин при низькій щільності монослою та однорідну популяцію більш диференційованих клітин при високій щільності монослою. Ця популяція фіброцит-подібних клітин при високій щільності монослою здатна до повернення в клітинний цикл у результаті трипсинізації, яка знижує щільність клітин у монослої, що призводить до появи вільного «краю» монослою. Диференційовка та проліферація клітин регулюється не тільки щільністю монослою, а й поживними факторами середовища (сироватка, йони Са 2+, гормонами, взаємодією з позаклітинним матриксом. Культури, які отримані з ембріональних тканин, характеризуються кращою виживаністю та більш активним ростом у порівнянні з культурами з відповідних дорослих тканин. Це відображає більш низький рівень спеціалізації та наявність клітин-попередників, які реплікуються, або стволових клітин у ембріонах. Дорослі тканини володіють, як правило, зниженим проліферативним пулом і вищим вмістом спеціалізованих клітин, що не діляться, які часто асоціюються з більш структурованим та слабо дезагрегуючим позаклітинним матриксом. Клітини мезодермального походження (фібробласти, ендотелій, міобласти) легше культивувати, ніж епітеліальні клітини, нейрони та клітини ендокринних тканин. Завдяки використанню цих культур було показано, що сироватка здатна пригнічувати ріст культури та сприяти диференціюванню клітин. Нормальні тканини, як правило, дають початок культурам з обмеженим часом життя, тоді як культури клітин, отримані з пухлин, здатні проліферувати необмежено довгий час. Відомо декілька ліній необмежено проліферуючих клітин, які не щепляться при введенні тваринам, тобто не є пухлеродними. Нормальні клітини ростуть звичайно як недиференційовані стволові клітини або клітини-попередники, та настання диференціювання у такій культурі супроводжується часто припиненням проліферації клітин. Деякі нормальні клітини, наприклад, фіброцити та клітини ендотелію, здатні диференціюватися, потім дедиференціюватися, відновлювати проліферацію та знов диференціюватися. Інші – наприклад, ороговілий епітелій і багато кровотворних клітин – після ініціації диференційовки нездатні до відновлення проліферації. У культурах клітин, отриманих з пухлин можлива часткова диференційовка при збереженні здатності до проліферації. Головним фактором при виборі тканини чи лінії клітин для подальшого дослідження являється природа процесу, який вивчатиметься на цих клітинах. Вивчення таких загальних клітинних процесів, як синтез ДНК, проникність мембран або визначення цитотоксичності може бути проведене на будь-яких типах клітин. Дослідження спеціалізованих клітинних функцій, таких як утворення міотрубок, синтез антитіл або регуляція ферментів циклу сечовини, вимагає використання особливих типів клітин, в яких відбувається експресія цих функцій. Після посіву клітин у флакон вони входять до лаг-періоду тривалістю 2 – 24 год., який змінюється періодом експоненціального зросту. У кінці цього періоду клітини досягають щільного монослою й входять у період повільного зросту або покою. Ці фази характерні для усіх кліткових ліній та дозволяють отримати відтворні характеристики кліткових ліній: тривалість лаг-періоду, час подвоєння популяції в середині експоненціальної фази та щільність клітин у монослою у період покою. Відтворність цих характеристик можлива тільки при постійних умовах культивування. Поведінка клітин та їх біохімічні властивості помітно відрізняються на різних фазах зросту культури, тому важливо контролювати стадію циклу зросту, на якій у культури додаються різні препарати або реагенти чи відбувається збір клітин для пересіву. Форма кривої росту дозволяє також отримати інформацію про репродуктивний потенціал культури. Деякі клітини, що швидко діляться, наприклад постійні лінії клітин, потребують зміни середовища після 3 – 4 діб культивування. На необхідність зміни середовища показує значення рН нижче 7,0.
Схема 1. Варіанти первинної культури. Різні шляхи отримання лінії клітин; в центрі та зліва – шляхом механічної дезагрегації, праворуч – шляхом ферментативної дезагрегації. Експлантати можна переносити, щоб стимулювати подальший ріст клітин експлантата, в той час як, клітини, що вийшли з експлантата, можна субкультивувати для отримання лінії клітин. Контрольні питання 1. Які типи клітин можна культивувати? 2. Які повинні бути клітини-попередники? 3. Яке значення сироватки? 4. Який головний фактор при виборі тканин? 5. Які тканини володіють зниженою проліферацією?
Лабораторна робота № 6 Порядок виконання роботи Вказати особливості складання поживних середовищ для культивування рослинних та тваринних клітин. Після витягання клітин з тканини чи організму та переміщення їх у культуру культуральне середовище повинне забезпечувати усі зовнішні умови, які клітини мали in vivo. Тільки у цьому випадку можливі виживання клітин, їх проліферація та диференційовка. Позаклітинне середовище повинно володіти всіма необхідними для виживання й росту властивостями, тобто забезпечувати клітини поживними та гормональними факторами. Серед біологічних середовищ, які виявилися придатними для культивування клітин поза організму, найбільше розповсюдження отримала сироватка. Хоча вже частково виявлені потреби клітин, для задоволення яких складають складні хімічно визначені середовища, додавання 5 – 20 % сироватки було і залишається необхідним для підтримки оптимального росту клітин. Часто по різним причинам буває необхідно позбавитися від неідентифікованих компонентів сироватки, тобто отримати хімічно відоме середовище. Фактори росту. Більшість ростових факторів присутні в сироватці у концентрації кількох нанограмів на мілілітр та нижче. Деякі з цих факторів специфічні для клітин на певній стадії диференціювання, як, наприклад, гематопоетичний фактор росту(колонієстимулюючий фактор). Деякі фактори діють синергетично, а дія ряду факторів не обмежена яким-небудь одним типом клітин. Один і той же тип клітин може бути стимульований різними ростовими факторами. До теперішнього часу фізіологічна роль усіх цих багато чисельних факторів не з’ясована. Гормони. Серед гормонів найбільш важливим для забезпечення росту майже всіх типів клітин у культурі виявляється інсулін. Цей гормон звичайно додають в культуру у відносно високій концентрації, оскільки він швидко розпадається, а також інактивується цистеїном. Глюкокортикоїди (гідрокортизон, дексаметазон) можуть стимулювати або пригнічувати ріст клітин у культурі в залежності від типу клітин та їх щільності. Глюкокортикоїди впливають на проліферацію клітин, змінюючи їх чутливість до факторів росту. Деякі лінії клітин потребують інших стероїдних гормонів (естрадіол, тестостерон, прогестерон). Гормони щитовидної залози (головним чином триіодтиронін) виявляються активними у підтримці росту деяких кліткових ліній. Фактори прикріплення й розпластання. Однією з головних функцій сироватки є забезпечення клітин факторами прикріплення та розпластання, незамінними компонентами позаклітинного матриксу. Більшість клітин ссавців, перед тим як почати проліферацію та утворювати клітинний монослой, повинні прикріпитися до субстрату та розпластатися в ньому. Ліпіди. Сироватка є багатим джерелом різних ліпідів, необхідних клітинам, що культивуються, для виживання й росту. Лінії клітин розрізняються за необхідністю у незамінних жирних кислотах, фосфоліпідах, лецитині та холестерині. Так, наприклад, оптимальний баланс жирних кислот та холестерину варіює в значних межах для різних ліній кровотворних клітин й для однієї і тієї ж лінії на різних стадіях дозрівання. Мінеральні речовини. Роль присутніх у сироватці неорганічних мікроелементів (Cu, Zn, Co, Mn, Mo, Va, Se) з’ясована не повністю, але багато з них можуть бути факторами ферментів. Так, наприклад, йони SeO32- потрібні для активації ряду ферментів метаболічної детоксикації. Йони селена можуть брати участь у інактивації вільних радикалів. Сироватка являє собою надзвичайно складну суміш багатьох дрібних та крупних молекул, здатних як викликати, так і гальмувати ріст клітин. Деякі компоненти сироватки, які здатні підтримувати виживання і ріст багатьох клітин ссавців у культурі, перераховані у таблиці. До головних функцій сироватки відносять: 1. забезпечення гормональними факторами, які стимулюють ріст клітин та їх функції; 2. забезпечення факторами прикріплення й розпластання клітин (створення біоматриксу); 3. забезпечення транспортними білками, які переносять гормони, мінеральні речовини, ліпіди та ін.
Таблиця 6.1 – Головні компоненти сироватки, необхідні для виживання й росту клітин.
Можливі переваги використання безсироваткових середовищ та середовищ з низьким вмістом сироватки. Використання таких середовищ обумовлює наступні переваги: 1. поліпшення відтворюваності результатів дослідів на страхованих культурах внаслідок більшої стабільності складу середовища (властивості сироватки можуть змінюватися від партії до партії); 2. зниження ризику зараження культури вірусами, грибами, мікоплазмою; 3. зниження вартості(особливо у разі ембріональної сироватки великої рогатої худоби); 4. полегшення очищення продуктів клітинного метаболізму; 5. зниження впливу додаткових білків на результати біологічних досліджень; 6. відсутність цитотоксичності сироватки; 7. відвертання багатошарового зростання фібробластів в первинній культурі; 8. селективне культивування диференційованих і функціонально таких, що розрізняються типів клітин з гетерогенної популяції первинної культури без переважної стимуляції окремих субпопуляцій.
Безсироваткове середовище Існують дві головні причини використання безсироваткових середовищ при роботі з великою кількістю клітин: 1. необхідність уникнути присутності стороннього білку, від якого інакше доведеться очищати отримуваний продукт; 2. висока вартість ембріональної сироватки великої рогатої худоби. Нині дослідження по заміщенню сироватки в культурах клітин розвиваються по трьох різних напрямах: 1. Аналітичний підхід. Виділення і ідентифікація сироваткових факторів, що необхідні для виживання і зростання клітин. Це надзвичайно трудомістке і часто безперспективне завдання, оскільки більшість гормональних факторів діють синергічно і є присутнім у сироватці в мінімальних кількостях. 2. Синтетичний підхід Сато разом з співробітниками. Додавання в основне поживне середовище різних комбінацій ростових факторів, які виконують функцію сироватки: специфічних та неспецифічних для клітин гормонів (включно з мітагенами), транспортних білків та факторів прикріплення й розпластання. 3. Метод, який запропонований Хемом разом з співробітниками. Метод заснований на поступовому зниженні концентрації сироватки до зупинки клітинної проліферації. Потім концентрація кожного компонента поживного середовища(вітамінів, амінокислот, гормонів та ін.) підбирається так, щоб розмноження клітин поновилося. Загальні правила та застереження: 1) Повинна бути впевненість у тому, що у процесі приготування середовища та у процесі роботи з ним, не виникне втрати або інактивації незамінних поживних речовин та ростових факторів: а) йони Fe2+ можуть окислюватися до Fe3+, преципітируювати та втрачатися при стерилізації фільтруванням. Тому додавати Fe2+ потрібно безпосередньо перед стерилізацією середовища. б) змішування концентрованих розчинів з Са2+ й РО43- може призвести до утворення осаду Са3(РО4)2. в) високі концентрації цистеїну можуть ін активувати інсулін, так що концентрація цистеїну повинна бути знижена до 10 мкМ. При неможливості слід додати інший відновлюваючий агент (наприклад, дитіотреітол або тіогліцерин). г) мікро емульсії й ліпосоми завжди слід готувати перед вживанням. Ненасичені жирні кислоти можуть окислюватися; мікроемульсії і ліпосоми можуть частково втрачатися при стерилізації середовища фільтруванням. Необхідно перевіряти цитотоксичніть стабілізаторів ліпосом.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 313; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.143.168.172 (0.111 с.) |