
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 1. 2. Основы функционирования белков. Лекарства как лиганды, влияющие на функцию белковСодержание книги
Поиск на нашем сайте 1. Активный центр белка и его взаимодействие с лигандом. В процессе формирования третичной структуры на поверхности функционально активного белка, обычно в углублении, образуется участок, сформированный радикалами аминокислот, далеко стоящими друг от друга в первичной структуре. Этот участок, имеющий уникальное строение для данного белка и способный специфично взаимодействовать с определенной молекулой или группой похожих молекул, называется центром связывания белка с лигандом или активным центром. Лигандами называются молекулы, взаимодействующие с белками. Высокая специфичность взаимодействия белка с лигандом обеспечивается комплементарностью структуры активного центра структуре лиганда. Комплементарность - это пространственное и химическое соответствие взаимодействующих поверхностей. Активный центр должен не только пространственно соответствовать входящему в него лиганду, но и между функциональными группами радикалов, входящих в активный центр, и лигандом должны образоваться связи (ионные, водородные, а также гидрофобные взаимодействия), которые удерживают лиганд в активном центре (рис. 1.13).
Некоторые лиганды, присоединяясь к активному центру белка, выполняют вспомогательную роль в функционировании белков. Такие лиганды называются кофакторами, а белки, имеющие в своем составе небелковую часть, - сложными белками (в отличие от простых белков, состоящих только из белковой части). Небелковая часть, прочно соединенная с белком, носит название простетической группы. Например, в составе миоглобина, гемоглобина и цитохромов содержится прочно прикрепленная к активному центру простетическая группа - гем, содержащий ион железа. Сложные белки, содержащие гем, называются гемопротеинами. При присоединении к белкам специфических лигандов проявляется функция этих белков. Так, альбумин - важнейший белок плазмы крови - проявляет свою транспортную функцию, присоединяя к активному центру гидрофобные лиганды, такие как жирные кислоты, билирубин, некоторые лекарства и др. (рис. 1.14) Лигандами, взаимодействующими с трехмерной структурой пептидной цепи, могут быть не только низкомолекулярные органические и неорганические молекулы, но и макромолекулы: • ДНК (рассмотренные выше примеры с ДНК-связывающими белками); • РНК; • полисахариды; • белки.
Уникальная первичная структура белков человека, закодированная в молекуле ДНК, в клетках реализуется в виде уникальной конформации, структуры активного центра и функций белков В этих случаях белок узнает определенный участок лиганда, соразмерный и комплементарный центру связывания. Так на поверхности гепатоцитов имеются белки-рецепторы к гормону инсулину, имеющему также белковое строение. Взаимодействие инсулина с рецептором вызывает изменение его конформации и активации сигнальных систем, приводящих к запасанию в гепатоцитах питательных веществ после еды. Таким образом, в основе функционирования белков лежит специфическое взаимодействие активного центра белка с лигандом. 2. Доменная структура и ее роль в функционировании белков. Длинные полипептидные цепи глобулярных белков часто складываются в несколько компактных, относительно независимых областей. Они имеют самостоятельную третичную структуру, напоминающую таковую у глобулярных белков, и называются доменами. Благодаря доменной структуре белков легче формируется их третичная структура. В доменных белках центры связывания с лигандом часто располагаются между доменами. Так, трипсин - протеолитический фермент, который вырабатывается экзокринной частью поджелудочной железы и необходим для переваривания белков пищи. Он имеет двухдоменное строение, а центр связывания трипсина с его лигандом - пищевым белком - располагается в бороздке между двумя доменами. В активном центре создаются условия, необходимые для эффективного связывания специфического участка пищевого белка и гидролиза его пептидных связей. Разные домены в белке при взаимодействии активного центра с лигандом могут перемещаться друг относительно друга (рис. 1.15). Гексокиназа - фермент, катализирующий фосфорилирование глюкозы с помощью АТФ. Активный центр фермента располагается в расщелине между двумя доменами. При связывании гексокиназы с глюкозой окружающие ее домены смыкаются и субстрат оказывается в «ловушке», где и происходит фосфорилирование (см. рис. 1.15).
В некоторых белках домены выполняют самостоятельные функции, связываясь с различными лигандами. Такие белки называются многофункциональными. 3. Лекарства - лиганды, влияющие на функцию белков. Взаимодействие белков с лигандами специфично. Однако благодаря конформационной лабильности белка и его активного центра можно подобрать другое вещество, которое также могло бы взаимодействовать с белком в активном центре или ином участке молекулы. Вещество, по структуре похожее на природный лиганд, называют структурным аналогом лиганда или неприродным лигандом. Оно также взаимодействует с белком в активном центре. Структурный аналог лиганда может как усиливать функцию белка (агонист), так и снижать ее (антагонист). Лиганд и его структурные аналоги конкурируют друг с другом за связывание с белком в одном центре. Такие вещества называются конкурентными модуляторами (регуляторами) белковых функций. Многие лекарственные препараты действуют как ингибиторы белков. Некоторые из них получают химической модификацией природных лигандов. Ингибиторы белковых функций могут быть лекарствами и ядами. Атропин - конкурентный ингибитор М-холинорецепторов. Ацетилхолин - нейромедиатор передачи нервного импульса через холинэргические синапсы. Для проведения возбуждения выделившийся в синаптическую щель ацетилхолин должен взаимодействовать с белком - рецептором постсинаптической мембраны. Обнаружены два типа холинорецепторов: • М-рецептор, кроме ацетилхолина избирательно взаимодействующий с мускарином (токсином мухомора). М - холинорецепторы имеются на гладких мышцах и при взаимодействии с ацетилхолином вызывают их сокращение; • Н-рецептор, специфично связывающийся с никотином. Н-холинорецепторы обнаружены в синапсах поперечнополосатых скелетных мышц. Специфическим ингибитором М-холинорецепторов является атропин. Он содержится в растениях красавке и белене.
|
||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 4099; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.220 (0.008 с.) |

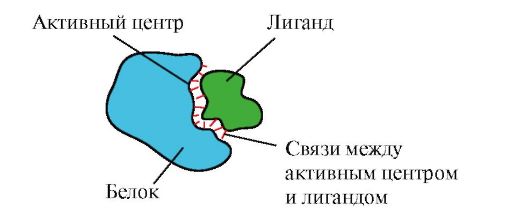 Рис. 1.13. Комплементарное взаимодействие белка с лигандом
Рис. 1.13. Комплементарное взаимодействие белка с лигандом Рис. 1.14. Взаимосвязь генотипа и фенотипа
Рис. 1.14. Взаимосвязь генотипа и фенотипа Рис. 1.15. Связывание доменов гексокиназы с глюкозой
Рис. 1.15. Связывание доменов гексокиназы с глюкозой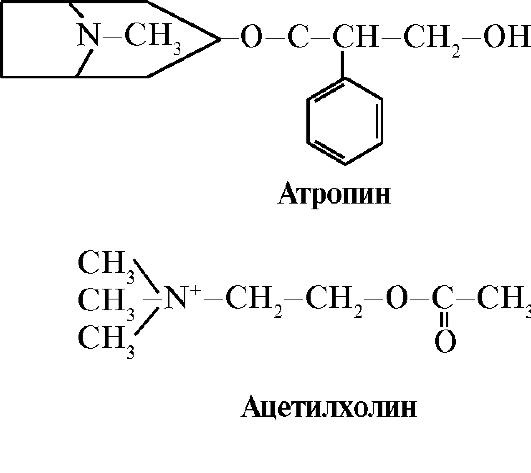 Атропин имеет в структуре схожие с ацетилхолином функциональные группы и их пространственное расположение, поэтому относится к конкурентным ингибиторам М-холинорецепторов. Учитывая, что связывание ацетилхолина с М-холинорецепторами вызывает сокращение гладких мышц, атропин используют как лекарство, снимающее их спазм (спазмолитик). Так, известно применение атропина для расслабления глазных мышц при просмотре глазного дна, а также для снятия спазмов при желудочнокишечных коликах. М-холинорецепторы имеются и в центральной нервной системе (ЦНС), поэтому большие дозы атропина могут вызвать нежелательную реакцию со стороны ЦНС: двигательное и психическое возбуждение, галлюцинации, судороги.
Атропин имеет в структуре схожие с ацетилхолином функциональные группы и их пространственное расположение, поэтому относится к конкурентным ингибиторам М-холинорецепторов. Учитывая, что связывание ацетилхолина с М-холинорецепторами вызывает сокращение гладких мышц, атропин используют как лекарство, снимающее их спазм (спазмолитик). Так, известно применение атропина для расслабления глазных мышц при просмотре глазного дна, а также для снятия спазмов при желудочнокишечных коликах. М-холинорецепторы имеются и в центральной нервной системе (ЦНС), поэтому большие дозы атропина могут вызвать нежелательную реакцию со стороны ЦНС: двигательное и психическое возбуждение, галлюцинации, судороги.


