Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Объясните причины и механизм возникших осложнений.Стр 1 из 11Следующая ⇒
Итак, гликолиз – не только главный путь утилизации глюкозы в клетках, но и уникальный путь, поскольку он может использовать кислород, если Последний доступен (аэробные условия), но может протекать и в отсутствие кислорода (анаэробные условия). Анаэробный гликолиз – сложный ферментативный процесс распада глюкозы, протекающий в тканях человека и животных без потребления кислорода. Конечным продуктом гликолиза является молочная кислота. В процессе гликолиза образуется АТФ. Суммарное уравнение гликолиза можно представить следующим образом:
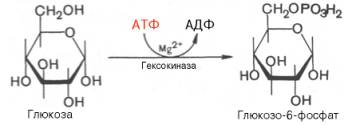
В анаэробных условиях гликолиз – единственный процесс в животном организме, поставляющий энергию. Именно благодаря гликолизу организм человека и животных определенный период может осуществлять ряд физиологических функций в условиях недостаточности кислорода. В тех случаях, когда гликолиз протекает в присутствии кислорода, говорят об аэробном гликолизе. Последовательность реакций анаэробного гликолиза, так же как и их промежуточные продукты, хорошо изучена. Процесс гликолиза катализируется одиннадцатью ферментами, большинство из которых выделено в гомогенном, клисталлическом или высокоочищенном виде и свойства которых достаточно известны. Заметим, что гликолиз протекает в гиало-плазме (цитозоле) клетки. Первой ферментативной реакцией гликолиза является фосфорилирование, т.е. перенос остатка ортофосфатана глюкозу за счет АТФ. Реакция катализируется ферментом гексокиназой:
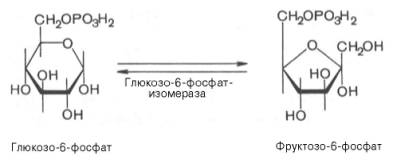
Образование глюкозо-6-фосфата в гексокиназной реакции сопровождается освобождением значительного количества свободной энергии системы и может считаться практически необратимым процессом. Наиболее важным свойством гексокиназы является ее ингибирование глюкозо-6-фосфатом, т.е. последний служит одновременно и продуктом реакции, и аллостерическим ингибитором. Фермент гексокиназа способен катализировать фосфорилирование не только D-глюкозы, но и других гексоз, в частности D-фруктозы, D-маннозы и т.д. В печени, кроме гексокиназы, существует фермент глюкокиназа, который катализирует фосфорилирование только D-глюкозы. В мышечной ткани этот фермент отсутствует (подробнее см. главу 16). Второй реакцией гликолиза является превращение глюкозо-6-фос-фата под действием фермента глюкозо-6-фосфатизомеразы во фруктозо-6-фосфат:
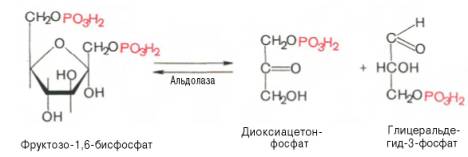
Данная реакция аналогично гексокиназной практически необратима, протекает в присутствии ионов магния и является наиболее медленно текущей реакцией гликолиза. Фактически эта реакция определяет скоростьгликолиза в целом. Фосфофруктокиназа относится к числу аллостерических ферментов. Она ингибируется АТФ и стимулируетсяАМФ. При значительных величинах отношения АТФ/АМФ активность фосфофруктокиназы угнетается игликолиз замедляется. Напротив, при снижении этого коэффициента интенсивность гликолиза повышается. Так, в неработающей мышце активность фосфофруктокиназы низкая, а концентрация АТФ относительно высокая. Во время работы мышцы происходит интенсивное потребление АТФ и активностьфосфофруктокиназы повышается, что приводит к усилению процесса гликолиза. Четвертую реакцию гликолиза катализирует фермент альдолаза. Под влиянием этого фермента фруктозо-1,6-бисфосфат расщепляется на две фосфотриозы:
Эта реакция обратима. В зависимости от температуры равновесие устанавливается на различном уровне. При повышении температуры реакция сдвигается в сторону большего образования триозофосфатов (дигидро-ксиацетонфосфата и глицеральдегид-3-фосфата). Пятая реакция – это реакция изомеризации триозофосфатов. Катализируется ферментомтриозофосфатизомеразой:
Равновесие данной изомеразной реакции сдвинуто в сторону дигид-роксиацетонфосфата: 95% дигидроксиацетонфосфата и около 5% глице-ральдегид-3-фосфата. В последующие реакции гликолиза может непосредственно включаться только один из двух образующихся триозофосфатов, а именно глицеральдегид-3-фосфат. Вследствие этого по мере потребления в ходе дальнейших превращений альдегидной формы фосфотриозы ди-гидроксиацетонфосфат превращается в глицеральдегид-3-фосфат. Образованием глицеральдегид-3-фосфата как бы завершается первая стадия гликолиза. Вторая стадия – наиболее сложная и важная. Она включает окислительно-восстановительную реакцию (реакциягликолитической оксидоредукции), сопряженную с субстратным фосфорилированием, в процессе которого образуется АТФ.
В результате шестой реакции глицеральдегид-3-фосфат в присутствии ферментаглицеральдегидфосфатдегидрогеназы, кофермента НАД и неорганического фосфата подвергается своеобразному окислению с образованием 1,3-бисфосфоглицериновой кислоты и восстановленной формы НАД (НАДН). Эта реакция блокируется йод- или бромацетатом, протекает в несколько этапов:
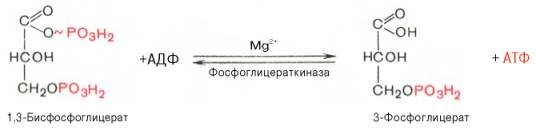
1,3-Бисфосфоглицерат представляет собой высокоэнергетическое соединение (макроэргическая связь условно обозначена знаком «тильда» ~). Механизм действия глицеральдегидфосфатдегидрогеназы сводится к следующему: в присутствии неорганического фосфата НАД+ выступает как акцептор водорода, отщепляющегося от глицеральдегид-3-фосфата. В процессе образования НАДН глицеральдегид-3-фосфат связывается с молекулой фермента за счет SH-групп последнего. Образовавшаяся связь богата энергией, но она непрочная и расщепляется под влиянием неорганического фосфата, при этом образуется 1,3-бисфосфоглицериновая кислота. Седьмая реакция катализируется фосфоглицераткиназой, при этом происходит передача богатого энергией фосфатного остатка (фосфатной группы в положении 1) на АДФ с образованием АТФ и 3-фосфогли-цериновой кислоты (3-фосфоглицерат):
Таким образом, благодаря действию двух ферментов (глицеральде-гидфосфатдегидрогеназы ифосфоглицераткиназы) энергия, высвобождающаяся при окислении альдегидной группы глицеральдегид-3-фосфата до карбоксильной группы, запасается в форме энергии АТФ. В отличие от окислительного фосфорилирования образование АТФ из высокоэнергетических соединений называется субстратнымфосфорилированием. Гексокиназа; 2 - фосфоглюкоизоме-раза; 3 - фосфофруктокиназа; 4 - альдо-лаза; 5 - триозофосфатизомераза; 6 - гли-церальдегидфосфатдегидрогеназа; 7 -фосфоглицераткиназа; 8 - фосфоглицеромутаза; 9 - енолаза; 10 - пируватки-наза; 11 - лактатдегидрогеназа. Реакция восстановления пирувата завершает внутренний окислительно-восстановительный цикл гликолиза. НАД+ при этом играет роль промежуточного переносчика водорода от глицеральдегид-3-фосфата (6-яреакция) на пировиноградную кислоту (11-я реакция), при этом сам он регенерируется и вновь может участвовать в циклическом процессе, получившем название гликолитический оксидоредукции. Биологическое значение процесса гликолиза заключается прежде всего в образовании богатых энергией фосфорных соединений. На первых стадиях гликолиза затрачиваются 2 молекулы АТФ (гексокиназная и фосфофрук-токиназная реакции). На последующих образуются 4 молекулы АТФ (фосфоглицераткиназная и пируваткиназная реакции). Таким образом, энергетическая эффективность гликолиза в анаэробных условиях составляет 2 молекулы АТФ на одну молекулу глюкозы. Как отмечалось, основной реакцией, лимитирующей скорость гликолиза, является фосфофруктокиназная. Вторая реакция, лимитирующая скорость и регулирующая гликолиз – гексокиназная реакция. Кроме того, контроль гликолиза осуществляется также ЛДГ и ее изоферментами. В тканях с аэробным метаболизмом (ткани сердца, почек и др.) преобладают изоферменты ЛДГ1 и ЛДГ2 (см. главу 4). Эти изоферменты инги-бируются даже небольшими концентрациями пирувата, что препятствует образованию молочной кислоты и способствует более полному окислению пирувата (точнее, ацетил-КоА) вцикле трикарбоновых кислот.
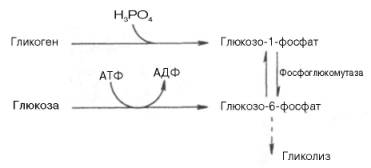
В тканях человека, в значительной степени использующих энергию гликолиза (например, скелетные мышцы), главными изоферментами являются ЛДГ5 и ЛДГ4. Активность ЛДГ5 максимальна при тех концентрацияхпирувата, которые ингибируют ЛДГ1. Преобладание изоферментов ЛДГ4 и ЛДГ5 обусловливает интенсивный анаэробный гликолиз с быстрым превращением пирувата в молочную кислоту. Как отмечалось, процесс анаэробного распада гликогена получил название гликогенолиза. Вовлечение D-глюкозных единиц гликогена в процесс гликолиза происходит при участии 2 ферментов – фосфорилазы а и фосфо-глюкомутазы. Образовавшийся в результате фосфоглюкомутазной реакции глюкозо-6-фосфат может включаться в процесс гликолиза. После образования глюкозо-6-фосфата дальнейшие пути гликолиза игликогенолиза полностью совпадают:
В процессе гликогенолиза в виде макроэргических соединений накапливаются не две, а три молекулы АТФ(АТФ не тратится на образование глюкозо-6-фосфата). Кажется, что энергетическая эффективность глико-генолиза выглядит несколько более высокой по сравнению с процессом гликолиза, но эта эффективность реализуется только при наличии активной фосфорилазы а. Следует иметь в виду, что в процессе активации фосфо-рилазы b расходуется АТФ (см. рис. 10.2). ОБРАЩЕНИЕ ГЛИКОЛИЗА В условиях интенсивной мышечной работы бывают ситуации, когда в клетку не успевает поступать кислород. При этом распад углеводов временно протекает в анаэробных условиях. Молекулам НАДН2некуда отдавать свой водород, так как не работают дыхательные цепи в митохондриях и челночные механизмы. Это не мешает протеканию первых пяти реакций гликолиза. Но НАД - это кофермент, запасы которого в цитоплазме невелики. После того, как весь этот НАД превратится в НАДН2в 6-й реакции, новые молекулы ФГА не могут окисляться до фосфоглицериновой кислоты, и тогда все последующие реакции гликолиза должны прекратиться. Но этого не происходит. В цитоплазме хорошим акцептором водорода является ПВК - конечный продукт 1-го этапа. Возникает сопряжение между двумя реакциями, которое называется гликолитическая оксидоредукция:
Реакции гликолитической оксидоредукции полностью обратимы. В отсутствие кислорода сколько НАДН2образуется на 6-й стадии, столько же НАДН2и отдаст свой водород на ПВК.
Поэтому в анаэробных условиях конечным продуктом распада глюкозы является лактат. Таким образом, гликолитическая оксидоредукция - это сопряжение между 6-й стадией (окисление ФГА) и 11-й стадией (восстановление ПВК до лактата) гликолиза [2]. В состоянии покоя, наступающего после интенсивной мыщечной работы, в клетку начинает поступать кислород. Это приводит к запуску митохондриальных дыхательных цепей. Запускаются окислительное декарбоксилирование пирувата, ЦТК и челночный механизм переноса водорода в митохондрии, а, значит, и распада глюкозы (гликогена). При этом процесс гликолиза тормозится автоматически. Торможение гликолиза поступившим в клетку кислородом называется эффектом Пастера по имени ученого, открывшего это явление. В раковых клетках такого эффекта не наблюдается. В них одновременно могут протекать сразу два процесса: и аэробный, и анаэробный гликолиз. Отсутствие эффекта Пастера в тканях, пораженных злокачественными опухолями, называется эффект Кребтри [7] Пируваткарбоксилаза Первая реакция на пути синтеза фосфоенолпирувата из пирувата. Первоначально пируват под влияние пируваткарбоксилазы и при участии СО2и АТФ карбоксилируется с образованием оксалоацетата [1]. Механизмы регуляции: · Ацетил-СоА При биосинтезе в ходе глюконеогенеза оксалоацетата из бикарбоната и пирувата, катализируемого пируваткарбоксилазой, в качестве аллостерического активатора выступает ацетил-КоА. Последний изменяет конформацию белка, в результате уменьшается величина Кмдля бикарбоната. Этот эффект имеет важное значение для саморегуляции промежуточного обмена веществ, поскольку ацетил-КоА, образующийся из пирувата, активирует пируваткарбоксилазу и тем самым способствует образованию оксалоацетата и его дальнейшему окислению в цикле лимонной кислоты. Активация пируваткарбоксилазы и ингибирование пируватдегидрогеназы, которые вызываются ацетил-КоА, образующимся при окислении жирных кислот, позволяют понять тормозящее действие окисления жирных кислот на окисление пирувата и активирующее влияние на глюконеогенез в печени. Как в печени, так и в почках регуляция активностей пируватдегидрогеназы и пируваткарбоксилазы имеет реципрокный характер, благодаря этому метаболическая судьба пирувата изменяется при переходе от окисления углеводов, начинающегося с гликолиза, к глюконеогенезу. Окисление жирных кислот обеспечивает глюконеогенез, поставляя АТФ, необходимый для протекания реакций, которые катализируются пируваткарбоксилазой и фосфоенолпируваткарбоксикиназой [6]. · АДФ Активность пируваткарбоксилазы ингибируется по аллостерическому механизму высокими концентрациями АДФ. Механизиы регуляции: · Фруктозо-2,6-бисфосфат Аллостерически ингибирует фруктоза-1,6-бисфосфатазу. · АМФ Активность фруктозо-1,6-бисфосфатазы также по аллостерическому механизму угнетается высокими концентрациями АМФ.
Таким образом, в условиях дефицита энергии в клетках глюконеогенез будет заторможен, во-первых, из-за недостатка АТФ, а, во-вторых, из-за аллостерического ингибирования двух ферментов глюконеогенеза продуктами расщепления АТФ - АДФ и АМФ. Нетрудно заметить, что скорость гликолиза и интенсивность глюконеогенеза регулируются реципрокно. При недостатке энергии в клетке работает гликолиз и ингибирован глюконеогенез, в то время как при хорошем энергетическом обеспечении клеток в них работает глюконеогенез и ингибировано расщепление глюкозы. Фосфатдегидрогеназа.
Его Vmaxбольше, чем у 6-фосфоглюконатдегидрогеназы, поэтому он не является лимитирующим. Но он ингибируется избытком АТФ и своего продукта НАДН2. Значит, в определенных условиях его Vmaxможет стать меньше, чем Vmax6-фосфоглюконатдегидрогеназы. В этих условиях лимитирующая роль переходит к глюкозо-6-фосфатдегидрогеназе. Таким образом, роль ключевого фермента пентозофосфатного циклавыполняют сразу 2 фермента - обе дегидрогеназы, которые разделяют между собой функции ключевого и лимитирующего ферментов. Эти ключевые ферменты являются "пунктами вторичного контроля"пентозофосфатного цикла. Скоростьпентозофосфатного циклаопределяется либо 6-фосфоглюконатдегидрогеназой, либо (когда много НАДФН2 и АТФ) - глюкозо-6-фосфатдегидрогеназой. Реакциипентозофосфатного цикларегулируются генетически на уровне биосинтеза этих ферментов. Пентозофосфатный циклсуществует не во всех типах клеток. Наиболее интенсивнопентозофосфатный циклпротекает в печени, эритроцитах, надпочечниках, половых железах, жировой ткани и молочной железе. Но даже в этих тканях ГМФ-путем расщепляется не более 25-30% глюкозы. В этих тканяхпентозофосфатный циклимеет такое значение, потому что клеткам нужно много НАДФН2. Например: В жировой ткани с большой скоростью идет синтез жиров. В печени - синтез жиров, холестерина. В коре надпочечников и в половых клетках синтезируются стероидные гормоны. Для этого нужно много НАДФН2 [2,6,8]. Регуляция на генетическом уровне идет медленно, требуется время для проявления эффекта этого типа регуляции. Автономная регуляция приводит к практически мгновенному эффекту[6]. Пентозофосфатный цикл в эритроцитах нужен для обеспечения НАДФН2, но не для синтезов, а для защиты от токсических эффектов кислорода. В эритроцитах многие ферменты имеют в активных центрах. SH-группы, которые могут окисляться под действием кислорода. Накопленный при распаде глюкозы в пентозофосфатном циклеНАДФН2позволяет регенерировать эти SH-группы
Реакции, катализируемые бифункциональным ферментом (БИФ) в печени (А). Регуляция активности БИФ (Б). При низком инсулинглюкагоновом индексе, характерном для периода длительного голодания, происходит фосфорилирование БИФ, и он функционирует как фосфатаза. Результат - снижение количества фруктозо-2,6-бисфосфата. Киназную и фосфатазную реакции катализируют разные активные центры БИФ, но в каждом из двух состояний фермента (фосфорилированном и дефосфорилированном) один из активных центров ингибирован. Регуляторное влияние фруктозо-2,6-бисфосфата заключается в том, что он аллостерически активирует фос-фофруктокиназу (фермент гликолиза). При этом фруктозо-2,6-бисфосфат снижает ингибирующее действие АТФ на этот фермент в абсорбтивном периоде и повышает его сродство к фруктозо-6-фосфату. В то же время фруктозо-2,6-бисфосфат ингибирует фруктозо-1,6-бисфосфатазу (фермент глюконеогенеза). Итак, в абсорбтивном периоде уровень фруктозо-2,6-бисфосфата повышается, что приводит к активации фосфофруктокиназы и ускорению гликолиза. Результатом уменьшения количества фруктозо-2,6-бисфосфата в постабсорбтивном периоде будет снижение активности фосфофруктокиназы, замедление гликолиза и переключение гликолиза на глюконеогенез. Регуляция реакций II субстратного цикла фруктозо-2,6-бисфосфатом В регуляции третьего субстратного цикла основная роль принадлежит пируваткиназе, фосфорилированная форма которой неактивна, а дефосфорилированная - активна. В период пищеварения инсулин активирует фосфопротеинфосфатазу, которая дефосфорилирует пируваткиназу, переводя её в активное состояние. Кроме того, инсулин в печени влияет на количество ферментов, индуцируя синтез пируваткиназы и репрессируя синтез фосфоенолпи-руваткарбоксикиназы. Следовательно, гликолитическая реакция фосфоенолпируват → пируват ускоряется при пищеварении. Эта же реакция замедляется в постабсорбтивном состоянии под влиянием глюкагона, который опосредованно через цАМФ-зависимую протеинкиназу фосфорилирует и инакгивирует пируваткиназу. При длительном голодании глюкагон ускоряет глюконеогенез. Это достигается не только путём фосфорилирования пируваткиназы и снижением скорости гликолиза, но и путём индукции синтеза ферментов глюконеогенеза: фосфоенолпируваткарбоксикиназы, фруктозо-1,6-бисфосфатазы и глюкозо-6-фосфатазы. Известно, что глюкагон, фосфорилируя опосредованно транскрипционные факторы, влияет на их активность и таким образом индуцирует синтез этих ферментов глюконеогенеза. Кроме того, синтез фосфоенолпируваткарбоксикиназы при длительном голодании индуцируется кортизолом, однако это происходит в результате включения другого механизма действия, характерного для стероидных гормонов. Координация скорости реакции II и III субстратных циклов достигается с помощью фруктозо-1,6-бисфосфата - продукта II субстратного цикла (гликолитическое направление), который является аллостерическим активатором пируваткиназы. В период пищеварения вследствие ускорения начальных стадий гликолиза концентрация фруктозо-1,6-бисфосфата повышается, что приводит к дополнительной активации пируваткиназы.
Окислительный этап В окислительной части пентозофосфатного пути глюкозо-6-фосфат подвергается окислительному декарбоксилированию, в результате которого образуются пентозы. Этот этап включает 2 реакции дегидрирования. Первая реакция дегидрирования - превращение глюкозо-6-фосфата в глюконолактон-6-фосфат - катализируется МАDР+-зависимой глюкозо-6-фосфатдегидрогеназой и сопровождается окислением альдегидной группы у первого атома углерода и образованием одной молекулы восстановленного кофермента NADPH. Далее глюконолактон-6-фосфат быстро превращается в 6-фосфоглюконат при участии фермента глюконолактонгидратазы. Фермент 6-фосфоглюконатдегидрогеназа катализирует вторую реакцию дегидрирования окислительной части, в ходе которой происходит также и декарбоксилирование. При этом углеродная цепь укорачивается на один атом углерода, образуется рибулозо-5-фосфат и вторая молекула гидрированного NADPH. Неокислительный этап Неокислительный этап пентозофосфатного пути включает серию обратимых реакций, в результате которых рибулозо-5-фосфат превращается в рибозо-5-фосфат и ксилулозо-5-фосфат, и далее за счёт переноса углеродных фрагментов в метаболиты гликолиза - фруктозо-6-фосфат и глицеральдегид-3-фосфат. В этих превращениях принимают участие ферменты: эпимераза, изомераза, транскетолаза и трансальдолаза. Транскетолаза в качестве кофермента использует тиаминдифосфат. Неокислительный этап пентозофосфатного пути не включает реакции дегидрирования и поэтому используется только для синтеза пентоз. Рибулозо-5-фосфат служит субстратом для двух ферментов. Фермент рибулозо-5-фосфат-З-эпимераза изменяет стехиометрическое положение одной ОН-группы у третьего атома углерода, превращая рибулозо-5-фосфат в ксилулозо-5-фосфат. Другой фермент - рибулозо-5-фосфатизомераза - катализирует превращение рибулозо-5-фосфата в рибозо-5-фосфат. Рибозо-5-фосфат, образующийся в неокислительной фазе, обеспечивает клетки рибозой, необходимой для синтеза нуклеотидов, которые служат предшественниками и структурными компонентами коферментов дегидрогеназ и нуклеиновых кислот. Ферменты транскетолаза и трансальдолаза катализируют перенос двух- и трёхуглеродных фрагментов, соответственно используя в качестве донора углеродных фрагментов кетозу, а альдозу - в качестве акцептора. Эти реакции протекают в 2 этапа: сначала происходит отщепление углеродного фрагмента от молекулы-донора, - а затем - перенос этого фрагмента на молекулу, выполняющую роль акцептора. Транскетолаза в неокислительной фазе пентозофосфатного пути катализирует 2 реакции. В первой реакции транскетолаза расщепляет связь С-С между кетогруппой и соседним атомом углерода в молекуле ксилулозо-5-фосфат, в результате чего кетосахар превращается в альдозу, глицеральдегид-3-фосфат, содержащую на 2 атома углерода меньше. Образующийся после расщепления двухуглеродный фрагмент остаётся ковалентно связанным в каталитическом центре фермента с коферментом тиаминдифосфатом. Далее фермент переносит двухуглеродный фрагмент на альдегидную группу альдосахара, образую новую кетозу - седргептулозо-7-фосфат.
3.Синтез и распад гликогена. Синтез гликогена протекает не во всех тканях, а только в печени, мышцах и в лейкоцитах. После образования глюкозо-6-фосфата (гексокиназная реакция) происходит внутримолекулярный перенос остатка фосфорной кислоты из 6-го положения в 1-е. При этом образуется глюкозо-1-фосфат: После изомеризации глюкозо-6-фосфата в глюкозо-1-фосфат протекает дополнительная активация глюкозного фрагмента. При этом расходуется 1 молекула УТФ, что эквивалентно расходованию 1-й молекулы АТФ. В результате образуется активированная форма - УДФ-глюкоза: Затем с УДФ глюкозный остаток переносится на молекулу гликогена. Удлинение цепи гликогена катализирует фермент гликогенсинтетаза. Таким образом, цепь гликогена становится на 1 глюкозный фрагмент длиннее. Гликоген, в отличие от растительного крахмала, более сильно разветвлен. Для формирования ответвлений существует специальный фермент, который называется "гликогенветвящий фермент" (стр.242 учебника). Молекула гликогена синтезируется не с "нуля", а происходит постепенное удлинение уже имеющегося кусочка цепи: "затравки". И при распаде гликогена никогда не происходит полного разрушения его молекул. Для включения одного остатка глюкозы в молекулу гликогена клетка расходует 2 молекулы АТФ. При распаде гликогена эта АТФ не регенерирует, а освобождается только Фн (неорганический фосфат). Ключевым ферментом синтеза гликогена является гликогенсинтаза. Это "пункт вторичного контроля". Ее Vmaxбольше, чем у гексокиназы, но меньше, чем у любого другого фермента на пути синтеза гликогена. Регуляция гликогенсинтазы: она активируется избытком глюкозо-6-фосфата. Поэтому если глюкозо-6-фосфат другими путями утилизируется медленно, то возрастание его концентрации приводит к увеличению скорости синтеза гликогена. Реакция, катализируемая гликогенсинтазой, необратима. В определенных условиях гликоген способен распадаться. Для этого существует свой обходной обратный путь. Его ключевым ферментом является гликогенфосфорилаза (фосфорилаза). Этот фермент расщепляет молекулу гликогена с участием Фн до глюкозо-1-фосфата и гликогена, укороченного на один глюкозный фрагмент: (С6Н10О5)n + H3PO4----> (C6H10O5)n-1+ глюкозо-1-фосфат Фосфорилаза - ключевой (то есть лимитирующий и регуляторный) фермент распада гликогена. Регуляция гликогенфосфорилазы: угнетается избытком АТФ, активируется избытком АДФ. Механизм ветвления гликогена
Гликоген - основная форма депонирования глюкозы в клетках животных. У растений эту же функцию выполняет крахмал. В структурном отношении гликоген, как и крахмал, представляет собой разветвленный полимер из глюкозы. Однако гликоген более разветвлен и компактен. Ветвление обеспечивает быстрое освобождение при распаде гликогена большого количества концевых мономеров. Синтез и распад гликогена не являются обращением друг в друга, эти процессы происходят разными путями.
Распад гликогена. Освобождение глюкозы в виде глюкозо-1-фосфата (реакция 5) происходит в результате фосфоролиза, катализируемого фосфорилазой. Фермент отщепляет концевые остатки один за другим, укорачивая цепи гликогена. Однако этот фермент расщепляет только -1,4 гликозидные связи. Связи в точке ветвления гидролизуются ферментом амило--1,6-гликозидазой, который отщепляет мономер глюкозы в свободном виде.
Виды гликогенозов Гликогеноз X типа Эта разновидность описана всего лишь единственный раз во всем мире. Тип наследования установить не удалось. Заболевание протекало с увеличением печени, сопровождалось болью и напряжением мышц при вовлечении их в работу. Лечение Гликогенозы, как и практически все генетические заболевания, являются неизлечимой патологией. Все меры медицинской помощи, по существу, являются симптоматическими. Тем не менее, поскольку ряд гликогенозов имеет благоприятный прогноз для жизни при соблюдении ряда условий (в частности мышечная форма II типа, III, V, VI, VII, IX, XI тип), то лечебные мероприятия способствуют уменьшению ряда симптомов и улучшению состояния здоровья пациента. В основу лечения при гликогенозах положена диетотерапия, позволяющая избежать гипогликемии и второстепенных нарушений метаболических процессов в организме. Суть диеты заключается в изучении гликемического профиля больного и подборе такого режима приема пищи, который позволит избежать прогрессирования биохимических нарушений (нарушений метаболизма жиров, молочной кислоты) и обеспечит достаточный уровень глюкозы в крови. Частые, в том числе ночные, кормления у маленьких детей помогают избежать гипогликемии. Обычно назначается пища, содержащая много белков и углеводов, а жиры ограничиваются. Процентное соотношение приблизительно следующее: углеводы — 70%, белки – 10%, жиры – 20%. Для того чтобы не приходилось кормить ребенка несколько раз за ночь, может использоваться сырой кукурузный крахмал (назначается детям старше 1 года), который разводят водой в соотношении 1:2. Начинают введение с дозы 0,25 мг/кг, затем ее постепенно увеличивают настолько, чтобы введенной дозы крахмала хватало для обеспечения организма глюкозой на 6-8 часов, то есть на всю ночь. Таким образом, прием крахмала на ночь позволяет отказаться от ночных кормлений, что обеспечивает детям полноценный сон без перерывов. В тех случаях, когда маленькие дети страдают от частых приступов гипогликемии, и повлиять на это только соблюдением диеты не удается, назначается дополнительное введение чистой глюкозы или смеси, обогащенной мальтодекстрином. При гликогенозе I типа требуется значительно ограничить продукты, содержащие галактозу и фруктозу (молоко, большинство фруктов). При III типе гликогеноза таких ограничений нет. При VII типе нужно ограничить поступление сахарозы. В ряде случаев (особенно при возникновении других, интеркуррентных заболеваний у таких детей) одного энтерального питания становится недостаточно, поскольку потребность организма в энергии повышается. Тогда прибегают к кормлению через назогастральный зонд и внутривенным инфузиям в условиях стационара. Те разновидности гликогенозов, при которых дефекты ферментов локализованы только в мышцах, требуют употребления фруктозы внутрь по 50-100 г в день, комплекса витаминов, аденозинтрифосфорной кислоты. Из медикаментозных препаратов при гликогенозе I типа используют препараты кальция, витамин Д и В1, аллопуринол (для предотвращения подагры и отложения уратов в почках), никотиновую кислоту (для снижения риска калькулезного холецистита и предотвращения панкреатита). Если с почками начинает выводиться белок, тогда назначают ингибиторы ангиотензинпревращающего фермента (Лизиноприл, Эналаприл и другие). Для гликогеноза II типа разработана специфическая ферментная терапия (заместительная). Препарат Миозим вводится по 20 мг/кг каждые две недели. Миозим представляет собой созданный с помощью генной инженерии искусственный человеческий фермент α-глюкозидазу. Естественно, эффект тем больше, чем раньше начато лечение. Но пока что препарат разрешен к применению только в некоторых странах Европы, в Японии и США. Генная инженерия продолжает разработки в этом направлении, пытаясь синтезировать и другие ферменты, необходимы для нормального синтеза и расщепления гликогена, чтобы помочь больным с остальными формами гликогенозов. Некоторым больным помогает введение глюкокортикоидов, анаболических гормонов и глюкагона. Препараты стимулируют некоторые биохимические процессы (например, глюконеогенез, то есть процесс синтеза глюкозы из неуглеводных веществ), тем самым уменьшая проявления заболевания. Из хирургических методов лечения при некоторых формах гликогенозов используют наложение портокавального анастомоза или трансплантацию печени. Портокавальный анастомоз накладывают больным с тяжелой формой гликогеноза I и III типов. Он позволяет уменьшить обменные нарушения, способствует регрессу размеров печени, улучшает переносимость гипогликемии. Пересадка печени от донора осуществляется при I, III, IV типах гликогенозов. При гликогенозе I типа операция проводится только при неэффективности мероприятий диетотерапии, при гликогенозе III типа – когда печень больного уже не спасти. Таким образом, гликогенозы – это довольно обширная группа болезней обмена веществ с генетическими истоками. На сегодняшний день, медицина не располагает 100%- ми методами эффективного лечения сего недуга, перспективы в этом направлении принадлежат генной инженерии. Реакции пентозофосфатного пути превращения глюкозы Пнтозофосфатный путь – альтернативный путь окисления глюкозы. Его функции: - поставляет клеткам кофермент НАДФН, использующийся как донор водорода в реакциях восстановления; беспечивает клетки пентозофосфатами для синтеза нуклеотидов и нуклеиновых кислот. Пентозофосфатный путь не приводит к синтезу АТФ. Ферменты пути локализованы в цитозоле. В пентозофосфатном пути превращения глюкозы выделяют окислительный и неокислительный пути образования пентоз. Окислительный путь включает две реакции дегидрирования. Коферментом дегидрогеназ является НАДФ+, восстанавливающийся в НАДФН. Пентозы образуются при окислительном декарбоксилировании.
Неокислительный путь включает реакции переноса 2- и 3-х углеродный фрагментов с одной молекулы на другую. Этот путь служит для синтеза пентоз. Процесс обратим, и из пентоз могут образовываться гексозы.
Пентозофосфатный путь образования пентоз протекает в печени, жировой ткани, молочной железе, коре надпочечников, эритроцитах. 1). Дегидрирование глюкозо-6-фосфата при участии глюкозо-6-фос-фатдегидрогеназы и кофермента НАДФ+ с образованием 6-фосфоглюконо-d-лактона и НАДФН:
2). 6-фосфоглюконо-d-лактон нестабилен и гидролизуется с образованием 6-фосфоглюконата (фермент – 6-фосфоглюконолактоназа):
3). Дегидрирование и декарбоксилирование 6-фосфоглюконата с образованием рибулозо-5-фосфата (пентоза) и НАДФН при участии декарбоксилирующей 6-фосфоглюконатдегидрогеназы:
4). Под действием эпимеразы из рибулозо-5-фосфата образуется ксилулозо-5-фосфат (пентоза). Под влиянием изомеразы рибулозо-5-фосфат превращается в рибозо-5-фосфат (пентоза). Между формами пентозофосфатов устанавливается равновесие:
На этом этапе пентозофосфатный путь может быть завершен. При других условиях наступает неокислительная стадия пентозофосфатного цикла, протекающая в анаэробных условиях. Она заключается в переносе двух- и трехуглеродных фрагментов от одной молекулы к другой. При этом образуются вещества, характерные для гликолиза (фруктозо-6-фосфат, фруктозо-1,6-бисфосфат, фосфотриозы), и вещества, специфические для пентозофосфатного пути (седогептулозо-7-фосфат, пентозо-5-фосфаты, эритрозо-4-фосфат).
Шесть молекул глюкозо-6-фосфата в пентозофосфатном цикле образуют 6 молекул рибулозо-5-фосфата и 6 молекул СО2. Из 6 молекул рибулозо-5-фосфата регенерируется 5 молекул глюкозо-6-фосфата:
Промежуточные продукты цикла (фруктозо-6-фосфат и глицеральдегид-3-фосфат) включаются в гликолиз.
Образование восстановительных эквивалентов
|
|||||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 244; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.61.119 (0.082 с.) |