Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основные составляющие промышленных ВВСодержание книги
Поиск на нашем сайте
В 1867 году в Швеции И. Олсон и И. Норбин получили патент на использование аммиачной селитры в составах ВВ. Аммиачная селитра (азотнокислый аммоний или нитрат аммония), NH4NO3 представляет собой бесцветное кристаллическое вещество. Выпускается в виде чешуек, гранул, кристаллов. Легко растворяется в воде, Плотность 1,56-1,74 г/см3; при температуре от –18° до +32°С плотность составляет 1,725 г/см3. В зависимости от температуры аммиачная селитра (АС) может существовать в различных модификациях. Фазовые переходы в АС осуществляются при температурах: –16°С; +32°С; +85°С; +125°С. При температуре 169,1°С АС плавится. При разложении один грамм селитры выделяет 0,2 г кислорода, окисляющего водород, углерод, алюминий. Из-за этого свойства АС используют в качестве компонента взрывчатых смесей. Насыпная плотность АС 0,8-0,9 г/см3. Толщина слоя, по которому устойчиво может распространяться детонация, равна 30-50 мм, а слоя из пыли АС - 15÷20 мм. Критический диаметр открытого заряда АС при плотности 0,8 г/см3 - 100 мм, а сухая и тонкоизмельченная АС имеет критический диаметр 10 мм, товарная (обычная селитра) имеет критический диаметр 200÷250 мм. Растворение АС в воде происходит со значительным поглощением тепла и понижением температуры замерзания раствора. При растворении 6 частей в 10 частях воды температура снижается на 17°, а раствор, содержащий 50г АС на 100 г воды, замерзает при –18°С. В связи с этим в местах хранения АС и аммиачно-селитренных ВВ следует систематически вести наблюдения за температурой и влажностью воздуха. Известные трудности возникают при работе со слежавшейся АС. Для уменьшения слеживаемости АС выпускают в виде гранул или крупных чешуек. Водоустойчивая аммиачная селитра ЖВ, содержащая гидрофобную смесь парафина и железных солей жирных кислот, обладает заметно меньшей слеживаемостью. Скорость детонации АС в зависимости от условий 1,5-3,4 км/с. Инициирование зарядов АС осуществляют промежуточным детонатором (например, зарядом аммонита, массой 5÷20% массы заряда АС). Теплота взрыва 335÷375 ккал/кг. В зависимости от материала оболочки существенно изменяется критический диаметр АС: в бумажной оболочке - 10÷12 см, а в стальной - 5 см. Гранулированная или чешуйчатая АС в мешке не детонирует от взрыва 500 г тротиловой шашки. По условиям хранения и транспортирования аммиачная селитра не относится к ВВ. Натриевая, калиевая и кальциевая селитры имеют высокую плотность (более 2 г/см3) и в два раза больше содержат кислорода, чем АС. Но эти селитры имеют ограниченное применение, их добавки повышают плотность ВВ, снижают температуру его замерзания, хорошо удерживают воду в составе ВВ. Смеси перечисленных селитр с горючими добавками более чувствительны к механическим воздействиям и воспламенению. Динамоны - это смеси АС с горючими невзрывчатыми веществами: тонкодисперсной смеси АС с горючими веществами типа древесной муки, измельченного торфа и других целлюлозных материалов, а также алюминиевой пудры и горючих жидкостей. К этой группе относятся игданит и гранулит. Первый получают путем смешивания гранулированной АС с дизельным топливом (ДТ). Названо это ВВ было авторами (1958 г.) в честь института горного дела им. А.А. Скочинского - ИГД. Второе ВВ - гранулит - представляет собой смесь гранулированной АС с минеральными маслами, иногда содержащие добавку алюминиевой пудры. Известны гранулиты АС-4, АС-8, гранулит-М и др. Тротил (тринитротолуол, тол) - это ВВ класса химических соединений (однокомпонентное ВВ). Впервые получен в 1863г., а в 1891 г. его стали выпускать как промышленный продукт во многих странах мира. Кристаллы чистого тротила имеют цвет от светло- до темно-желтого.
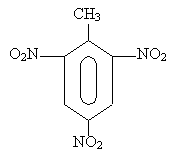
Тротил C6H2(NO2)3CH3 является одним из самых распространенных ВВ и представляет собой кристаллическое вещество. Он выдерживает нагревание в течение нескольких часов при температуре до 240°С. С химической точки зрения тротил представляет собой тринитротолуол и относится к классу нитросоединений ароматического ряда:
Впервые чистый тротил был получен в 1863 году, а применяется в практике взрывного дела с 1891 года. На его основе разработан целый ряд смесевых ВВ. Так А.А. Солонин изобрел аммотол - смесь аммиачной селитры с тротилом. Уже к началу XX века тротил стал основным бризантным ВВ, не уступая своих позиций и в настоящее время. Благодаря невысокой реакционной способности, он весьма стоек и легко смешивается или сплавляется с различными веществами (селитрой, алюминием, гексогеном, ксилилом и т.д.). Тротил мало чувствителен к механическим воздействиям. Взрывается при падении груза 10 кг с высоты 25 см. Чувствительность к детонации мала, причем чувствительность литого тротила заметно ниже, чем прессованного. Литой тротил не взрывается даже от штатного капсюля-детонатора, ему необходим промежуточный детонатор. Тротил получают нитрованием толуола, производимого из каменноугольной смолы на коксовых заводах или из нефти, подвергшейся пиролизу. Нитрование производится концентрированной азотной кислотой: C6H2(NO2)3CH3+3HNO3= C6H2(NO2)3CH3+3H2O. Наряду с одностадийной технологией применяются двух- и трёхстадийные способы нитрования. После нитрования необходима тщательная промывка горячей водой от кислоты и очистка от несимметричных изомеров, динитротолуола и других примесей. Очистку производят раствором сульфита натрия или перекристаллизацией из чистого этилового спирта. После очистки тротил сушат и чешуируют. Готовый тротил должен представлять собой однородную массу, состоящую из чешуек (кристаллов ромбической формы) светло-жёлтого или жёлтого цвета с температурой затвердевания не менее 80,20С, с содержанием влаги и летучих не более 0,07 %, с кислотностью не более 0,01%. Содержание примесей, не растворимых в бензоле или толуоле, должно быть менее 0,1%. Насыпная плотность порошкообразного тротила0,9 г/см3. При прессовании под давлением около 4000 кг/см2 плотность достигает 1,6 г/см3. Литой тротил имеет плотность 1,54 -1,59г/ см3. Температура вспышки тротила около 310°С. Вспышка взрывом не сопровождается. Горение тротила в замкнутом пространстве или больших масс может привести к взрыву. Восприимчивость тротила к инициированию можно по мере ее уменьшения представить таким рядом: порошкообразный, прессованный, чешуйчатый, гранулированный, литой. Прессованный тротил инициируют капсюлем-детонатором (КД) или несколькими витками детонирующего шнура (ДШ). Для взрыва литого тротила требуется промежуточный мощный детонатор из прессованных шашек тротила или патронов аммонита. Теплота взрыва тротила при плотностях 0,85 г/см3 и 1,5 г/см3 составляет соответственно 3393,9 кДж/кг и 4231,9 кДж/кг. Скорость детонации сухого гранулированного тротила в открытых зарядах диаметром 60 мм составляет 2,7÷3,3 км/с, в водонаполненном состоянии - 6 км/с. Критический диаметр детонации сухого гранулированного тротила в открытых зарядах около 60 мм, водонаполненного 25÷30 мм кислородный баланс (–74%). Работоспособность водонаполненного гранулированного тротила по пробе Трауцля дает 310-315 см3, сухого порошкообразного - 285 см3. Бризантность водонаполненного гранулированного тротила составляет 23 мм, сухого гранулированного - 9 мм, а тонкоизмельченного - 16 мм. В настоящее время из-за токсичности практически все страны мира не производят тротил и не используют его в промышленности. Тротил практически нерастворим в воде, имеет высокую химическую стойкость. Вспышка его обычно не сопровождается взрывом. Температура вспышки тротила составляет 310°С. Переход горения в детонацию наблюдается только при воспламенении тротила в замкнутом пространстве или в очень больших количествах. Применяют тротил в порошкообразном, прессованном, чешуйчатом, гранулированном виде, а иногда в виде кусков и литых зарядов. При попадании в тротил песка или других твердых примесей резко возрастает его чувствительность к удару и трению, что необходимо учитывать при закладке в скважины. Наиболее чувствительным к инициированию является порошкообразный тротил, наименее – литой. Порошкообразный и прессованный тротил взрываются от капсюля-детонатора или от нескольких витков ДШ. Для взрыва гранулированного или литого тротила требуется более мощный промежуточный детонатор из тротиловых шашек или патроноваммонита. Очень часто на практике применяют понятие энергетического эквивалента – тротилового эквивалента. Для этого выбирают в качестве эталонного ВВ тротил и опытным путем для него находят точное значение соответствующих функций P=f[(G)1/3R-1] и I=[(G)1/6R-1], где: Р – давление при взрыве, I – полный импульс, G – вес заряда, R - расстояние от центра заряда до места измерения. После чего определяют вес заряда исследуемого ВВ, который на любом расстоянии дает одинаковое значение параметров волны с зарядом тротила известного веса. Эта величина и называется тротиловым эквивалентом ВВ. Тротиловый эквивалент m соответствует отношению показателей работоспособности данного ВВ (Qvh)ВВ по отношению к таким же показателям тpoтила (Qvh)ТР: m=[(Qvh)ВВ/(Qvh)ТР]. В большинстве случаев при оценке тротилового эквивалента пользуются отношением только теплот взрыва m=[(Qv)ВВ/(Qv)ТР], что целесообразно для ВВ с близким составом продуктов взрыва. Разложение тротила при взрывчатом превращении происходит в соответствии с уравнением реакции: C6H2(NO2)3CH3=2,5H2O+3,5CO+3,5C+1,5N2 с тепловым эффектом 932кДж/моль или 4235 кДж/кг, при этом объём газообразных продуктов составляет порядка 0,750 м3 на 1 кг тротила. Тротил имеет большой отрицательный кислородный баланс, из-за чего при его взрыве выделяется значительное количество твёрдых продуктов - сажи. Алюмотол - это смесь тротила с алюминиевым порошком (№15). Гранулированный алюмотол готовят путем смешивания расплавленного тротила с алюминиевым порошком и последующей грануляции полученной смеси в воде. Продукт представляет собой серебристого цвета гранулы диаметром 3-5 мм. Теплота взрыва водонаполненного алюмотола составляет 5195,6 кДж/кг; работоспособность 420-430 см3; бризантность - 24,5 мм. Скорость детонации в открытых зарядах диаметром 60 мм 5,5÷6,0 км/с. Тетрил (тринитрофенилметилнитрамин) C6H2(NO2)4NCH3 –
представляет собой порошкообразную массу мелкокристаллического вещества светло-желтого цвета с температурой плавления около130°С. В соответствии с химической номенклатурой тетрил является тринитрофенилметилнитроамином и относится к классу нитросоединений ароматического ряда:
Все нитросоединения нерастворимы или малорастворимы в воде, практически не гигроскопичны и водоустойчивы. С увеличением числа нитрогрупп взрывчатые свойства нитросоединений усиливаются, а токсичность, наоборот, снижается. Температура вспышки тетрила находится в интервале температур 190-194°С. При горении даже в сравнительно небольших количествах он способен взрываться. Тетрил относится к категории ВВ весьма чувствительных к тепловому и механическому воздействию. Примесь даже 0,05% песка резко повышает чувствительность тетрила к удару и трению. Соединения, у которых нитрогруппа связана с углеродным атомом через азот, характеризуются меньшей химической устойчивостью. Более того, они обладают высокой чувствительностью и повышенной опасностью в обращении: тетрил, имеющий температуру плавления около 128°С, при длительной выдержке при температуре 140°С способен к самовоспламенению. Тетрил также обладает большой восприимчивостью к детонации и очень хорошо передает ее другим ВВ. Чувствительность к механическому воздействию и детонации выше, чем у пикриновой кислоты, бризантность также выше (19 мм). Используют для изготовления шашек - промежуточных детонаторов. В виду большой мощности тетрил особенно пригоден для изготовления капсюлей-детонаторов и детонаторов (ЭД, КД). На открытых взрывных работах тетрил применяют в виде шашек как промежуточный детонатор для инициирования маловосприимчивых ВВ. Для снаряжения боеприпасов практически не применяется. Получают тетрил нитрованием сульфата диметиланилина:
Сульфат диметиланилина получают растворением диметиланилина в избытке серной кислоты. Смесь обрабатывается азотной кислотой. Из промытого от остатков кислоты осадка получают готовый тетрил кристаллизацией в процессе сушки. Разложение тетрила при взрывчатом превращении происходит в соответствии с уравнением реакции: C6H2(NO2)4NCH3=2,5H2O+5,5CO+1,5C+2,5N2 с тепловым эффектом 1246 кДж/моль или 4610 кДж/кг, при этом объём газообразных продуктов составляет порядка 0,740 м3 на 1 кг тетрила. Тетрил имеет четко выраженный отрицательный кислородный баланс, что необходимо учитывать на практике.
Гексоген (циклотриметилентринитроамин, циклонит, RDX) (CH2)3N3(NO2)3 представляет собой белое порошкообразное кристаллическое вещество без вкуса и запаха с температурой вспышки 230°C. С химической точки зрения гексоген представляет собой циклотриметилентринитроамин:
В воде он практически нерастворим. Гексоген чрезвычайно токсичен и обладает химической стойкостью: признаки разложения заметны лишь при температуре около 200°C. Обладает работоспособностью по Трауцлю 475 см3, фугасность составляет 470 мл. При воспламенении сгорает с характерным ярким пламенем. Температура вспышки - 290°С. Чувствительность к удару - 30 см. Теплота взрыва в прессованном виде 5447 кДж/кг. При испытаниях по стандартной пробе Гесса навеска гексогена разрушает свинцовый столбик. Впервые гексоген был получены в конце XIX века, но как ВВ нашел применение только с 1920 г. Применяется как вторичное инициирующее ВВ в детонаторах; в смеси с тротилом или в сплаве с тротилом в виде шашек ТГ; в качестве сенсибилизатора в некоторых сортах мощных аммонитов (например, в аммоните скальном №1). Гексоген флегматизируют воскообразными веществами в составах А-IХ-I, А-IХ-2 или специальным лаком в составе ГФГ-2; с тротилом или алюминием – шашки ТГА; в виде пластичных и эластичных ВВ на основе гексогена. Используют в некоторых типах твердых ракетных топлив в качестве активного горючего. Гексоген по мощности значительно превзошёл ранее применявшиеся бризантные взрывчатые вещества: 1 кг гексогена, занимающий объем 0,6л, выделяет при взрыве 5,40 МДж за 10-5 с, что соответствует 500 ГВт - т.е. в десятки раз больше, чем мощность крупнейшей электростанции; а энергии, полученной при взрыве 200 г этого ВВ при условии полного использования, достаточно для того, чтобы поднять массу в 120 тонн на высоту в 1 метр. Во время второй мировой войны он широко использовался для изготовления детонаторов и разрывных зарядов бронебойных и кумулятивных боеприпасов. Получают гексоген нитрованием уротропина (CH2)6N4 (температура плавления 165°С, хорошо растворим в воде, температура вспышки 190°С, фугасность 190 мл.):
С целью увеличения выхода гексогена возможно использование динитрата уротропина вместо чистого уротропина, но при этом важное значение имеют концентрация азотной кислоты и наличие оксидов азота, которые способны вызывать окисление или "выгорание" уротропина. Гексоген, полученный нитрованием динитрата уротропина, почти полностью растворяется в азотной кислоте. Для его выделения данный раствор разбавляют до концентрации кислоты <60%, при которой растворимость гексогена незначительна. При этом необходимо предотвращать повышение температуры. Чувствительность к удару меньше, чем у ТЭНа, но больше, чем у тротила. Наряду с ТЭНом гексоген является сильнейшим и наиболее бризантным ВВ. Для уменьшения чувствительности гексоген обычно флегматизируют парафином или воском. В чистом виде он пригоден только для изготовления капсюлей-детонаторов (в качестве вторичного инициирующего ВВ) и детонирующих шнуров. В смесях с тротилом гексоген используется для снаряжения боеприпасов, а также применяется в качестве компонента некоторых сортов аммонитов с целью увеличения их мощности и для изготовления зарядов и торпед, используемых при прострелке нефтяных скважин. В качестве примера использования гексогена в пластиковых взрывчатках можно указать пластифицированный гексоген С-1 (название по военной классификации) - смесь 88% гексогена, 11% вазелина и 1% белкового (казеинового) клея в пластиковой укупорке. Для ВВ с отрицательным кислородным балансом, коим является гексоген, преобладающей реакцией считают окисление углерода до СО: 2С+O2=2CO. Если при этом не весь кислород расходуется, то его остаток практически равными долями идет на окисление СО до СО2 и Н2 до H2O, что обусловлено близкими тепловыми эффектами реакций CO+0,5O2=CO2+242 кДж/моль и H2+0,5O2=H2O+282 кДж/моль. По этой схеме гексоген при взрыве образует следующие продукты распада: С3H6N3(NO2)3=3H2O+3CO+3N2 с тепловым эффектом 1128 кДж/моль или 5400 кДж/кг. Объём образующихся газов при взрыве составляет порядка 0,890 м3/кг. Октоген (циклотетраметилентетранитрамин, НМХ) C4H8N8O8 - кристаллический белый порошок; плотность монокристаллов 1,9 г/см3; температура плавления с разложением 277°С. Температура вспышки 335°С. Токсичен. Скорость детонации около 9 км/с. Получен в 1941 г. Обладает относительно высокой термостабильностью. Входит в состав твердых ракетных топлив. Его используют в зарядах для перфорации глубоких нефтяных скважин с температурой выше 180°С. Имеет 4 кристаллических модификации. Одна из них - β-модификация - является стабильной формой, обладает наименьшей чувствительностью к механическим воздействиям. ТЭН (тетранитропентаэритрит) C5H8(ONO2)4 получен в 1894 году. Кристаллический порошок белого цвета. Плотность монокристаллов 1,728 г/см3. Влаги не боится. Скорость детонации 8,2÷8,7 км/с. Температура вспышки 255°С, температура плавления с разложением - 141°С, работоспособность 500 см3. Чувствительность к удару 30 см. Химически стойкое вещество. Теплота взрыва 6201 кДж/кг. Бризантность высокая: свинцовый столбик разрушается. Небольшие количества тэна сгорают спокойно, при повышенном давлении горение переходит во взрыв. Обладает высокой чувствительностью к трению и удару, поэтому его выпускают не только в чистом виде, но и флегматизированным парафином и другими подобными веществами. Критический диаметр детонации тэна при плотности 1 г/см3 равен 3 мм. Используется в качестве вторичного инициирующего ВВ в некоторых КД. Застывшая суспензия тэна в тротиле (пентолит) применяется в шашках в качестве промежуточных детонаторов. Используется для изготовления пластитов и эластитов. Применяется в качестве медицинского препарата под названием "ЭРИНИТ", который является аналогом нитроглицерина. Кроме этого, ТЭН нашел широкое применение в детонирующих шнурах, поскольку имеет критический диаметр детонации - 1 мм. Нитроглицерин (тринитрат глицерина, НГ, НГЦ) C3H5(ONO2)3
представляет собой маслянистую бесцветную жидкость с характерным сладким вкусом (технический нитроглицерин имеет слабо жёлтую окраску). При температуре более 50°С летуч. Хорошо растворим в большинстве органических растворителей, хорошо растворяет коллоидный хлопок, на чем основано получение желатинизированного нитроглицерина для пластичных динамитов. Заключает в себе большой запас энергии: его работоспособность 590 см3, бризантность по Гессу 24-26 мм. Является сильнодействующим ядом, вызывая острые головные боли при вдыхании его или при соприкосновении с кожей. От пламени загорается с некоторым трудом; легко воспламеняется искрой огнепроводного шнура. В небольших количествах (до 2 кг) сгорает спокойно. Горение больших количеств переходит во взрыв. С химической точки зрения нитроглицерин представляет собой глицеринтринитрат: CH2ONO2-CHONO2-CH2ONO2. Тринитроглицерин впервые получил в 1846 г. в Италии химик-исследователь А. Собреро. Это, безусловно, способствовало целому комплексу исследований по поиску новых ВВ. Однако до 1854 г. нитроглицерин из-за большой опасности при получении и использовании на практике не был востребован. Впервые предложение о практическом применении нитроглицерина для разрывных зарядов в артиллерийских снарядах внес в 1854 году, во время Крымской войны, профессор Н.Н. Зинин. Но вследствие большой опасности при снаряжении и при использовании боеприпасов, начинённых нитроглицерином, Главное артиллерийское управление отказалось от применения нитроглицерина. Поэтому впервые чистый нитроглицерин был применен для изготовления взрывчатых смесей в горно-добывающей промышленности только в 1867 г. Однако на золотых приисках в Восточной Сибири при производстве взрывных работ артиллерийский офицер З.Ф. Петрушевский, работавший под руководством знаменитого русского химика Н.Н. Зинина, использовал разработанное им в 1853 г. ВВ на основе нитроглицерина, аналогичное по составу динамитам - «магнезиальный динамит» (75% нитроглицерина и 25% углекислого магния). Но подлинную революцию в мирном и военном применении динамитов и порохов на основе нитроглицерина, а также средств их инициирования произвел знаменитый шведский инженер и предприниматель А. Нобель, разработавший в 1888 г. нитроглицериновый баллиститный порох, получаемый путем желатинизации нитроцеллюлозы нитроглицерином. В России технологию бездымного пироксилинового пороха разработал в 1891 г. Д.И. Менделеев. Нитроглицерин получают обработкой глицерина смесью концентрированных азотной и серной кислот. Хорошо отмытый от этих кислот он достаточно химически стоек при комнатной температуре, но при наличии следов кислот способен постепенно разлагаться с последующим взрывом. Чувствительность к удару весьма велика: детонирует при падении груза массой 2 кг с высоты 4 см. Применяется в смеси с нитроцеллюлозой для получения нитроглицеринового пороха, а в смеси с нитроцеллюлозой и другими горючими наполнителями для производства динамитов. Взрывчатые смеси на основе нитроглицерина содержат обычно нитроглицерин в желатинизированном виде, т.е. в виде смеси с растворяющей его нитроцеллюлозой. Полученный гель требует добавок инертных горючих компонентов (древесной муки, ваты, песка и т.д.) или неорганических окислителей (аммиачной или калиевой селитры). Однако следует отметить, что из-за высокой чувствительности и опасности в обращении, а также дороговизны взрывчатые смеси на основе нитроглицерина (динамиты) в последнее время утратили свое былое значение во взрывном деле. Направление протекания реакции любого взрывчатого превращения лимитируется принципом Ле-Шателье-Брауна и законами химической термодинамики. Взрыв можно рассматривать как термохимическую реакцию, протекающую в адиабатических условиях, поэтому в соответствии со вторым законом термодинамики, базирующемся на фундаментальном принципе максимизации энтропии, любая изолированная система будет стремиться перейти в такое состояние, при котором бы обеспечивался максимум значения энтропии системы. В предельном случае это обуславливает образование термодинамически наиболее устойчивых соединений (стабильных фаз), что, в свою очередь, сопровождается максимальным тепловым эффектом процесса. Так разложение нитроглицерина осуществляется в соответствии с уравнением реакции: C3H5(ONO2)3=2,5H2O+3CO2+1,5N2+0,25O2 с тепловым эффектом 1420 кДж/моль или 6200 кДж/кг. Равновесие этой химической реакции при взрыве смещается в направлении образования высших оксидов углерода и водорода CO2 и H2O, молекулярных азота N2 и кислорода O2, т.е. в направлении образования продуктов реакции. При взрыве образуется порядка 0,715 м3 газообразных продуктов на 1 кг нитроглицерина. Ограниченно применяется в качестве сенсибилизаторов при изготовлении некоторых предохранительных ВВ: победитов, угленитов, серного и нефтяного аммонитов. Единственное штатное БВВ жидкое и единственное с положительным кислородным балансом. Нитрогликоль C2H4(ONO2)2 - прозрачная жидкость с удельным весом 1,5 г/см3. Затвердевает при –20°С. В смеси с нитроглицерином образует растворы, имеющие температуру затвердевания от –17°С до –23°С. Химически стоек; теплота взрыва 7120 кДж/кг, скорость детонации 7,4 км/с; работоспособность 600 см3. При работе с нитрогликолем нужна особая осторожность – недопустим контакт открытых поверхностей тела. Области применения такие же, как и у нитроглицерина.
В табл.5 приведены технологические характеристики некоторых ВВ. Таблица 5
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-26; просмотров: 419; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.225.175.230 (0.01 с.) |