Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Механизмы возникновения первичной фармакологической реакции. Природа рецепторов.Содержание книги
Поиск на нашем сайте
Соотношение между концентрацией лекарственного вещества И его фармакологическим эффектом Таблица 1. Различия между градуальной и квантовой кривыми «доза-эффект»
Широта терапевтического действия. Терапевтический индекс. Терапевтический коридор.
Если после того, как достигается плато эффекта доза лекарства будет продолжать расти, то через определенный промежуток времени начнет проявляться токсическое действие лекарства. Зависимость токсического действия от дозы (концентрации) лекарства носит такой же характер, как и его полезный эффект и может быть описана градуальной или квантовой кривыми. На этих кривых также может быть определена величина TD50 или ТС50 – токсической дозы (концентрации) лекарства, которая вызывает токсический эффект, равный 50% от максимального (для квантовой кривой – токсический эффект у 50% лиц в популяции). Иногда, вместо TD50 пользуются показателем LD50 – летальная доза, которая вызывает гибель 50% объектов в популяции. Информация относительного токсического потенциала лекарства позволяет дать характеристику его безопасности. Основными критериями безопасности являются: º Терапевтический индекс – это соотношение между токсической и эффективной дозами лекарства, которые вызывают появление полумаксимального эффекта. ТИ=TD50/ED50. Чем больше величина терапевтического индекса, тем более безопасным является лекарство. Например, на схеме 6 величина ED50»6 мг, а LD50»210 мг и ТИ=210/6=35. Пенициллин является лекарством у которого величина терапевтического индекса составляет более 100, а дигоксин имеет терапевтический индекс равный всего лишь 2. Таким образом, фактически терапевтический индекс определяет расстояние между точками ED50 и TD50 на кривых «доза-эффект». При этом мы исходим из допущения о том, что сами кривые имеют одинаковый наклон и характер нарастания эффекта, а также, что токсическое действие лекарства проявляется позже его терапевтического эффекта. К сожалению, достаточно часто характер кривых терапевтического и токсического действия лекарства будет различаться. º Терапевтическая широта (терапевтическое окно) – это диапазон доз между минимальной терапевтической и минимальной токсической дозами лекарства (ТШ=TD10/ED10). Терапевтическая широта более корректный показатель безопасности лекарства, поскольку он позволяет учитывать степень нарастания нежелательных эффектов на кривой «доза-эффект». Например, на схеме 8 показано лекарственное средство, у которого фармакологическое действие проявляется в виде быстро нарастающего эффекта в ответ на незначительное повышение дозы. Токсическое действие у него, напротив, имеет вид плавно нарастающей кривой. В данном случае величина терапевтического индекса составляет около 10, но благодаря тому, что токсические эффекты нарастают медленно и одновременно с терапевтическим действием 15% эффект лекарства возникает одновременно с развитием отравления у 15% пациентов. Т.е. терапевтическая широта у данного средства отсутствует и его полезное действие возникает одновременно с токсическим. º Фактор надежной безопасности – это отношение минимальной токсической дозы к максимальной эффективной (ФНБ=TD1/ED99). Фактически, данный критерий представляет собой несколько модифицированную форму терапевтической широты и показывает: во сколько раз может быть превышена терапевтическая доза лекарства без риска развития интоксикации (нежелательных эффектов). º Терапевтический коридор – это диапазон эффективных концентраций лекарственного вещества в крови, которые необходимо создать и поддерживать в организме, чтобы обеспечить достижение желаемого терапевтического действия. Таблица 2. Сравнительная характеристика конкурентного и неконкурентного антагонистов
Конкурентным антагонистом в отношении АТ1-рецепторов ангиотензина является лозартан, он нарушает взаимодействие ангиотензина II с рецепторами и способствует снижению артериального давления. Действие лозартана можно преодолеть, если ввести высокую дозу ангиотензина II. Неконкурентным антагонистом в отношении этих же АТ1-рецепторов является валсартан. Его действие нельзя преодолеть даже при введении высоких доз ангиотензина II. Интересным является взаимодействие, которое имеет место между полным и парциальным агонистами рецепторов. Если концентрация полного агониста превышает уровень парциального, то в ткани наблюдается максимальный ответ. Если уровень парциального агониста начинает повышаться, он вытесняет полный агонист из связи с рецептором и ответ ткани начинает уменьшаться от максимального для полного агониста, до максимального для парциального агониста (т.е. такого уровня, при котором он займет все рецепторы). Данная ситуация представлена на схеме 9С. · Физиологический (непрямой) антагонизм – антагонизм, связанный с влиянием 2 лекарственных веществ на различные рецепторы (мишени) в тканях, что приводит к взаимному ослаблению их эффекта. Например, физиологический антагонизм наблюдается между инсулином и адреналином. Инсулин активирует инсулиновые рецепторы в результате чего увеличивается транспорт глюкозы в клетку и уровень гликемии понижается. Адреналин активирует b2-адренорецепторы печени, скелетных мышц и стимулирует распад гликогена, что в итоге приводит к повышению уровня глюкозы. Данный вид антагонизма часто используется при оказании неотложной помощи пациентам с передозировкой инсулина, которая привела к гипогликемической коме. РЕАКЦИИ ТИПА В Аллергические реакции (реакции гиперчувствительности). Это группа реакций, связанная с гиперактивацией иммунной системы. Они не зависят от вида лекарственного вещества и величины принятой дозы, протекают стереотипно (т.е. имеют универсальные проявления не зависимо от вызвавшего их лекарственного средства). У чувствительных лиц аллергическую реакцию могут вызвать ничтожные дозы лекарства (запах пенициллина в процедурном кабинете может привести к развитию анафилактического шока у пациента с аллергией к нему), тогда как у лиц без аллергической сенсибилизации введение даже значительных доз лекарства не способно вызвать такую реакцию. Для проявления аллергической реакции необходима предварительная сенсибилизация организма, поэтому после первого контакта организма с лекарством-аллергеном латентный период может продолжаться по меньшей мере 1-2 недели (за это время иммунные клетки синтезируют антитела). Только вторичный контакт с аллергеном вызовет развитие аллергической реакции. В роли антигенов, вызывающих аллергию могут выступать лекарства-белки (стрептокиназа, инсулин). Большинство же лекарств является гаптенами (неполными антигенами). Они приобретают антигенные свойства лишь после того, как соединяться с белком (например, белком плазмы крови). Для развития аллергической реакции совсем не обязательно наличие антител к данному лекарству. Химически родственные лекарственные средства могут вызывать перекрестные аллергические реакции. Выделяют 4 типа аллергических реакций: ] Тип I – аллергические реакции немедленного типа, анафилактические реакции. Связаны с образованием реагиновых антител (IgE), которые фиксируются на поверхности тучных клеток. При повторном воздействии лекарства оно активирует антитела и вызывает выброс из тучных клеток биологически активных веществ – гистамина, серотонина, лейкотриенов и простагландинов. Аллергическая реакция проявляется через несколько минут и продолжается 1-2 часа. Примерами реакций такого типа является анафилактический шок, ангионевротический отек Квинке, крапивница, бронхиальная астма. ] Тип II – цитолитические реакции. Антигенное лекарство образует комплекс с белками на поверхности клеток. К этому комплексу вырабатываются антитела. Антитела связывают комплексы белок-лекарство и активируют систему комплемента, который повреждает мембрану клеток и вызывает их гибель. Примерами реакций этого типа является тромбоцитопения, агранулоцитоз и гемолитическая анемия после приема некоторых лекарств. ] Тип III – иммунокомплексные реакции. Лекарство-антиген и антитело образуют циркулирующие иммунные комплексы. Эти крупномолекулярные комплексы могут фиксироваться к стенкам мельчайших капилляров легких, почек, кожи и привлекать к ним фагоциты. Фагоциты, поглощая комплексы вырабатывают ряд ферментов, повреждающих ткань. Примерами реакций такого типа является развитие сыпей, сывороточной болезни (лихорадка, артралгии, лимфаденопатии), васкулитов и нефритов после приема лекарства. ] Тип IV – клеточно-опосредованная реакция замедленного типа. Связана с появлением на Т-лимфоцитах антиген-специфических рецепторов. Такие лимфоциты называются сенсибилизированными. При поступлении антигена (лекарства) Т-лимфоциты выделяют лимфокины, которые привлекают в очаг фагоциты, лимфоциты и запускают воспалительную реакцию. Примерами реакций этого типа являются контактный дерматит и фотосенсибилизация при приеме лекарства. Идиосинкразия – качественно измененная необычная реакция на лекарственное средство, обусловленная, как правило, генетическими аномалиями. Наиболее ярким примером идиосинкразии является злокачественная гипертермия, которая возникает после применения галота (средство для наркоза) или сукцинилхолина (миорелаксант) у 1 человека из каждых 20.000. Реакция связана с аутосомно-доминантным дефектом строения саркоплазматического ретикулума в мышцах. При введении указанных выше лекарств у пациента происходит массивный выброс ионов кальция из депо в цитоплазму мышечного волокна, развиваются клонические судороги и повышается температура тела (за счет усиления термогенеза). РЕАКЦИИ ТИПА С Кумуляция (от лат. cumulatio – увеличение, скопление) – повышение интенсивности ответной реакции организма на повторное введение лекарства. Различают 2 вида кумуляции: ] Материальная кумуляция – связана с накоплением в организме молекул лекарства, если оно вводится со скоростью большей, чем скорость элиминации этого лекарства. Наиболее характерен этот вид кумуляции для высоколипофильных веществ, которые имеют низкую скорость элиминации (сердечные гликозиды, барбитуровые препараты, амиодарон). Материальная кумуляция имеет как свои положительные, так и отрицательные стороны. Лекарственные средства, способные к кумуляции имеют длительное действие, поэтому их можно применять нечасто и это удобно для пациента. Однако, за счет кумуляциилекарства достаточно высок риск развития интоксикации, если уровень лекарства в организме превысит токсический порог. ] Функциональная кумуляция – связана с тем, что фармакологический эффект лекарства сохраняется в организме больший период времени, чем само это лекарство. При повторном введении такого лекарства суммируются не его количества в организме, а эффекты этого лекарства. Функциональная кумуляция характерна для лекарственных средств, которые оказывают необратимое воздействие на субстрат. Например, тиклопидин быстро инактивируется в воротной вене кишечника, но при этом он успевает необратимо изменить мембрану эритроцитов, которые находятся в крови этой вены. При повторных введениях тиклопидина его эффекты суммируются, т.е. все большее и большее число эритроцитов подвергается необратимой модификации и реологические свойства крови улучшаются. Толерантность (привыкание). Толерантность представляет собой эффект обратный кумуляции. Под толерантностью понимают снижение ответной реакции организма на повторные введения лекарственного средства. Для того, чтобы восстановить реакцию на лекарство его приходится вводить во все бóльших и бóльших дозах. Так, например, обычная доза диазепама для лечения фобий (тревожных неврозов) составляет 5-10 мг/сут, на фоне развития толерантности при длительном приеме она может составлять до 1000 мг/сут. Различают 2 вида толерантности: [ Истинная толерантность – наблюдается как при энтеральном, так и при парентеральном введении лекарства, она не зависит от степени его всасывания в кровоток. В основе истинной толерантности лежат, как правило, фармакодинамические механизмы привыкания: § Десенситизация – снижение чувствительности рецептора к лекарственному средству. Например, b-адреномиметики при длительном применении приводят к фосфорилированию b-адренорецепторов и фосфорилированные рецепторы не способны ответить на b-адреномиметики. § Down-регуляция – снижение числа рецепторов к лекарственному средству. Например, при повторных введениях наркотических анальгетиков количество опиоидных рецепторов снижается и требуются все бóльшие и бóльшие дозы лекарства, чтобы вызвать желаемый ответ. Если лекарственное средство блокирует рецепторы, то механизм толерантности к нему может быть связан с up-регуляцией – увеличением числа рецепторов к лекарственному средству. Например, при длительном приеме b-адреноблокаторов число b-адренорецепторов на поверхности клеток начинает компенсаторно увеличиваться за счет синтеза новых молекул и требуются все более высокие дозы лекарства, чтобы блокировать новые рецепторы. § Включение компенсаторных механизмов регуляции. Например, при первом введении гипотензивного средства нифедипина у пациента может развиться ортостатический коллапс (резкое падение артериального давления). Однако, при последующих введениях барорефлексы адаптируются к способности лекарства расширять сосуды и не допускают падения артериального давления ниже уровня, необходимого для кровоснабжения мозга. Истинная толерантность может носить не только приобретенный, но и врожденный характер. Так, например, афро-американцы обладают врожденной толерантностью к b-адреноблокаторам и ингибиторам АПФ, а европейцы – к a-адреноблокирующим средствам. [ Относительная толерантность (псевдотолерантность). Этот вид толерантности развивается только при введении лекарства внутрь и связан со снижением скорости и полноты всасывания лекарства. Данный вид толерантности искусственно вырабатывали в древние века лица, которые боялись быть отравленными. Наиболее показателен пример Митридата Великого (ок. 132-63 гг до н.э.) царя Понта Эвксийского. Отравив свою мать он достиг вершины власти, но при этом сам стал панически бояться быть отравленным соперниками. В течение многих лет он принимал внутрь в небольших дозах различные яды и наконец, потерял к ним восприимчивость. Когда Понт был завоеван Цезарем Митридат, чтобы избежать позорного пленения пытался покончить с собой и просил вначале сына, а затем жену дать ему яд. Но его организм не воспринимал яд и, наконец, царю пришлось просить раба, чтобы тот заколол его. Данный пример толерантности связан с тем, что яд не абсорбировался в кишечнике Митридата, но если бы ему была введена даже ничтожная доля яда парентерально, он, несомненно бы, погиб. Тахифилаксия (от греч. tachys – быстрый, phylaxis – бдительность, охрана) – состояние при котором часто введение лекарственного средства вызывает развитие толерантности уже через несколько часов, но при достаточно редких введениях лекарства его эффект сохраняется в полной мере. Развитие толерантности связано обычно с истощением эффекторных систем. Например, действие симпатомиметика эфедрина связано с вытеснением норадреналина из окончаний симпатических нервов. Если эфедрин вводят слишком часто, то запас норадреналина в окончаниях не успевает возобновиться и тахифилаксия развивается уже через 3-5 введений эфедрина. Лекарственная зависимость. «То, что человечество в целом будет когда-либо обходиться без искусственного рая, маловероятно. Большинство мужчин и женщин ведут такую тягостную жизнь, которая в лучшем случае так монотонна, убога и ограничена, что желание «уйти» от нее, отключиться хотя бы на несколько мгновений, есть и всегда было одним из основных желаний души». Эта мысль была высказана A. Huxley в его работе «The Doors of Perception» и до сих пор именно она выражает всю суть существования проблемы лекарственной зависимости. Лекарственная зависимость – состояние психики и/или физическое состояние, которое является следствием воздействия на организм лекарственного средства и характеризуется специфическими поведенческими реакциями, трудно преодолимым стремлением повторно принимать лекарство, чтобы добиться особого психического эффекта или избежать дискомфорта при отсутствии лекарства в организме. Лекарственная зависимость характеризуется: º Психологической зависимостью – развитием эмоционального дистресса при прекращении приема лекарства. Человек ощущает себя опустошенным, погружается в депрессию, испытывает чувство страха, тревоги, его поведение становится агрессивным. Все эти психопатологические симптомы возникают на фоне мыслей о необходимости ввести себе лекарство, вызвавшее зависимость. Стремление к приему лекарства может колебаться от простого желания до страстной жажды приема лекарства, которая поглощает все остальные потребности и превращается в смысл жизни человека. Считают, что психологическая зависимость развивается тогда, когда у человека появляется сознание того, что оптимального самочувствия он может достигнуть исключительно благодаря введению лекарственного средства. Основой психологической зависимости является вера человека в действие лекарства. Косвенно это подтверждается тем, что в литературе описаны случаи развития психологической зависимости к плацебо (неактивным таблеткам, инъекциям дистиллированной воды). º Физической зависимостью. Физической зависимостью называют нарушение нормального физиологического состояния организма, которое требует постоянного присутствия в нем лекарства для поддержания состояния физиологического равновесия. Прекращение приема лекарства вызывает развитие специфического симптомокомплекса получившего название абстинентного синдрома (от лат. abstinentia – воздержание). Абстинентный синдром – комплекс психических и нейровегетативных расстройств в виде нарушения функции в сторону, противоположную той, которая характерна для действия лекарства. Например: морфин устраняет боль, угнетает дыхательный центр, суживает зрачки, вызывает запор; при абстиненции у пациента возникают мучительные боли, частое шумное дыхание, зрачки расширены и развивается упорная диарея. º Толерантностью. Толерантность к средствам, вызывающим лекарственную зависимость зачастую носит перекрестный характер, т.е. возникает не только к данному химическому соединению, но и ко всем структурно подобным соединениям. Например, у пациентов с лекарственной зависимостью к морфину толерантность возникает не только к нему, но и к другим опиоидным анальгетикам. Для развития лекарственной зависимости наличие всех 3 критериев не является необходимым условием, в таблице 3 представлены основные виды лекарственной зависимости и составляющие ее компоненты. Таблица 3. Основные психоактивные вещества, способные вызывать зависимость
Примечание: 0 – данного эффекта не наблюдается; +-++++ - наличие эффекта от слабовыраженного до сильновыраженного От лекарственной зависимости следует отличать несколько близких по смыслу понятий: ] Наркомания (наркотическая зависимость) – это компульсивное применение лекарственного средства, характеризующееся все возрастающим, непреодолимым влечением к введению данного лекарства все увеличивая его дозы. Компульсивность влечения означает, что потребность во введении лекарства доминирует у пациента над всеми другими (даже витальными) потребностями. Таким образом, наркомания – это крайне тяжелая форма лекарственной зависимости. С позиций данного определения, влечение к морфину – наркомания, тогда как влечение к никотину – лекарственная зависимость. ] Пристрастие к лекарству. Это понятие характеризует менее интенсивное влечение к приему лекарств, когда отказ от лекарства вызывает только ощущение легкого дискомфорта, без развития физической зависимости или развернутой картины психологической зависимости. Т.о. пристрастие охватывает ту часть лекарственной зависимости, которая не подпадает под определение наркомании. Например, упомянутая выше лекарственная зависимость к никотину – форма пристрастия. ] Злоупотребление лекарственными средствами – самовольное применение лекарственных средств в таких дозах и такими способами, которые отличаются от принятых медицинских или социальных стандартов в данной культуре и в данное время. Т.о. злоупотребление лекарственными средствами охватывает только социальные аспекты применения лекарств. Примером злоупотребления является использование анаболических стероидов в спорте или для улучшения телосложения молодыми мужчинами. Лечение лекарственной зависимости трудная и неблагодарная задача. До сих пор не создано эффективной методики, которая бы обеспечивала бы успех лечения более чем у 30-40% пациентов. Достижение сколько-нибудь заметных результатов возможно только при полной кооперации усилий пациента, врача и того социального окружения, в котором находится заболевший. В основе современных методик лежат следующие принципы: · психотерапевтические и трудотерапевтические методы; · групповое лечение и реабилитация (общества анонимных алкоголиков, наркоманов); · постепенная или резкая отмена препарата на фоне детоксикационной терапии; · проведение заместительной терапии (замена наркотического средства медленно и длительнодействующими аналогами с их последующей отменой; например, т.н. программа метадоновой заместительной терапии у героиновых наркоманов); · лечение специфическими антагонистами (налоксоном и налтрексоном) или сенсибилизирующими средствами (тетурамом); · нейрохирургический методы криодеструкции поясной извилины и гиппокампа. РЕАКЦИИ ТИПА D. Тератогенность (от греч. teratos – монстр, чудовище) – способность лекарства при назначении его беременной женщине вызывать анатомические аномалии развития плода. Лекарственное средство способно вызвать нарушения развития ребенка на любой из 3 стадий: · Оплодотворения и имплантации (первые 17 дней беременности) – в эту стадию может произойти нарушение беременности, которое закончится выкидышем. · Органогенеза (18-55 дни гестации) – наиболее уязвимый период, его нарушение вызывает одни из самых тяжелых уродств. · Роста и развития (после 56 дня беременности) – в этот период редко возникают системные аномалии. Чаще всего нарушения проявляются в виде поражений части органа (пороки сердца, атрезия анального отверстия) или различные функциональные нарушения. В таблице 4 перечислены наиболее часто используемые лекарственные средства, способные оказать тератогенное действие. Канцерогенность – способность лекарства вызывать опухолевую трансформацию соматических клеток. Механизмы канцерогенеза чрезвычайно сложны, но могут быть объединены в 3 группы: · Изменение в структуре ДНК под влиянием лекарства. Данный механизм возможен у алкилирующих противоопухолевых средств, антибиотика гризеофульвина. · Угнетение иммунной системы (в норме иммунная система отслеживает возникновение злокачественных клеток и обеспечивает их уничтожение). · Изменение гормонального фона. Нарушение естественного гормонального фона служит толчком для развития опухолевого роста в гормонзависимых тканях. Таблица 4. Лекарственные средства, оказывающие тератогенный эффект у человека.
Мутагенность – способность лекарственного средства вызывать дефекты генетической информации в генеративных клетках человека и передавать эти изменения по наследству. РЕАКЦИИ ТИПА Е Синдром «рикошета» (синдром отдачи, rebound syndrome) – состояние, обусловленное растормаживанием регуляторных процессов или реакций после отмены лекарства, которое их подавляло. Таким образом, синдром «рикошета» можно сравнить с обострением заболевания после отмены лекарственного средства. Чаще всего синдром «рикошета» наблюдается после отмены средств, оказывающих на организм угнетающее воздействие. Например, при длительном лечении стенокардии b-адреноблокаторами в миокарде образуются все новые и новые молекулы b-адренорецепторов. Если b-адреноблокатор внезапно отменить, то ранее существовавшие и новые b-адренорецепторы освобождаются и подвергаются атаке норадреналином и адреналином. В результате частота приступов стенокардии резко возрастает. Таблица 5. Лекарственные средства, вызывающие синдром «рикошета».
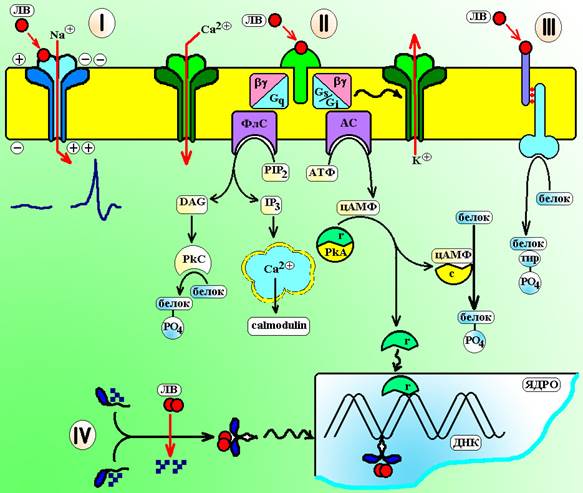
Синдром отмены – недостаточность функции органов и тканей после прекращения введения лекарственного средства, замещающего эту функцию. Синдром отмены возникает при прекращении приема глюкокортикостероидов и проявляется недостаточностью коры надпочечников. Причины этого заключаются в том, что глюкокортикостероиды создают высокие концентрации гормонов в крови и по принципу отрицательной обратной связи тормозят секрецию АКТГ гипофизом. Кора надпочечников перестает получать стимулы и подвергается атрофии. При внезапной отмене экзогенных глюкокортикостероидов в организме не может быть обеспечен достаточный синтез эндогенных гормонов. Механизмы возникновения первичной фармакологической реакции. Природа рецепторов. Как уже упоминалось, механизм действия лекарственных средств связан с их влиянием на биологические субстраты клетки, которое приводит к развитию фармакологического эффекта. Роль таких биологических субстратов могут выполнять: · Молекулы неорганических веществ – ионы железа для дефероксамина, соляная кислота для гидроокиси алюминия, молекулы воды для наркотических газов; · Структурные белки клетки – колхицин, мебендазол воздействуют на белок тубулин, который формирует микротрубочки; · Белки-ферменты – каптоприл блокирует ангиотензин-превращающий фермент; · Транспортные белки – сердечные гликозиды нарушают работу Na+/K+-АТФазы; · Нуклеиновые кислоты – ряд противоопухолевых средств изменяет структуру ДНК клетки. Наиболее важным является взаимодействие лекарственного вещества с особыми регуляторными молекулами клетки – рецепторами для нейромедиаторов, гормонов и других биологически активных веществ. Рецептор (лат. recipere – получать) – специфические молекулярные компоненты клетки, которые при взаимодействии с лигандами подвергаются конформационным изменениям и за счет воздействия на эффекторные системы клетки изменяют функции ткани и органа в целом. От рецепторов следует отличать места инертного связывания – молекулярные компоненты с которыми могут взаимодействовать биологически активные вещества, не вызывая их конформационных изменений и передачи сигнала на эффекторные системы. Например, эстрогены взаимодействуя с эстрогеновыми рецепторами вызывают изменение транскрипции генов. В то же время, эстрогены могут связываться с секс-глобулином в плазме крови (транспортный белок) но это не приводит к какому-либо биологическому эффекту, поэтому в данном случае секс-глобулин – инертное место связывания для стероидов. В клетке различают 4 типа рецепторов: три из них являются мембранными (т.е. встроены в мембраны клеток) и один тип – цитоплазматическим (см. схему 1). · Трансмембранные рецепторы, связанные с ионными каналами. Представляют собой белки, которые формируют в мембране ионный канал. При взаимодействии лиганда с рецепторной субъединицей белка проницаемость ионного канала меняется. К данной группе рецепторов относят: ] Н-холинорецепторы, связанные с Na+-каналами. При взаимодействии с ацетилхолином рецептор открывает натриевый канал и под влиянием тока ионов натрия в клетку возникает деполяризация мембраны и генерируется потенциал действия. ] ГАМКА-рецепторы, которые связаны с Cl--каналами. При взаимодействии с g-аминомасляной кислотой рецептор открывает канал и обеспечивает поступление в клетку ионов хлора. Возникает гиперполяризация мембраны и переход ее в состояние покоя. · Трансмембранные рецепторы, связанные с G-белками. Эти рецепторы состоят из 3 субъединиц. Рецепторный белок располагается на наружной стороне мембраны. При взаимодействии с лигандом он передает сигнал на внутримембранный G-белок, который за счет энергии ГТФ перемещается к внутренней стороне мембраны и изменяет активность эффекторных белков. Эффекторные белки расположены на внутренней стороне мембраны и представляют собой ферменты, которые образуют «вторичные мессенджеры» – молекулы-посредники, которые передают сигнал в клетку и вызывают развитие ответной реакции. В качестве эффекторных белков выступают: ] Аденилатциклаза – это фермент, который гидролизует АТФ с образованием циклического АМФ (цАМФ). Молекула цАМФ в цитоплазме клетки связывается с зависимой от нее протеинкиназой А (PkA). При этом молекула протеинкиназы распадается на 2 фрагмента: рецепторная субъединица PkA вместе с цАМф поступает в ядро клетки и влияет на транскрипцию генов, а каталитическая субъединица PkA остается в цитоплазме и обеспечивает фосфорилирование белков. Работу аденилатциклазы через Gs-белок стимулируют b-адренорецепторы, Н2-гистаминовые рецепторы, D1-дофаминовые рецепторы. Через Gi-белок работу аденилатциклазы тормозят a2-адренорецепторы, М2-холинорецепторы, m-опиоидные рецепторы. ] Гуанилатциклаза – это фермент, который гидролизует ГТФ с образованием цГМФ. Молекула цГМФ активирует в клетке цГМФ-зависимые протеинкиназы, которые также фосфорилируют белки. С гуанилатциклазой связаны рецепторы предсердного натрийуретического пептида. ] Фосфолипаза С – это фермент, который обеспечивает гидролиз фосфатидилинозитол бифосфата (PIP2) до инозитол-трифосфата (IP3) и диацилглицерола (DAG). IP3 воздействует на внутриклеточные кальций-депонирующие органелы, а DAG обеспечивает активацию протеинкиназы С (PkC), которая обеспечивает фосфорилирование внутриклеточных белков. С фосфолипазой С связаны через Gq-белок a1-адренорецепторы, М1 и М3-холинорецепторы, Н1-гистаминовые рецепторы.
Схема 1. Типы циторецепторов. I – трансмембранные рецепторы, связанные с ионным каналом, II – трансмембранные рецепторы, связанные с G-белками, III – трансмембранные рецепторы с ферментативной активностью, IV – цитозильные рецепторы. ЛВ – лекарственное вещество, ФлС – фосфолипаза С, АС – аденилатциклаза, PIP2 – фосфатидил бифосфат, IP3 – инозитол трифосфат, DAG – диацилглицерол, PkC – протеинкиназа С, PkA – протеинкиназа А (r – рецепторная субъединица, с – каталитическая субъединица), тир – остатки тирозина в молекуле белка. · Трансмембранные рецепторы-ферменты. Данный вид рецепторов представлен молекулами, состоящими из 2 субъединиц. Рецепторная субъединица располагается с наружной стороны мембраны, а каталитическая (т.е. обладающая ферментативногй активностью) – прошивает мембрану клетки насквозь. При взаимодействии с лигандом рецепторная субъединица активирует каталитическую часть молекулы. В качестве каталитической субъединицы выступают: ] Тирозинкиназы – ферменты, которые фосфорилируют остатки тирозина в молекулах белков. К т
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-19; просмотров: 286; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.156.26 (0.012 с.) |

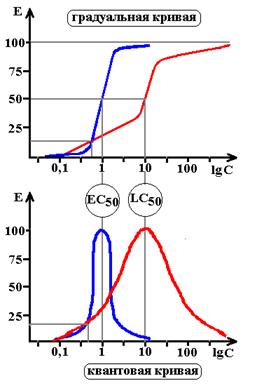 Схема 8. Терапевтический индекс и широта действия. Терапевтический эффект лекарства проявляется с высокой скоростью и EC50=1, токсические эффекты нарастают медленно, при этом LC50=10. Несмотря на то, что ТИ=10/1=10, терапевтическая широта равна нулю, т.к. TD15=LD15=0,6
Схема 8. Терапевтический индекс и широта действия. Терапевтический эффект лекарства проявляется с высокой скоростью и EC50=1, токсические эффекты нарастают медленно, при этом LC50=10. Несмотря на то, что ТИ=10/1=10, терапевтическая широта равна нулю, т.к. TD15=LD15=0,6