Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Физические и химические свойства серыСодержание книги
Поиск на нашем сайте
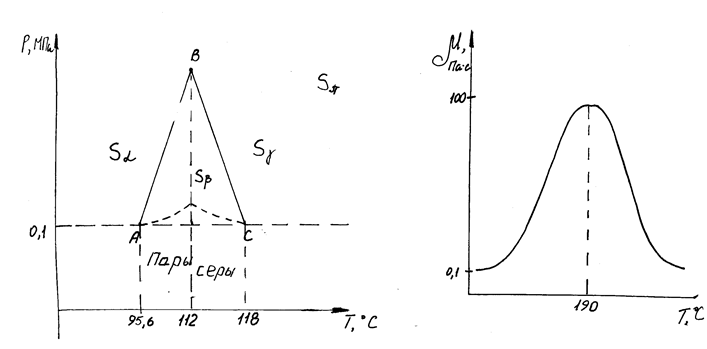
У звичайних умовах сірка S - жовті тендітні кристали без смаку і запаху, легко розчинні в сірковуглеці CS2.Кристалічні ґрати сірки - молекулярна, у вузлах ґрат знаходяться молекули S8 (неплоскі цикли типу "корона"). Рідка сірка складається з молекул S8 і ланцюгів різної довжини, у парах сірки містяться молекули S8, S6, S4 і S2, при 1500 °С з'являється одноатомна сірка (у хімічних рівняннях для простоти будь-яка сірка зображується як S). Не розчиняється у воді і при звичайних умовах не реагує з нею.
молекула сірки Фізичні константи: Mr = 32,066;ρ = 2,07 г/см3 (ромбічна),1,96 г/см3 (моноклінна),tпл = 119,3 °C,tкип = 444,674 °C. Сірка має високу активність при нагріванні. Реагує як окислювач з металами і неметалами: S + Na = Na2S Подвергается дисмутации в растворах щелочей: Фізичні властивості Сірка — кристалічна речовина жовтого кольору. Вона дуже крихка і легко розтирається в дрібнесенький порошок. Зустрічається в трьох алотропних формах: дві кристалічні (ромбовидна і моноклінічна, за способом сполучення атомів у кристалі) і аморфна. Електричного струму і тепла майже не проводить. Плавиться при 112,8°С, кипить при 444,6°С. Пари сірки при дуже швидкому охолодженні переходять у твердий стан у вигляді дуже тонкого порошку (сіркового цвіту), минаючи рідкий стан. У воді сірка не розчиняється і не змочується водою, але в бензолі C6H6 і особливо в сірковуглеці CS2 розчиняється добре. Хімічні властивості Сірка належить до головної підгрупи шостої групи періодичної системи Менделєєва. Порядковий номер її 16. Маючи в зовнішньому шарі шість електронів: (+ 16), 2,8,6 — атоми сірки проявляють властивості окисника і, приєднуючи від атомів Інших елементів два недостаючі їм електрони, перетворюються в негативно двовалентні іони: S0 + 2е = S2-. Але сірка — менш активний окисник, ніж кисень, оскільки її валентні електрони більш віддалені від ядра атома і слабіше з ним зв'язані, ніж валентні електрони атомів кисню. На відміну від кисню сірка може проявляти властивості і відновника: S0 — 6e = S6+ або S0 — 4e = S4+. Відновні властивості сірки виявляються при взаємодії її з сильнішим від неї окисником, тобто з речовинами, атоми яких мають більшу силу до прилучення електронів. Сірка може безпосередньо реагувати майже з усіма металами (за винятком благородних), але переважно при нагріванні. Так, якщо суміш порошків сірки й заліза нагріти хоч в одному місці, щоб почалася реакція, то далі уся суміш сама собою розжариться (за рахунок теплоти реакції) і перетвориться в чорну крихку речовину — моносульфід заліза: Fe + S = FeS Суміш порошків сірки й цинку при підпаленні реагує дуже бурхливо, із спалахом. Внаслідок реакції утворюється сульфід цинку: Zn + S = ZnS Із ртуттю сірка реагує навіть при звичайній температурі. Так, при розтиранні ртуті з порошком сірки виникає чорна речовина — сульфід ртуті: Hg + S = HgS При високій температурі сірка реагує також з воднем з утворенням сірководню: H2 + S = H2S При взаємодії з металами і воднем сірка відіграє роль окисника, а сама відновлюється до іонів S2- Тому в усіх сульфідах сірка негативно двовалентна. Сірка порівняно легко реагує і з киснем. Так, підпалена сірка горить на повітрі з утворенням діоксиду сірки SO2 (сульфітного ангідриду) і в дуже незначній кількості триоксиду сірки SO3 (сульфатного ангідриду). S + O2 = SO2 2S + 3O2 = 2SO3 При цьому окисником є кисень, а сірка — відновником. У першій реакції атом сірки втрачає чотири, а в другій — шість валентних електронів, внаслідок чого сірка в сполуці SO2 позитивно чотиривалентна, а в SO3 — позитивно шестивалентна. Сірка не змочується водою, не розчиняється у воді. Звязок S-S по міцності поступається лише С-С. Є такі модифікації Sγ(моноклінна, складається з 6 циклів), Sβ (моноклінна, складається з 8 циклів), Sα (орторомбічна модифікація, складається з 16циклооктосірок, які звязані Вандерваальськими силами). Sα починає переходити в Sβ при 112 С. Sλ – складається з всіх модифікацій, в т.ч. з Sω (полімерної сірки). Є дві модифікації полімерної сірки: Sω і Sμ. Нерозчиняється навіть в каучуку. Одержуємо нагріваючи а потім різко охолоджуючи. Від відстані між спіралями залежить, яка є модифікація Sω чи Sμ.
|
||||
|
Последнее изменение этой страницы: 2017-01-19; просмотров: 104; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.17.181.112 (0.009 с.) |