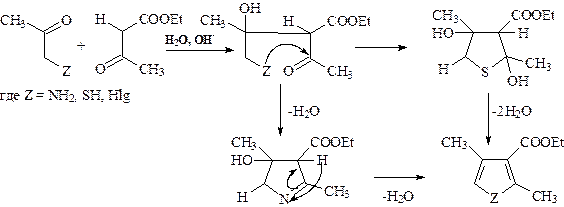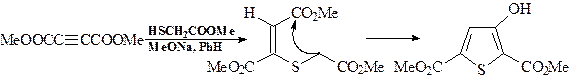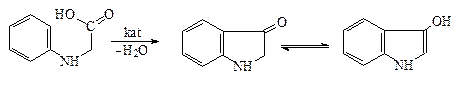Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Синтез гетероциклических соединений по «схеме в»
Схема В предполагает образование С – С и С – Х связей при циклизации соединений. При этом связь С – С образуется в результате альдольной, кротоновой и сложноэфирной конденсаций, а также при С алкилировании ароматических и алифатических соединений. Если арены С – алкилируются практически все, то среди алифатических соединений С – алкилируются в основном 1,3-дикарбонильные соединения и им аналогичные соединения с активированной С – Н связью, такие как, МЭ, АУЭ, ЭЭЦУК и некоторые другие. В связи с этим при синтезе гетероциклов по рассматриваемой схеме чаще всего используются эти соединения, а также альдегиды, кетоны и сложные эфиры с a-С – Н связью. 1. Синтез пятичленных гетероциклических соединений с одним гетероатомом из 1,3-дикарбонильных соединений (чаще всего АУЭ) и a-галоген-, амино-, меркаптокарбонильных соединений (с интезы Кнорра, Ганча, Фейста-Бенари ). В случае амино- и меркаптокарбонильных (чаще всего эфиры меркаптоуксусной кислоты) соединений реакция идет через стадию альдольной конденсации с последующим образованием иминов или тиоацеталей и ароматизацией.
Выход целевых продуктов реакций с участием a-галогенкарбо-нильных соединений по этому механизму небольшой (тиофена около 50%, фурана – 10%). В связи с этим её проводят в таких условиях, чтобы она начиналась не с альдольной конденсации, а с С-алкилирования 1,3-дикарбонильного соединения.
В результате образуется 1,4-дикарбонильное соединение, которое, как показано ранее, циклизуется с образованием фурана, пиррола (в присутствии аммиака) или тиофена (в присутствии сульфидов фосфора). 2. Синтез производных тиофена н уклеофильным присоединением меркаптогруппы по тройной связи с последующей сложноэфирной конденсацией Кляйзена, как и в случае схемы А, более предпочтителен и позволяет получать тиофен с выходом до 94%:
Только в данном случае используется не 1,3-бутадиин, а эфир ацетилендикарбоновой кислоты. 3. Синтез производных индола (бензо[b]пиррола). Практически все синтезы производных индола включают реакции N- и С-алкилирования или/и ацилирования ароматических аминов. Реагентами могут быть ацетилен, окись этилена, a-галогенкарбонильные соединения и др. а) Синтезы индола из ариламинов и ацетилена ( метод Чичибабина), окиси этилена, a-галогенкарбонильных соединений (альдегидов, кетонов, кислот, хлорангидридов кислот и др.).
Если взять хлорацетилхлорид (синтез a-индоксила в производстве ортофена), то сначала идет ацилирование амина, а затем алкилирование бензольного кольца:
б) Метод Э.Фишера включает алкилирование и образование азометина.Циклизация идет с высоким выходом, но образуется смесь изомеров (катализатор – кислота протонная или Льюиса):
Этот метод применяют в синтезе серотонина (а) и индометацина (б):
|
|||||
|
Последнее изменение этой страницы: 2017-01-19; просмотров: 205; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.17.203.68 (0.005 с.) |