
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Этапы приготовления препаратаСтр 1 из 4Следующая ⇒
РУКОВОДСТВО ДЛЯ СТУДЕНТОВ К ПРАКТИЧЕСКИМ ЗАНЯТИЯМ ПО МИКРОБИОЛОГИИ
Государственное образовательное учреждение среднего профессионального образования «Энгельсский медицинский колледж»
А.В. Палиенко
РУКОВОДСТВО К ПРАКТИЧЕСКИМ ЗАНЯТИЯМ по курсу «Микробиология с основами эпидемиологии и методами микробиологических исследований» раздел «Морфология микроорганизмов»
Руководство для студентов отделения 060110 «Лабораторная диагностика»
г. Энгельс, 2009 г. РЕЦЕНЗИЯ на руководство к практическим занятиям по курсу «Микробиология с основами эпидемиологии и методами микробиологических исследований» раздел «Морфология микроорганизмов», составленное преподавателем микробиологии А.В. Палиенко Представленная работа составлена в соответствии Государственного стандарта и квалификационной характеристики специальности 060110 «Лабораторная диагностика». Построено в соответствии современными педагогическими и методическими требованиями. Данное руководство обеспечит самостоятельность студентов в работе на практических занятиях по микробиологии и облегчит педагогический процесс. Для эффективного усвоения материала имеются вопросы и тестовые задания для студенческого самоконтроля. По каждому занятию указан объем выполняемой практической работы. Приведенные в работе алгоритмы, рисунки, схемы помогут систематизировать и закрепить знания студентов по данной теме. В руководстве приводится микроскопический метод исследования микроорганизмов, который позволяет изучить тинкториальные и морфологические свойства микроба, степень чистоты выделенной культуры, расположение микроорганизмов в мазках, выявить структуры клетки – споры, капсулы, определить подвижность микроба, дифференцировать кислотоустойчивые бактерии. Все эти признаки необходимы для идентификации микроорганизма. С помощью этого метода можно подтвердить клинический диагноз инфекционных заболеваний. Учебное пособие предназначено для использования во время практических занятий по микробиологии раздел «Морфология микроорганизмов», а также для самостоятельной работы студентов дома.
Рецензент: Глинская Е.В., к.б.н., доцент кафедры микробиологии и физиологии растений биологического факультета СГУ им. Н.Г.Чернышевского
СОДЕРЖАНИЕ Предисловие…………………………………………………...……...5 Введение в практикум………………………………………………..6 Занятие №1……………………………………………………………8 Занятие №2……………………………………………………………16 Занятие №3……………………………………………………………19 Занятие №4……………………………………………………………22 Занятие №5…………………………………………………………....24 Занятие №6…………………………………………………………....26 Ответы на тестовые задания ………………………………………...31 Список литературы…………………………………………………..32 Приложение №1……………………………………………………....33 Приложение №2……………………………………………………....35
ПРЕДИСЛОВИЕ Лабораторные занятия проводятся в специально оборудованных помещениях, имеющих подводку электричества к каждому рабочему месту, а также раковину с водопроводной водой. Поверхность рабочих столов покрыта стеклом для лучшей дезинфекции. За каждым студентом закрепляется постоянное рабочее место, на котором должно быть оборудование, необходимое для выполнения конкретного задания, рабочая тетрадь, ручка и карандаш. Для личных вещей отводится специальное место. В начале занятия студенты знакомятся с определенным заданием, изложенным в учебном пособии, делают записи основных методик в рабочей тетради, а затем приступают к выполнению работы под наблюдением преподавателя. Результаты исследований в виде рисунков, описаний морфологии микроорганизмов заносятся в тетрадь, и работа представляется преподавателю для проверки. В связи с тем, что на практических занятиях студенты работают с живыми культурами микробов, анилиновыми красителями, химическими веществами, а также используют электрические приборы (лампы) и спиртовки, они обязаны выполнять основные правила техники безопасности (приложение №1,2). Все задания студентами выполняются самостоятельно в соответствии с задачами, поставленными в учебном пособии. Автор будет признателен за все замечания и предложения по содержанию включенного материала и совершенствованию методики обучения.
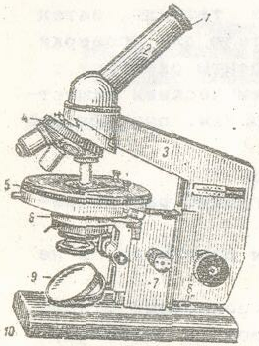
ВВЕДЕНИЕ В ПРАКТИКУМ Микроскоп (рис.1) - оптический прибор для изучения микрообъектов. Студенческие лаборатории чаще оснащены микроскопами МБИ-1. В научных и практических микробиологических лабораториях используют микроскопы отечественных марок: МБР – 1, МБИ-1, МБИ-2, МБИ-3, Биолам Р-1 и другие. Они предназначены для изучения формы, структуры, размеров и других признаков микроорганизмов, величина которых не менее 0.2-0.3 мкм. Поскольку микробы очень малы, то измеряются они в микрометрах (мкм - тысячная доля миллиметра) и потому изучение их возможно только с помощью микроскопов, дающих достаточно большое увеличение. Общее увеличение микроскопа слагается из произведения увеличений объектива и окуляра. Обычно при микробиологических исследованиях для получения полезного увеличения в 600-1000 раз используют объективы с увеличением в 90-100 раз и окуляры, увеличивающие изображение в 7-10 раз. Объективы подразделяются на сухие и иммерсионные (погруженные). При работе с сухими объективами между фронтальной линзой и изучаемым объектом находится воздух. При этом, в виду разницы коэффициентов преломления предметного стекла и воздуха, часть световых лучей отклоняется и не попадает в объектив. Объективы иммерсионные обозначают буквами О.И. и цифрами х90 и х100. Современные микроскопы имеют ряд усовершенствований. Так, бинокулярный микроскоп с двумя тубусами дает возможность вести наблюдение одновременно обоими глазами. Для изучения неокрашенных объектов используется фазово-контрастное устройство, с помощью которого можно получить четкое контрастное изображение прозрачных, не имеющих окраски микроорганизмов. При прохождении света через окрашенный препарат, изменяется интенсивность света (амплитуда световой волны), что легко улавливается глазом. При прохождении же пучка света через неокрашенный, прозрачный объект изменяется только скорость его движения, т.е. фаза колебаний светового луча, что глазом не улавливается. Принцип фазово-контрастного устройства заключается в переводе невидимых колебаний света в амплитудные видимые. В ряде специальных исследований, в частности при изучении внутриклеточных структур микроорганизмов, используется люминесцентная микроскопия, основанная на способности некоторых объектов при специальном окрашивании флюорохромами светиться в коротковолновых лучах света (ультрафиолетовых, синих и др.). К флюорохромам относятся акридиновый желтый, пиронин, акридиновый оранжевый. Люминесцентная микроскопия проводится с обычным микроскопом, снабженным источником ультрафиолетовых лучей и набором светофильтров, выделяющих коротковолновую часть спектра. Наиболее совершенными приборами, дающими возможность получать полезное увеличение объекта в 200-500 тыс. и более раз, являются электронные микроскопы, в которых вместо световых лучей используется поток электронов. С помощью электронных микроскопов удается рассмотреть белковые молекулы.
Рис. Микроскоп: 1 – окуляр, 2 – тубус, 3 – тубусодержатель, 4 – револьвер объективов, 5 – предметный столик, 6 – конденсор, 7 – микровинт, 8 – макровинт 9 – зеркало, 10 - основание
ПРАКТИЧЕСКОЕ ЗАНЯТИЕ №1 Простые и сложные методы окрашивания. Окраска препаратов по методу Грама. Способы приготовления красителей. Студент должен знать: - технику безопасности в кабинете (лаборатории) микробиологии (приложение №1), - требования к помещению и оборудованию в лаборатории (приложение №2), - характеристика «грязной» и «чистой» зоны лаборатории. Перечень комнат и их предназначение, - требования к проведению работ в бактериологической лаборатории, - спецпрофилактика сотрудникам лаборатории, - этапы приготовления препарата, его фиксация: виды и цель, - простые методы окрашивания, - сложные методы, сущность метода Грама, - особенности окраски по методу Грама, красители и реактивы, - подготовка насыщенных, водных растворов и красителей. Студент должен уметь: - доставка патологического материала. Материал на патогенные биологические агенты (ПБА), - прием материала в регистратуре, - обработка отработанного материала и лабораторной посуды, - поведение при «аварии» в лаборатории, - приготовление бактериального препарата, - окраска препарата по методу Грама, -микроскопия окрашенных препаратов с использованием иммерсионной системы, - соблюдение мер безопасной работы с живыми культурами микробов, - обработка рабочего места и рук дез. веществами.
Этапы самостоятельной аудиторной работы: 1. Подготовить препараты и окрасить их простым методом и по методу Грама 2. Препараты промикроскопировать с иммерсией 3. Обработать рабочие места и руки 4. Зарисовать результаты микроскопирования в дневник
Рецепты приготовления красителей 1. Карболовый фуксин Циля: - насыщенного спиртового раствора основного фуксина – 10 мл - раствора карболовой кислоты 5% - 90мл Внимание! Карболовую кислоту вливают в краситель, а не наоборот. Смесь встряхивают, фильтруют и сливают во флакон
Или - основной фуксин в порошке - 1 гр - карболовая кислота кристаллическая -5 гр - глицерин -0,5 мл - спирт 96% - 10 мл - вода дистиллированная - 100мл 2. Насыщенные спиртовые растворы (исходные): - красителя - 1гр - спирта 96% - 10 мл Смесь помещают в термостат на несколько дней до полного растворения. Взбалтывают ежедневно, хранят с притертыми пробками 3. Фуксин Пфейффера: - фуксин Циля – 1 мл - воды дистиллированной – 9 мл Готовят непосредственно перед употреблением, т.к. раствор нестойкий. 4. Бумага по Синеву: - 1%спиртовой раствор кристаллического фиолетового:
на 100 мл 96% спирта добавляют 1 гр сухого красителя и 3 мл глицерина Полоски фильтровальной бумаги пропитывают раствором и высушивают.
СПОСОБ ГРАМА 1. На фиксированный мазок нанести генцианвиолет (бумага по Синеву) на 1-2 мин 2. Краску слить и нанести раствор Люголя на 1 мин 3. Раствор Люголя слить и на мазок нанести 96% спирт на 15-20 мин в зависимости от толщины мазка 4. Спирт смыть дистиллированной водой 5. Мазок дополнительно окрасить разведенным фуксином Пфейффера на 2-3 мин 6. Краситель смыть водой, препарат высушить, промикроскопировать с иммерсией 7. Микроскопия с иммерсией.
Генцианвиолет связывается с пептидогликаном клеточной стенки (рис. №2). Толстый слой пептидогликана грамположительных бактерий связывает много красителя, тонкий слой – грамотрицательных – мало. Раствор Люголя фиксирует краситель за счет образования комплекса – краситель-пептидогликан-йод. При обработке мазка спиртом грамотрицательные микроорганизмы быстро теряют краситель и обесцвечиваются, а грамположительные остаются окрашенными в синий цвет. Дополнительный краситель окрашивает грамотрицательные микроорганизмы в красный цвет Грамположительные (Гр+) бактерии окрашиваются в сине-фиолетовый цвет. Грамотрицательные (Гр-) бактерии окрашиваются в красный цвет. Рис. № 2. Грамотрицательные и грамположительные бактерии
Стрептококки Гр+ Streptococcus piogenes
Стафилококки Гр+ кокки, располагающиеся в виде скоплений, напоминающих виноградную гроздь Staphylococcus aureus
Бактерии Гр- Esherichia coli
Клостридии Гр + Clostridium perfringens
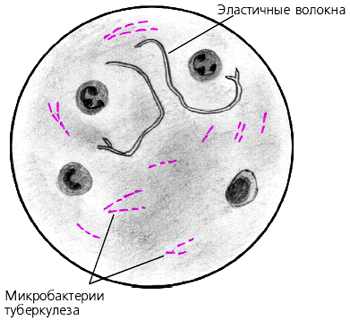
Вибрионы Гр- Vibrio cholerae ДИАГНОСТИКА ТУБЕРКУЛЕЗА МЕТОД ЦИЛЯ-НИЛЬСЕНА (ИНСТРУКЦИЯ 1999ГОД) 1. 2. Н2О 3. 25% Н2SО4 - 3 мин 4. Н2О 5. Спирт 96% - 5 мин 6. Н2О 7. Метиленовый синий 0,3 % - 1 мин 8. Н2О Рис. №4. Кислотоустойчивая микобактерия МЕТОД ЦИЛЯ-НИЛЬСЕНА 1. На фиксированный препарат + фильтровальная бумага + фуксин Циля. Подогреваем до отхождения паров + краситель (2 раза) 2. Н2О 3. 5% Н2SО4 (погружая 2-3 раза) 4. Н2О 5. Метиленовый синий 1 % - 3-5 мин 6. Н2О 7. Микроскопия с иммерсией. Кислотоустойчивые бактерии окрашиваются в красный цвет, остальные – в синий (рис. № 4,5). Рис. № 5 Mycobacterium tuberculosis в мокроте
ПРАКТИЧЕСКОЕ ЗАНЯТИЕ №3 Выявление капсул по методу Бурри, Бурри-Гинса. Студент должен иметь представления:
- негативные методы окраски. Студент должен знать: - методы микробиологических исследований, - виды микроскопии, их особенности, - строение, состав и функции капсулы, - капсулообразование как фактор патогенности, - примеры капсульных микробов, - особенности фиксации и окраски по методу Бурри и Бурри-Гинса, красители и реактивы, - цель применения и сущность метода. Студент должен уметь: - выявление капсул у бактерий методом Бурри – Гинса, -микроскопия окрашенных препаратов с использованием иммерсионной системы, - соблюдение мер безопасной работы с живыми культурами микробов, - обработка рабочего места и рук дез. веществами. Этапы самостоятельной аудиторной работы: 5. Подготовить препарат из культуры и окрасить его по методу Бурри-Гинса 6. Препараты, подготовленные и демонстрационные, промикроскопировать с иммерсией 7. Обработать рабочие места и руки 8. Зарисовать результаты микроскопирования и записать алгоритм метода в дневник
ОБНАРУЖЕНИЕ КАПСУЛ У БАКТЕРИЙ
Рис. №6. ПРИГОТОВЛЕНИЕ МАЗКА ДЛЯ ВЫЯВЛЕНИЯ КАПСУЛЫ ОКРАСКА ПО МЕТОДУ ОЖЕШКО 1. На высушенный мазок (нефиксированный!) + несколько капель 0,5% НCl, держать над пламенем спиртовки до образования паров 2. Высушивают и фиксируют физическим способом 3. Окрашивают по методу Циля-Нильсена: 1) На фиксированный препарат + фильтровальная бумага + фуксин Циля. Подогреваем до отхождения паров + краситель (2 раза) 2) Н2О 3) 5% Н2SО4 (погружая 2-3 раза) 4) Н2О 5) Метиленовый синий 1 % - 3-5 мин 6) Н2О 4. Микроскопия с иммерсией
Метод Ожешко сходен с методом Циля-Нильсена, но отличается использованием раствора соляной кислоты в качестве протравы, разрыхляющей оболочку споры, которая плохо воспринимает красители. Кислотоустойчивые споры окрашиваются в розово-красный, а бактериальная клетка в голубой цвет (рис. № 9).
Рис. №9. Споры у Bacillus subtilis
ПРАКТИЧЕСКОЕ ЗАНЯТИЕ №5 Определение подвижности микроорганизмов методами нативных препаратов. Студент должен знать: - строение, состав и значение жгутиков, - классификация бактерий по расположению жгутиков, - примеры жгутиковых микробов, - факторы, влияющие на скорость движения микробов, - методы определения подвижности микробов, - особенности темнопольной микроскопии, - принцип строения влажной камеры, ее предназначение, - особенности культур, используемых в данных методах. Студент должен уметь: - техника микроскопии нативных неокрашенных препаратов в темном поле, - выявление подвижности микроорганизмов, - методика приготовления висячей капли, - методика приготовления раздавленной капли, - соблюдение мер безопасной работы с живыми культурами микробов, - обработка рабочего места и рук дез. веществами. Этапы самостоятельной аудиторной работы: 13. Подготовить препараты висячая и раздавленная капли из культуры, выращенной на жидкой питательной среде 14. Препараты бактериоскопировать в темнопольной микроскопии 15. Обработать рабочие места и руки 16. Записать результаты микроскопирования и алгоритмы методов в дневник
МЕТОД РАЗДАВЛЕННОЙ КАПЛИ 1. На предметное стекло наносят пипеткой или петлей каплю культуры и покрывают ее покровным стеклом.! Чтобы не образовалось пузырьков воздуха, покровное стекло подводят ребром к краю капли и резко опускают его 2. Для предохранения от высыхания препарат помещают во влажную камеру 3. Микроскопируют в темном поле при увеличении объектива 40Х Препарат можно поместить во влажную камеру для предохранения от высыхания МЕТОД ВИСЯЧЕЙ КАПЛИ 1. 2. На покровное стекло наносят каплю культуры и осторожно накрывают покровное стекло стеклом с лункой так, чтобы капля оказалась в центре 3. Склеившиеся стекла быстро переворачивают покровным стеклом вверх. Капля находится в герметической камере и сохраняется долгое время Микроскопия сначала при увеличении 8Х. Находят край капли, а затем переводят на большое увеличение 40Х (рис. № 11). Рис. №10. Техника приготовления препарата висячая капля

ПРАКТИЧЕСКОЕ ЗАНЯТИЕ №6 Зачетное занятие с замером навыков по теме: «Морфология микроорганизмов» Перечень манипуляций к зачету: - подготовить препарат и окрасить его по методу Грама. Значение метода - подготовить препарат и окрасить его по методу Ожешко. Значение метода - подготовить препарат и окрасить его по методу Бурри-Гинса. Значение метода - подготовить препарат, окрасив его по методу Циля-Нильсена (1999г). Значение метода - подготовить препарат висячая капля, значение методики - подготовить препарат раздавленная капля, значение методики - промикроскопировать готовые препараты, окрашенные различными методами: по Граму, Ожешко, Бурри-Гинсу, Циля-Нильсену. Вопросы к зачету: - назовите основные формы бактериальных клеток, -перечислите основные и дополнительные структуры прокариотической клетки, их функции, - укажите состав и строение жгутиков, группы бактерий по расположению жгутиков, - назовите строение и функции нуклеоида у прокариот, - укажите, что собой представляет спора и ее значение для бактерий, расположение спор в клетке (примеры микробов). Тестовые задания для самоконтроля 1. Расставьте этапы приготовления препарата в нужном порядке: а) окрашивание б) фиксация в) приготовление мазка г) высушивание
2. Укажите соответствие между возбудителем и методом его окраски: 1) стафилококк а) по Граму 2) микобактерия туберкулеза б) Циля - Нильсену 3) пневмококк в) Бурри - Гинсу 4) бацилла сибирской язвы г) Ожешко 3. Простой метод окраски: а) по Нейссеру б) метиленовым синим в) по Граму г) по Романовскому - Гимзе 4. Хранителем наследственной информации у прокариот является: а) нуклеоид б) спора в) включения г) капсула 5. Окраска по методу Бурри отличается от метода Бурри-Гинса: а) по времени окрашивания б) отсутствия фуксина Пфейффера в) разные разведения туши г) мазок фиксируется в пламени горелки 6. При окраске препарата методом Циля-Нильсена (инструкция 1999г.) используется: а) 0,5% НС1 б) 0,9% NaCl в) 5% Н2SО4 г) 25% Н2SО4 7. К спорообразованию способны: а) стафилококки б) бациллы в) сарцины г) кишечная палочка 8. В методике окраски по Бурри-Гинсу используется черная тушь, разведенная в а) 2 раза б) 5 раз в) 10 раз г) 100 раз 9. Укажите соответствие: Метод окраски: Цель метода: 1. метод Ожешко а) обнаружение капсулы 2. метод Бурри б) определение кислотоустойчивости 3. метод Циля-Нильсена в) отношение к Граму 4. метод Грама г) определение споры 10. При изучении подвижности используется микроскопия: б) темнопольная в) электронная г) люминисцентная 11. Гонококки - это шаровидные бактерии, в мазках выглядят как: а) диплококки б) сарцины в) микрококки г) тетракокки 12. При окраске по Граму используется следующий краситель: а) фуксин Циля б) метиленовый синий в) бриллиантовый зеленый г) генциановый фиолетовый 13. Спору у бактерий можно выявить, окрасив препарат: а) метиленовым синим б) методом Ожешко в) методом Грама г) по Бурри-Гинсу 14. Флагеллин - это белок, входящий в состав: а) оболочки б) капсулы в) цитоплазмы г) жгутиков 15. Укажите соответствие: Вид микроскопии: Цель применения: 1) Световая обычная микроскопия а) для изучения живых неокрашенных препаратов 2)Фазово-контрастная микроскопия б) для изучения окрашенных препаратов 16. Перетрихи - имеют следующее расположение жгутиков на клетке: а) по всей поверхности б) на обоих концах в) пучок на одном из концов г) один жгутик на конце клетки 17. Виды фиксации: 1) физический а) пламя горелки, б) смесь Никифорова, 2) химический в) ацетон, г) спирт 18. Предметное стекло с лункой используется: а) в методе Циля-Нильсена б) изучение подвижности в) изучения на наличие капсулы г) при обнаружении споры 19. Дополнительной структурой бактерий является: а) нуклеоид б) ЦПМ в) капсула г) рибосомы 20. Препарат из нативного материала готовится при окраске: а) Грама б) Бурри - Гинса в) Ожешко г) Циля-Нильсена 21. Бактерии штопорообразной формы называют: а) спирохеты б) спириллы в) вибрионы г) бруцеллы 22. Негативные методы окраски используются при методе: а) Бурри-Гинса б) Циля-Нильсена г) Ожешко д) Нейссера 23. В состав клеточной стенки бактерий входит: а) крахмал б) муреин в) альбумин г) пилин 24. Методы изучения микроорганизмов: а) серологические б) бактериологические в) аллергические г) все ответы верны ОТВЕТЫ НА ТЕСТОВЫЕ ЗАДАНИЯ 1. в, г, б, а 2. 1 – а 2 – б 3 – в 4 - г 3. б 4. а 5. б 6. г 7. б 8. в 9. 1 – г 2 – а 3 – б 4 – в 10. б 11. а 12. г 13. б 14. г 15. 1- б 2 –а 16. а 17. 1- а 2 – б, в, г 18. б 19. в 20. г 21. а 22. а 23. б 24. г
СПИСОК ЛИТЕРАТУРЫ
1. Алешукина А.В. Медицинская микробиология: Учебное пособие. – Ростов н/Д: Феникс, 2003 г. 2. Бакулина Н.А., Краева Э.Л. Микробиология. М., «Медицина», 1976 3. Микробиология /Под ред. Ф.К. Черкес. – М.: Медицина, 1986 г. 4. Основы микробиологии, вирусологии, иммунологии: Учебник / А.А.Воробьев, Ю.С. Кривошеин, А.С. Быков и др. Под ред. А.А. Воробьева и Ю.С. Кривошеина. – М.: Мастерство; Высшая школа, 2001 г. 5. Прозоркина Н.В., Рубашкина Л.В. Основы микробиологии, вирусологии, иммунологии: Учебное пособие для средних специальных медицинских учебных заведений. – Ростов н/Д: Феникс, 2002 г. 6. Руководство для малого практикума по микробиологии, П.А.Чиров, З.И.Остроухова, Е.И.Тихомирова, Изд-во СГУ, 1998 г. 7. Сбойчаков В.Б. Микробиология с основами эпидемиологии и методами микробиологических исследований: учебник для средних медицинских учебных заведений / В.Б. Сбойчаков. – СПб.: СпецЛит, 2007г.
ПРИЛОЖЕНИЕ №1 Техника безопасности в кабинете (лаборатории) микробиологии Правила работы со спиртовкой 1. Заправленную спиртовку хранят плотно закрытой притертым колпачком, чтобы предотвратить испарение спирта с фитиля 2. При зажигании спиртовки нужно снять колпачок и поджечь фитиль спичкой. При этом нельзя сдвигать держатель фитиля, т.к. пламя проскочит внутрь спиртовки, что вызовет сильную вспышку и разбрызгивание горящего спирта 3. Нельзя зажигать спиртовку от другой уже горящей спиртовки, т.к. при этом может сдвинуться держатель фитиля и вылиться спирт 4. Нельзя дуть на пламя, чтобы погасить спиртовку. Для этого следует аккуратно закрыть спиртовку колпачком. 5. Необходимо следить за тем, чтобы спиртовка не перегревалась. Это ведет к испарению спирта и опасности взрыва 6. При длительном нагревании лучше пользоваться двумя спиртовками 7. Не следует при работе наклонять голову над спиртовкой, т.к. при накоплении паров спирта под держателем фитиля может происходить самопроизвольное вспыхивание
Правила пользования ручным химическим пенным огнетушителем ОХП -10 В случае возникновения пожара необходимо: 1. Для приведения огнетушителя в действие – ручку верхней части корпуса поворачивают на 180о и переворачивают огнетушитель вверх дном 2. Струю пены следует направлять не в центр пламени, а под минимальным углом к поверхности горения в нижнюю часть пламени, последовательно сбивая и оттесняя его от краев к центру 3. При тушении огня ОХП – 10 необходимо обесточить все помещения с помощью рубильника, т.к. химическая пена в составе огнетушителя обладает высокой электропроводностью РУКОВОДСТВО ДЛЯ СТУДЕНТОВ К ПРАКТИЧЕСКИМ ЗАНЯТИЯМ ПО МИКРОБИОЛОГИИ
Государственное образовательное учреждение среднего профессионального образования «Энгельсский медицинский колледж»
А.В. Палиенко
РУКОВОДСТВО К ПРАКТИЧЕСКИМ ЗАНЯТИЯМ по курсу «Микробиология с основами эпидемиологии и методами микробиологических исследований» раздел «Морфология микроорганизмов»
Руководство для студентов отделения 060110 «Лабораторная диагностика»
г. Энгельс, 2009 г. РЕЦЕНЗИЯ на руководство к практическим занятиям по курсу «Микробиология с основами эпидемиологии и методами микробиологических исследований» раздел «Морфология микроорганизмов», составленное преподавателем микробиологии А.В. Палиенко Представленная работа составлена в соответствии Государственного стандарта и квалификационной характеристики специальности 060110 «Лабораторная диагностика». Построено в соответствии современными педагогическими и методическими требованиями. Данное руководство обеспечит самостоятельность студентов в работе на практических занятиях по микробиологии и облегчит педагогический процесс. Для эффективного усвоения материала имеются вопросы и тестовые задания для студенческого самоконтроля. По каждому занятию указан объем выполняемой практической работы. Приведенные в работе алгоритмы, рисунки, схемы помогут систематизировать и закрепить знания студентов по данной теме. В руководстве приводится микроскопический метод исследования микроорганизмов, который позволяет изучить тинкториальные и морфологические свойства микроба, степень чистоты выделенной культуры, расположение микроорганизмов в мазках, выявить структуры клетки – споры, капсулы, определить подвижность микроба, дифференцировать кислотоустойчивые бактерии. Все эти признаки необходимы для идентификации микроорганизма. С помощью этого метода можно подтвердить клинический диагноз инфекционных заболеваний. Учебное пособие предназначено для использования во время практических занятий по микробиологии раздел «Морфология микроорганизмов», а также для самостоятельной работы студентов дома.
Рецензент: Глинская Е.В., к.б.н., доцент кафедры микробиологии и физиологии растений биологического факультета СГУ им. Н.Г.Чернышевского
СОДЕРЖАНИЕ Предисловие…………………………………………………...……...5 Введение в практикум………………………………………………..6 Занятие №1……………………………………………………………8 Занятие №2……………………………………………………………16 Занятие №3……………………………………………………………19 Занятие №4……………………………………………………………22 Занятие №5…………………………………………………………....24 Занятие №6…………………………………………………………....26 Ответы на тестовые задания ………………………………………...31 Список литературы…………………………………………………..32 Приложение №1……………………………………………………....33 Приложение №2……………………………………………………....35
ПРЕДИСЛОВИЕ Лабораторные занятия проводятся в специально оборудованных помещениях, имеющих подводку электричества к каждому рабочему месту, а также раковину с водопроводной водой. Поверхность рабочих столов покрыта стеклом для лучшей дезинфекции. За каждым студентом закрепляется постоянное рабочее место, на котором должно быть оборудование, необходимое для выполнения конкретного задания, рабочая тетрадь, ручка и карандаш. Для личных вещей отводится специальное место. В начале занятия студенты знакомятся с определенным заданием, изложенным в учебном пособии, делают записи основных методик в рабочей тетради, а затем приступают к выполнению работы под наблюдением преподавателя. Результаты исследований в виде рисунков, описаний морфологии микроорганизмов заносятся в тетрадь, и работа представляется преподавателю для проверки. В связи с тем, что на практических занятиях студенты работают с живыми культурами микробов, анилиновыми красителями, химическими веществами, а также используют электрические приборы (лампы) и спиртовки, они обязаны выполнять основные правила техники безопасности (приложение №1,2). Все задания студентами выполняются самостоятельно в соответствии с задачами, поставленными в учебном пособии. Автор будет признателен за все замечания и предложения по содержанию включенного материала и совершенствованию методики обучения.
ВВЕДЕНИЕ В ПРАКТИКУМ Микроскоп (рис.1) - оптический прибор для изучения микрообъектов. Студенческие лаборатории чаще оснащены микроскопами МБИ-1. В научных и практических микробиологических лабораториях используют микроскопы отечественных марок: МБР – 1, МБИ-1, МБИ-2, МБИ-3, Биолам Р-1 и другие. Они предназначены для изучения формы, структуры, размеров и других признаков микроорганизмов, величина которых не менее 0.2-0.3 мкм. Поскольку микробы очень малы, то измеряются они в микрометрах (мкм - тысячная доля миллиметра) и потому изучение их возможно только с помощью микроскопов, дающих достаточно большое увеличение. Общее увеличение микроскопа слагается из произведения увеличений объектива и окуляра. Обычно при микробиологических исследованиях для получения полезного увеличения в 600-1000 раз используют объективы с увеличением в 90-100 раз и окуляры, увеличивающие изображение в 7-10 раз. Объективы подразделяются на сухие и иммерсионные (погруженные). При работе с сухими объективами между фронтальной линзой и изучаемым объектом находится воздух. При этом, в виду разницы коэффициентов преломления предметного стекла и воздуха, часть световых лучей отклоняется и не попадает в объектив. Объективы иммерсионные обозначают буквами О.И. и цифрами х90 и х100. Современные микроскопы имеют ряд усовершенствований. Так, бинокулярный микроскоп с двумя тубусами дает возможность вести наблюдение одновременно обоими глазами. Для изучения неокрашенных объектов используется фазово-контрастное устройство, с помощью которого можно получить четкое контрастное изображение прозрачных, не имеющих окраски микроорганизмов. При прохождении света через окрашенный препарат, изменяется интенсивность света (амплитуда световой волны), что легко улавливается глазом. При прохождении же пучка света через неокрашенный, прозрачный объект изменяется только скорость его движения, т.е. фаза колебаний светового луча, что глазом не улавливается. Принцип фазово-контрастного устройства заключается в переводе невидимых колебаний света в амплитудные видимые. В ряде специальных исследований, в частности при изучении внутриклеточных структур микроорганизмов, используется люминесцентная микроскопия, основанная на способности некоторых объектов при специальном окрашивании флюорохромами светиться в коротковолновых лучах света (ультрафиолетовых, синих и др.). К флюорохромам относятся акридиновый желтый, пиронин, акридиновый оранжевый. Люминесцентная микроскопия проводится с обычным микроскопом, снабженным источником ультрафиолетовых лучей и набором светофильтров, выделяющих коротковолновую часть спектра.
|
|||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-19; просмотров: 1350; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.143.31 (0.32 с.) |








 На фиксированный препарат накладывают фильтровальную бумагу, на которую наносят карболовый фуксин Циля. Подогревают до отхождения паров, процедуру можно повторить. Выдерживают 5 мин
На фиксированный препарат накладывают фильтровальную бумагу, на которую наносят карболовый фуксин Циля. Подогревают до отхождения паров, процедуру можно повторить. Выдерживают 5 мин
 Некоторые микробы обладают способностью откладывать на поверхности своего тела мощный слизистый слой вокруг клеточной стенки. Его называют капсулой. В состав капсул входят, главным образом, полисахариды (пневмококк), но у некоторых они содержат и полипептиды (палочка сибирской язвы). Капсулы имеют консистенцию геля, поэтому при микроскопии живых бактерий они видны очень плохо. Для обнаружения применяют негативную окраску. При этом краситель заполняет пространство вокруг бактерий, в результате чего они выглядят светлыми частицами на темном фоне.
Некоторые микробы обладают способностью откладывать на поверхности своего тела мощный слизистый слой вокруг клеточной стенки. Его называют капсулой. В состав капсул входят, главным образом, полисахариды (пневмококк), но у некоторых они содержат и полипептиды (палочка сибирской язвы). Капсулы имеют консистенцию геля, поэтому при микроскопии живых бактерий они видны очень плохо. Для обнаружения применяют негативную окраску. При этом краситель заполняет пространство вокруг бактерий, в результате чего они выглядят светлыми частицами на темном фоне.
 Для приготовления препарата необходимы стекло с лункой, покровное стекло, вазелин. Края лунки покрывают тонким слоем вазелина (рис. № 10)
Для приготовления препарата необходимы стекло с лункой, покровное стекло, вазелин. Края лунки покрывают тонким слоем вазелина (рис. № 10)


