
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Схема ТСХ-скрининга веществ основного характераСодержание книги
Поиск на нашем сайте
Условия исследования: Пластинки «Сорбфил» - силикагель, закреплённый на полимерной подложке силиказолем. Система растворителей - диоксан:хлороформ:ацетон:25% раствор NH3 23,5: 22,5:2,5:1,5. Время насыщения камеры - 20 минут. Высота подъёма фронта растворителей - 8 см. Реагенты для обнаружения: 10% раствор серной кислоты – обнаружение производных фенотиазина, флуоресценция хинина;
Реактив Марки (прокапывание) - фенотиазины (усиление окраски), димедрол, алкалоиды опия; Реактив Драгендорфа - общий реагент на азотсодержащие вещества основного характера. Методика исследования В зоны А и С точками наносят по 1/2 части аликвоты АО (методика подготовки пробы аналогична приведенной для веществ кислотного характера). В зону В наносят в точку 1-2 метчика, причём аминазин - обязательно. В зону D наносят полосой аликвоту БO. После хроматографирования пластинку подсушивают. Зоны А и В обрабатывают раствором серной кислоты. Наблюдают окраску и флуоресценцию при 366 нм. Затем обрабатывают зоны А и В реактивом Драгендорфа, а зону С прокапывают реактивом Марки. Отмечают окраску, копируют пластинку и определяют значения Rf и RS (по аминазину). С зоной D поступают также, как и с зоной Е для веществ кислотного характера. Таблица 2. Значения Rf и RS (по аминазину) для веществ основного характера
Литература: [4]. ЗАНЯТИЕ №13. Количественное определение лекарственных веществ,выделенных из биоматериала полярными растворителями Цель занятия: Научиться проводить количественное определение веществ, изолируемых из биоматериала полярными растворителями ХОД ЗАНЯТИЯ · Контроль исходного уровня знаний 1. Правила работы на спектрофотометре, фотоэлектроколориметре и флуориметре. 2. Основные требования, предъявляемые к методам количественного определения токсических веществ в биологических жидкостях. 3. Применение физико-химических методов в химико-токсикологическом анализе. · Лабораторная работа Методика фотометрического определения папаверина (аминазина) В биожидкостях В пенициллиновый флакон с анализируемой пробой прибавляют 10 мл воды очищенной, перемешивают. Фильтруют в мерную колбу вместимостью 25 мл, прибавляют 1 мл 0,1% раствора поливинилового спирта (ПВС), 1 мл 0,07% раствора эозина, 2 мл 0,01 М раствора серной кислоты и доводят водой до метки. Параллельно готовят раствор сравнения, содержащий все реактивы за исключением определяемых соединений. Для приготовления раствора стандартного образца в мерную колбу вместимостью 25 мл помещают 2 мл стандартного раствора папаверина (аминазина) - 10 мкг/мл, прибавляют вышеуказанные реактивы и доводят водой до метки. Измеряют оптическую плотность раствора на ФЭКе при длине волны 540 нм, в кювете с толщиной слоя 2 см относительно раствора сравнения. Концентрацию папаверина (аминазина) в мкг/мл рассчитывают по формуле:
где АХ – оптическая плотность анализируемого раствора; где АСТ – оптическая плотность стандартного раствора. Методика количественного определения хинина в биожидкостях В пенициллиновый флакон с анализируемой пробой прибавляют 10 мл 0,01 М раствора серной кислоты, встряхивают 5 минут и фильтруют в пенициллиновый флакон. В качестве стандарта используют раствор хинина с концентрацией 1 мкг/мл. Измеряют интенсивность флуоресценции анализируемого и стандартного растворов. Концентрацию хинина в мкг/мл в анализируемой биожидкости рассчитывают по формуле:
где IХ – интенсивность флуоресценции анализируемого раствора; где IСТ - интенсивность флуоресценции стандартного раствора. Методика спектрофотометрического определения производных барбитуровой кислоты в биожидкостях В пенициллиновый флакон с анализируемой пробой прибавляют 10 мл воды очищенной. Встряхивают 5 минут. Фильтруют в пенициллиновый флакон. В кювету спектрофотометра с толщиной слоя 1 см помещают фильтрат и добавляют 3 капли 0,2 М раствора серной кислоты. Перемешивают. Измеряют оптическую плотность раствора при 240 нм. В качестве раствора сравнения используют воду очищенную. Затем в кювету с анализируемым раствором прибавляют 3 капли 30% спиртового раствора NaOH, перемешивают и измеряют оптическую плотность. В качестве раствора сравнения используют воду очищенную. Аналогично измеряют оптическую плотность стандартного раствора барбитала с концентрацией 10 мкг/мл. Концентрацию барбитуратов (мкг/мл) в анализируемой биологической жидкости рассчитывают по формуле:
где где Литература: [4].
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-17; просмотров: 408; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.220 (0.01 с.) |





 и
и  - оптические плотности анализируемого раствора в щелочной и кислой средах;
- оптические плотности анализируемого раствора в щелочной и кислой средах; и
и 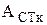 - оптические плотности стандартного раствора в щелочной и кислой средах;
- оптические плотности стандартного раствора в щелочной и кислой средах;


