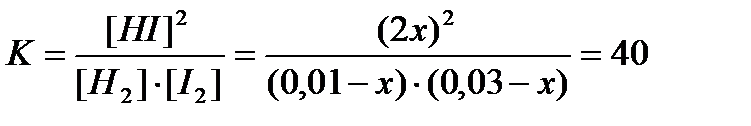Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Классификация неорганических соединенийСодержание книги
Поиск на нашем сайте
КЛАССИФИКАЦИЯ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ Основные типы неорганических веществ
Все вещества делятся на простые и сложные. Простые вещества состоят из атомов одного химического элемента. Сложные вещества состоят из атомов двух или большего числа элементов. Все простые(кроме одноатомных) и сложные вещества принято называть химическими соединениями, так как в них атомы одного или разных элементов соединены между собой химическими связями. Элементы условно делят на металлы и неметаллы. К неметаллам относят все элементы VIIIA группы(благородные газы) и VIIAгруппы(галогены); элементы VIA группы(кроме полония);фосфор и мышьяк (VA группа); углерод, кремний(IVA группа); бор(IIIA группа) и водород. Неорганические вещества разделяются на бинарные или многоэлементные соединения. К важнейшим бинарным соединениям относятся соединения элементов с кислородом(оксиды), с галогенами(галогениды), азотом(нитриды),углеродом(карбиды), гидриды(соединения металлических элементов с водородом). Оксиды по функциональным признакам подразделяются на солеобразующие и несолеобразующие (индефферентные). Несолеобразующие оксиды при обычных условиях не взаимодействуют с водой, основаниями и кислотами. Однако при высоких температурах,, а также в биохимических реакциях они проявляют достаточно высокую реакционную способность(например, СО, NO, N2O). Солеобразующие оксиды по их кислотно-основным свойствам подразделяются на основные, кислотные и амфотерные. Основные оксиды – оксиды, которым в качестве гидроксидов соответствуют основания. Основной характер проявляют оксиды активных металлов, а также металлов d–элементов, атомы которых имеют низкие степени окисления. Например, основному оксиду Na2O соответствует гидроксид NaOH, оксиду СаО –гидроксид Са(ОН)2,оксиду CrO - гидроксид Cr(OH)2 Кислотные оксиды – оксиды, которым в качестве гидроксидов соответствуют кислоты. Это оксиды неметаллов и d–элементов в высоких степенях окисления. Например, кислотному оксиду SO3 соответствует кислотный гидроксид H2SO4 (серная кислота), оксиду CrO3 –кислотный гидроксид H2CrO4(хромовая кислота). Важнейшим свойством кислотных оксидов является их способность реагировать с основаниями и основными оксидами с образованием солей. Кислотные и основные оксиды сохраняют солеобразующие свойства соответствующих гидроксидов при взаимодействии с противоположными по свойствам гидроксидов между собой: N2O5 + 2NaOH = 2NaNO3 + H2O 3CaO + 2H3PO4 = Ca3(PO4)2 + 3H2O Амфотерные оксиды – это оксиды, способные взаимодействовать как с кислотами, так и со щелочами, а также с кислотными и щелочными оксидами. Им соответствуют гидроксиды, проявляющие в зависимости от условий свойства кислот или оснований: Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O 2Al(OH)3 + 3SO3 = Al2(SO4)3 + 3H2O Al2O3 + 2NaOH = 2NaAlO2 + H2O 2Al(OH)3 + Na2O = 2NaAlO2 + 3H2O Оксиды d–элементов всегда в той или иной степени амфотерны, так как с повышением степени окисления основный характер этих соединений уменьшается, в то же время возрастает их кислотный характер. Таким образом, оксидыd –элементов в промежуточных степенях окисления будут проявлять амфотерные свойства. Гидроксиды – соединения имеющие в своём составе гидроксильные группы ОН-. Химические свойства простых веществ Химические свойства металлов Для металлов проявление в реакциях восстановительных свойств, поэтому в соединениях они всегда имют положительную степень окисления. Неметаллы в соединениях с металлами имеют отрицательную степень окисления. Взаимодействие металлов с оксидами 2Al + Fe2O3 = Al2O3 + 2Fe 2Al + Cr2O3 = Al2O3 + 2Cr Эти реакции сопровождаются большим выделением тепла Химические свойства оксидов
N2O5 + H2O = 2HNO3 - кислотный гидроксид NO2(OH) Na2O + H2O = 2NaOH - основный гидроксид
CaO + SO3 = CaSO4 Na2O + Al2O3 = 2NaAlO2 (при сплавлении)
образуя соль и воду: MgO + H2SO4 = MgSO4 + H2O Na2O + Zn(OH)2 = Na2ZnO2 + H2O (при сплавлении)
N2O5 + Al2O3 = 2Al(NO3)3 SO3 + ZnO = ZnSO4 CO2 + CaO = CaCO3
образованием соли и воды: . Mn2O7 + 2KOH = 2KMnO4 + H2O N2O5 + Zn(OH)2 = Zn(NO3)2 + H2O
Al2O3 + K2O = 2KAlO2
ZnO + H2SO4 = ZnSO4 + H2O ZnO + 2NaOH + H2O = Na2[Zn(OH)4] ZnO + 2NaOH = Na2ZnO2 + Н2О (в расплаве)
реакции образуется малорастворимое вещество или выделяется газ: CO2 + Na2SiO3 + H2O = H2SiO3 ↓ + Na2CO3 SiO2 + Na2CO3 = Na2SiO3 + CO2↑ (сплавление) Кислоты Соли Соли - это сложные соединения, частицы которых состоят из катионов металлов и анионов кислотных остатков. Их можно рассматривать как продукты взаимодействия кислоты и основания, при котором происходит замещение атомов водорода кислоты на металл или гидроксидных групп основания на кислотные остатки. В зависимости от степени замещения водорода или гидроксидных ионов различают соли средние, кислые, основные. Кроме того, существуют соли более сложного состава - смешанные, двойные и комплексные. Типы солей представлены на рис:
С О Л И
Средние Основные Кислые Смешанные и двойные Комплексные
Химические свойства средних солей.
Соли в водном растворе могут реагировать со многими веществами (металлами, щелочами, растворимыми кислотами, растворимыми солями) при условии, если в результате этих реакций будут образовываться газ, осадок, гидрат аммиака или слабые кислоты:
Fe + CuSO4 = Cu ↓+ FeSO4 Pb(NO3)2 + 2KOH = Pb(OH)2 ↓+ K2SO4 AgNO3 + HCl = AgCl ↓+ HNO3 BaCl2 + Na2SO4 = BaSO4 ↓+ 2NaCl (NH4)2SO4 + 2NaOH = Na2SO4 + 2NH3*H2O Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
Специфическим свойством некоторых солей является их способность разлагаться при нагревании. Соли азотной кислоты (нитраты) при нагревании разлагаются, причём продукты разложения могут быть разными в зависимости от положения металла соли в электрохимическом ряду напряжений: Левее Mg → MeNO2 + O2 В интервале Mg-Cu → MeO + NO2 + O2 Правее Cu → Me + NO2 + O2 Разложение солей аммония также протекает неоднозначно:
NH4Cl → NH3 + HCl
NH4NO2 → N2 + 2H2O (NH4)2CO3 → 2NH3 + H2O + CO2 (NH4)2Cr2O7 → Cr2O3 + N2 + 4H2O
Cоли угольной кислоты (карбонаты) при нагревании также могут образовывать различные продукты: CaCO3 → CaO + CO2 Ca(HCO3)2 → CaCO3 + CO2 + H2O Соли серной кислоты (сульфаты) обычно разлагаются с образованием оксида металла и оксида серы (VI) (кроме сульфатов Na, K, Rb, Cs): CuSO4 → CuO + SO3↑.
Неполное замещение атомов водорода приводит к тому, что в формуле соли, в составе анионной части присутствуют один или несколько атомов водорода. Формулы кислых солей выглядят следующим образом: NaH2PO4, Na2HPO4, KHS, Ca(HCO3)2. В качестве приме рассмотрим реакцию получения кислых солей фосфорной кислоты и гидроксида натрия.
H3PO4 + NaOH = NaH2PO4 + H2O, и (дигидрофосфат натрия)
H3PO4 + 2NaOH = Na2HPO4 + 2H2O (гидрофосфат натрия)
При построении традиционных названий кислых солей к названию аниона средней соли добавляется приставка гидро- и числовая приставка, если число атомов водорода в анионе больше, чем один:
NaHSO3 - гидросульфит натрия, Ca(H2PO4)2 - дигидрофосфат кальция.
Напишите уравнения соответствующих реакций:
Оксиды металлов Оксиды неметаллов
: Кислоты
Основания
Напишите уравнения реакций, заменив названия формулами:
СПОСОБЫ ВЫРАЖЕНИЯ СОСТАВА РАСТВОРОВ Массовая доля ω(в) растворённого вещества «В» – отношение массы растворённого вещества m(в) к сумме масс растворённого вещества и растворителя, чаще всего, воды (т.е. к массе раствора): w(в) = Массовая доля растворённого вещества выражается в долях или в %%(процентное содержание). Например, раствор с массовой долей серной кислоты ω (H2SO4)=0,2(т.е.20%) может быть обозначен как 20% - раствор серной кислоты. В биологии и медицине также часто используют мг% и мкг%. Число мг% показывает, сколько мг растворённого вещества содержится в 100 г раствора. Число мкг% показывает, сколько мкг растворённого вещества содержится в 100 г раствора. Содержание растворённого вещества в мг% и мкг% применяют для характеристики очень разбавленных растворов. Например, массовая доля раствора глюкозы равна 0,001% или 1мг% или 1000мкг%. Молярная концентрация с(в) растворённого вещества «В»- отношение количества вещества n(в) к объёму раствора: c(в)= Раствор, в котором молярная концентрация растворённого вещества равна с(в) моль/л, характеризуется молярностью, численно равной значению с(в). Например, раствор с молярной концентрацией серной кислоты с(H2SO4)= 0,1моль/л может быть обозначен как 0,1М H2SO4 (децимолярный раствор серной кислоты в воде). Нормальная концентрация(молярная концентрация химического эквивалента сeq (в) растворённого вещества «В» – это отношение эквивалентного количества вещества neq(в) к объёму раствора:
Раствор, в котором молярная концентрация эквивалента равна ceq(в) моль/л, характеризуется нормальностью, численно равной значению ceq(в). Например, раствор с молярной концентрацией эквивалента серной кислоты ceq(H2SO4)= 1моль/л может быть обозначен как 1н H2SO4 (однонормальный раствор серной кислоты в воде). Нормальность раствора определяется эквивалентным количеством растворённого вещества и, следовательно, как и последнее, зависят от эквивалентного числа z(в), постоянного только для конкретной реакции, причём величина ceq(в) всегда в z(в) раз больше его молярной концентрации c(в): сeq(в)=z(в) с(в). Химическим эквивалентом называется реальная или условная частица вещества «В», которая в данной кислотно-основной реакции эквивалентна одному иону Н+ или в данной окислительно-восстановительной реакции одному электрону. В одной формульной единице вещества «В» может содержаться z (в) химических эквивалентов этого вещества. Эквивалентное число z (в) показывает, сколько химических эквивалентов содержится в одной формульной единице; всегда z(в) ≥1. Например, 0,1н H2SO4 – это раствор, содержащий 0,1 моль/л эквивалента серной кислоты, т.е. (1/2 H2SO4). При указании нормальной концентрации обязательно следует указывать конкретную реакцию, в которой данный раствор применяется. Молярная доля χ растворённого вещества - отношение количества данного компонента «В» в молях, содержащегося в растворе, к общему количеству всех веществ, включая растворитель: χ = n(в)/n(в) + n(р-ль) Молярная доля χ, как и массовая выражается в долях единицы, в процентах. Например, χ(H2SO4) = 0,01 = 1%.
Моляльность раствора b – отношение количества данного растворённого вещества n(в) моль к массе растворителя (в кг): b = n(в)/m(р-ль). Например, b(H2SO4) = 0.1моль/кг.
Пример 1. В 450 г воды растворили 50 г CuSO4·5H2O. Вычислите массовую долю кристаллогидрата, безводной соли и ионов меди в растворе. Решение: ω (CuSO4·5H2O) = ω (CuSO4) = Пример 2. Какую массу 5%-ного раствора MgSO4 можно приготовить из 300 г MgSO4 ·7H2O?
Решение: ω(MgSO4) = m(MgSO4)/m (р-р). m(р-р) = m(MgSO4)/0,05 m(MgSO4) = m(MgSO4 ·7H2O)/M (MgSO4 ·7H2O) ·M(MgSO4) = 300/246 · 120 = 146,3(г) m(р-р) = 146,3/0,05 = 2926,8(г) Пример3. Сколько воды следует прибавить к 200мл 20% -ного раствора серной кислоты с плотностью 1,14г/мл, чтобы получить 5% -ный раствор?
Решение: m(р-ра H2SO4) = 200·1,14 = 228(г). m(H2SO4) = 228 · 0.2 = 45.6(г) 0,05 =45,6/ [228 + m(H2O)]. [228 + m(H2O)] = 45,6/0,05 = 912(г) m(H2O) = 912 – 228 = 684(г). Пример 4. Смешали 300г 40% раствора азотной кислоты и 700г 10% раствора той же кислоты. Определите массовую долю полученного раствора.
Решение: m(р-ра HNO3) = 300 + 700 = 1000(г). m(HNO3) = 300 · 0,4 + 700 · 0,1 = 190(г). ω(нового раствора) = 190/1000 = 0,19=19% Пример 5. Определите массу 30% раствора серной кислоты, которую следует добавить к 600 г 80% раствора той же кислоты для получения 60% раствора.
Решение: Пусть масса 30% раствора X. Тогда масса раствора после смешения: m(р-р) = 600 + X m(H2SO4) = 600 · 0,8 + X · 0,3. 0,6 = [600 · 0,8 + X · 0,3. 0,6] / (600 + X). X = 400(г). Пример 6. Как приготовить 500мл 1,5 М раствора серной кислоты из 96%-ного раствора с плотностью 1,84г/мл?
Решение: n(H2SO4) = 1,5 · 0,5 = 0,75(моль). m(H2SO4) = 98 0,75 = 73,5(г). V(96% р-ра H2SO4) = 73,5/ 1,84 · 0,96 = 42(мл). Далее необходимо долить воды, чтобы довести объём раствора до 500мл. Пример 7. Вычислите молярную и нормальную концентрацию раствора H3PO4 с массовой долей кислоты 49% и плотностью 1,33г/мл.Фактор эквивалентности кислоты равен 1/3.
Решение: Масса 1л раствора: 1000 ·1,33 = 1330(г). m(H3PO4) = 1330 · 0,49 = 650(г). n(H3PO4) = 650 / 98 = 6,6(моль). c(H3PO4) = 6,6 моль/л. c(1/3 H3PO4) = 6,6 / (1/3) = 19,8(моль экв),т.е. 19,8н H3PO4.
ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ 1. Определите массу растворённого вещества: а)в 250 г 8%-ного раствора K2CO3,. б) в 500 мл 5%-ного раствора азотной кислоты с плотностью раствора 1,03г/мл. 2. Вычислите массовую долю растворённых веществ для растворов, содержащих: а)1 моль аммиака в 3 моль воды; б) 100г серной кислоты в 10 моль воды. 3. Вычислите массовую долю безводной соли для раствора, приготовленного из 14,3г Na2CO3· 10H2O и 120г воды. 4. Вычислите массовую долю безводной соли в растворе, полученном растворением 0,01 моль кристаллогидрата Al2(SO4)3 · 18 H2O в 1,0 моль воды. 5. Какую массу хлорида калия следует добавить к 450 г 8%-ного раствора той же соли для получения 12%-ного раствора? 6. Какую массу воды следует добавить к 1кг 40;%-ного раствора серной кислоты для получения 25%-ного раствора? 7. Из 750 кг 48%-ного раствора серной кислоты выпарили 300 кг воды. Определите массовую долю серной кислоты в полученном растворе. 8. Какую массу 32%-ного раствора азотной кислоты следует добавить к 600 г 80%-ного раствора той же кислоты для получения 64%-ного раствора? 9. Определите массу 8%-ного раствора гидроксида натрия, которая потребуется для нейтрализации 292 г 20%-ного раствора соляной кислоты. 10. Какой объём 5,5%-ного раствора азотной кислоты(плотность равна 1,03г/мл) требуется для нейтрализации 60 мл 12%-ного раствора КОН (плотность равна 1,1г/мл)? 11. К 700 мл 84,5%-ного раствора серной кислоты(плотность 1,78г/мл) добавлено 1200 мл 42%-ного раствора гидроксида натрия (плотность 1,45 г/мл). Какой объём 35%-ного раствора гидроксида калия (плотность 1,35 г/мл) потребуется добавить к раствору для достижения нейтральной реакции? 12. Определите массу растворённого вещества, содержащегося в 1л следующих растворов: а)0,1н H2SO4(фактор эквивалентности ½); б) 0,5н Na2CO3 (фактор эквивалентности ½); в) 0,3н H3PO4 (фактор эквивалентности1/3). 13. Какой объём раствора 0,1н H2SO4 (фактор эквивалентности ½) можно приготовить из 70 мл 50%-ного раствора этой кислоты (плотность 1,40 г/мл)? 14. Вычислите молярную и нормальную концентрации следующих растворов: а) 40%-ный раствор гидроксида натрия(плотность 1,43 г/мл); б)20%-ный раствор соляной кислоты(плотность 1,1 г/мл);в) 18%-ный раствор аммиака(плотность0,932 г/мл) 15. Какая масса Na2CO3 требуется для взаимодействия с 600 мл 0,5н HNO3? 16. Какая масса BaCl2 · 2H2O потребуется для взаимодействия с 750 мл 0,12н H2SO4 + (фактор эквивалентности ½)? 17. Определите нормальную концентрацию 0,1 М H3PO4, используемого для получения гидрофосфатов. 18. В плазме крови содержится 152 ммоль/л ионов натрия. Считая, что ионы натрия находятся только в виде хлорида натрия, вычислите массовую долю хлорида натрия в плазме крови, Плотность плазмы крови 1,03 г/мл. 19.Для раствора сахарозы с концентрацией 0,1 моль/л рассчитайте массовую долю сахарозы (в %,мг%, мкг%), моляльность b, молярную долю χ. ρ (р-ра) = 1,04 г/мл. 20.Массовая доля железа в крови в расчёте на элемент составляет 50 мг%. Рассчитайте массу железа в расчёте на элемент, содержащегося в 5,0 кг крови.
Ответы: 1-а)20г,б)25,75г;2- а)23,9%,б)35,7%; 3 – 3,95%; 4 – 13,86%; 5 – 20,45г; 6 – 600г; 7 – 80%; 8 – 300г; 9 – 800г; 10 – 157мл; 11 – 380 мл; 12 – а)4,9г,б)26,5г,в)9,8г; 13 – 10л; 14 – а)14,3н,б)9,87н,в)6,03н; 15 – 15,9г; 16 – 11г; 17 - 0,2н; 18 – 0,86%; 19 –ω= 3,29%,3290 мг%, 3290000 мкг%, b =0,0994 моль/кг, χ= 0,00179; 20 – 2,5г; ХИМИЧЕСКОЕ РАВНОВЕСИЕ Пример 1. Константа равновесия системы H2(г) + I2(г) = 2HI(г) при некоторой температуре равна 40. Определите равновесные концентрации реагирующих веществ, если исходные концентрации этих веществ составляют (в моль/л): [I2] = 0,01; [H2] = 0,03. Решение: Пусть уменьшение концентрации водорода и иода к моменту равновесия будет x. Тогда равновесные концентрации составят(в моль/л): [I2] =(0,01 - x); [H2] = (0,03 – x); [HI] = 2x.
Решение этого уравнения даёт два корня:x1= 0,0349 моль/л и x2= 0,0096моль/л Так как исходная концентрация иода равна 0,01 моль/л, уменьшение концентрации не может превышать эту величину и, следовательно, решением задачи будет x2= 0,0096моль/л.Тогда равновесные концентрации реагирующих веществ будут равны(в моль/л): [[H2]р = 0,01 – 0,0096 = 0,0004; [I2]р = 0,03 – 0,0096 = 0,0204; [HI]р = 2 0,0096 = 0,0192. Пример 2. Химическое равновесие реакции СО2(г) + Н2(г) = СО(г)+Н2О(г) Установилось при следующих концентрациях реагирующих веществ(моль/л): [CO2] = 7,0; [H2] = 5,0; [CO] = 10; [H2O] = 14. Равновесие системы было нарушено вследствие уменьшения концентрации Н2О до 11 моль/л Рассчитайте равновесные концентрации реагирующих веществ после сдвига равновесия. Решение. Уменьшение концентрации Н2О показывает, что равновесие сместилось в сторону прямой реакции. Таким образом, концентрация СО2 и Н2 уменьшилась, а концентрация СО и Н2О увеличилась. Пусть изменение концентрации реагирующих веществ будет х моль/л.Тогда новые равновесные концентрации после смещения равновесия будут равны (в моль/л): [CO2] = (7-x); [H2] = (5-x); [CO] = (10 + x); [H2O] = (11 + x). Константа равновесия данной реакции равна: Кс = [CO] [H2O] / [CO2][H2] = 10 · 14 / 7 · 5 = 4,0. 4 = (10 +x) (11 +x) / (7 – x)(5 – x) = (110 + 21x + x2) / (35 – 12x + x2). x2 – 23x +10 = 0; x1 = 22,56; x2 = 0,44. Реальное значение имеет второй корень. Следовательно, х = 0,44моль/л. Новые равновесные концентрации: [CO2] = 7,0 – 0,44 = 6,56 моль/л; [H2] = 5,0 – 0,44 = 4,56 моль/л; [CO] = 10,0 + 0,44 = 10,44 моль/л; [H2O] = 11,0 + 0,44 = 11,44 моль/л.
ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1 Напишите выражения констант химического равновесия (Кс, Кр) следующих обратимых реакций (V = const. Т = const): а)N2(г) + 3H2(г) = 2NH3(г) б)C(тв)+ CO2(г) =2CO(г) в)4HCl(г) +O2(г) = 2H2O(г) + 2Cl2(г) г)2NO2(г) =2NO(г) +O2(г) 2. В каком направлении смещено равновесие в реакции Н2(г)+ J2(г)= 2HJ(г), если при некоторой температуре константа равновесия Кр>1? 3. С ростом температуры равновесие в реакции N2(г) + O2(г)= 2NO(г) сдвигаетсяв сторону прямой реакции. Экзотермичекая или эндотермическая реакция?. 4. При некоторой температуре константа равновесия реакции А=В равна 4. Как изменится константа равновесия реакции, если концентрацию вещества А увеличить в 10 раз? 5. При температуре 298К константа равновесия реакции А=В равна 4×10-4, а при температуре 1000К равна 5×10-6. Экзотермическая или эндотермическая эта реакция? 6. Как повлияет повышение давления на состояние равновесия системы: СН4(г) = С(тв) + 2Н2(г). 7. Как повлияет понижение температуры на величину константы равновесия реакции N2(г)+ ЗН2(г)=2 NH3(г),если стандартная реакции экзотермическая? 8. Исходные концентрации СО и Н2О соответственно равны 0,08 моль/л. Вычислите равновесные концентрации СО, Н2О и Н2 в системе СО(г)+ Н20(г)= СО2(г)+ Н2(г),если равновесная концентрация СО оказалась равной 0,05моль/л. 9. Равновесие реакции 4HCl(г) + 02(г)= 2H2O(г)+ 2Cl2(г) установилось при следующих концентрациях реагирующих веществ(в моль/л): /Н2О/ = /Cl2 / = 0.4; /HCl/ = /О2/ = 0.2. Вычислите константу равновесия Кс и исходную концентрацию кислорода в реакционной смеси. ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1. Рассчитайте [Н3О +], [ОН -] и рН: а) 0,01 М. раствора НС1, б) раствора Н2SО4 с концентрацией С[0,5Н2SO4 ] = 0,01 моль/л; в) 0,2 М раствора КОН; г ) раствора Ва(ОН)2. с концентрацией С[0,5 Ва(ОН)2]= 1 • 10-3моль/л. 2. Рассчитайте молярную концентрацию: а) раствора HBr, если рН раствора равно 1,65. б) раствора NaOH, если рН раствора равно11,26. 3. Рассчитайте рН раствора, содержащего в 2,5л одновременно 0,0032 моль HNO3 и 0,0083 моль H2SO4. ---------------------------------------------------------------------------------------------------------------------------- ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1. Напишите уравнения протолитического равновесия и укажите сопряженные кислотно-основные пары в водных растворах: а) азотистой кислоты Ко (HNO2) = 5,1×10-4; б) аммиака Кo(NH3××H2O)= 1,76×10-5; в) угольной кислоты Ко (Н2СО3 )= 4,5 • 10-7 Ко (НСО3-) = 4,8×10-11 От каких факторов зависит стандартная константа равновесия Ко ? 2 Напишите уравнения реакций автопротолиза воды и безводной уксусной кислоты. 3. Как связаны константы кислотности и основности сопряженной пары NH4 + - NH3? Приведите вывод формулы. 4. Степень диссоциации уксусной кислоты равна 1,32 • 10-2,Ко= 1,75 • 10-5. Определите концентрацию кислоты и рН раствора. 5. В О,1 М водном растворе аммиака рН=11,12. Вычислите степень диссоциации, константу основности и концентрацию ионов аммония в данном растворе. 6. Рассчитайте рН раствора, полученного при смешивании 10 мл 0,1 М HNO2 и 20 мл 0,05 М КОН, если плотности растворов равны 1,00 г/мл [К о (HNO2). =5,1×10-4]. ХИМИЯ ЭЛЕМЕНТОВ Р- ЭЛЕМЕНТЫ. VIIA- группа ВОПРОСЫ И ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ Р-ЭЛЕМЕНТЫ. VIА- группа. 1.Объясните аномальный с точки зрения периодического закона зависимость температур кипения от порядкового номера элемента Н2Э..................... H2O…………..H2S…………..H2Se……………H2Te tкип. 0C............ 100,00………… -60,35……….- 41,50…………. -1,80
2. Рассчитайте рН: а) 0,1М раствора сероводорода; б) 0,1М раствора сульфида натрия. Р - ЭЛЕМЕНТЫ VА - группа 1. Дайте сравнительную характеристику атомов элементов подгруппы азота, указав: а) электронные конфигурации, б) валентные возможности, в) наиболее характерные степени окисления. 2. Опишите электронное строение: аммиака, иона аммония. 3. Какова реакция среды в водных растворах: нитрата бария, нитрита натрия, фосфата калия? 4. Какие из перечисленных выше солей взаимодействуют в подкисленном серной кислотой растворе: а) с иодидом калия, б) с перманганатом калия? Напишите уравнения протекающих реакций. 5. Дайте сравнительную характеристику водородных соединений подгруппы азота, указав, как изменяются: а) температуры кипения и плавления, б) термическая устойчивость, в) окислительно- восстановительные свойства, г) кислотно- основные свойства.
Р- ЭЛЕМЕНТЫ IV А- группы 1. Дайте сравнительную характеристику атомов элементов подгруппы углерода, указав: а) электронные конфигурации,б) валентные возможности, в) наиболее характерные степени окисления. 2. Какой тип гибридизации АО углерода в молекулах: CH4, C2H6, C2H4, C2H2,CO2? 3. Дайте сравнительную характеристику свойств водородных соединений элементов подгруппы углерода. 4. Какие равновесия устанавливаются в водном растворе углекислого газа? 5. Можно ли получить нейтральный раствор, прибавив к раствору угольной кислоты строго эквивалентное количество щёлочи? 6. Углекислый газ пропускают через насыщенный раствор гидроксида кальция. Вначале образуется осадок, который затем исчезает. Составьте уравнения реакций. 7. Напишите в молекулярной и ионно-молекулярной форме уравнения взаимодействия с водой карбоната натрия, гидрокарбоната калия, карбоната аммония. Укажите реакцию среды. Р -ЭЛЕМЕНТЫ IIIA- группы. 1. Особенности строения атомов элементов главной подгуппы третьей группы.Как изменяются их свойства с увеличением порядкового номера элемента? Какие валентные состояния характерны для этих элементов? 2. Какие изменения претерпевает тетраборат натрия(бура) в водном растворе и при обработке соляной или серной кислотой? 3. Напишите уравнения реакций между алюминием и раствором щёлочи.Что произойдёт при постепенном добавлении к раствору алюминатов соляной кислоты? 4 Напишите уравнения реакций взаимодействия фосфида алюминия с: а)водой;б)серной кислотой; в)щёлочью. S-ЭЛЕМЕНТЫ. 1и 2 группы 1. Как изменяются радиусы и потенциалы ионизации атомов главных подгрупп 1и 2 группы Периодической системы Д.И. Менделеева с ростом порядкового номера элемента? Дайте объяснение наблюдаемым закономерностям на основе электронного строения атомов. 2. Как и почему изменяются основные свойства в рядах: 1)LiOH - CsOH, 2)Be(OH)2 – Ba(OH)2? 3. Опишите электронное строение и геометрическую структуру молекулы хлорида бериллия.
КЛАССИФИКАЦИЯ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
|
||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-16; просмотров: 338; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.23.103.14 (0.009 с.) |


 (моль/л).
(моль/л).
 0,1 = 10%
0,1 = 10% 
 6,4% ω (Cu2+) =
6,4% ω (Cu2+) =  2,56%
2,56%