

Мы поможем в написании ваших работ!
ЗНАЕТЕ ЛИ ВЫ?
|
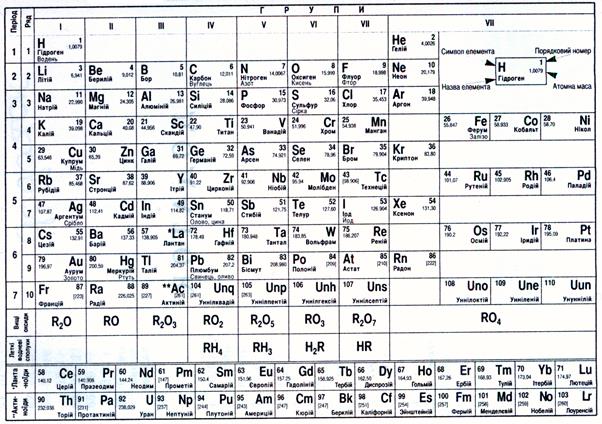
Періодична система хімічних елементів Д.І.Менделєєва
Таблиця 1
Таблиця відносних молекулярних мас неорганічних сполук
Таблиця 2
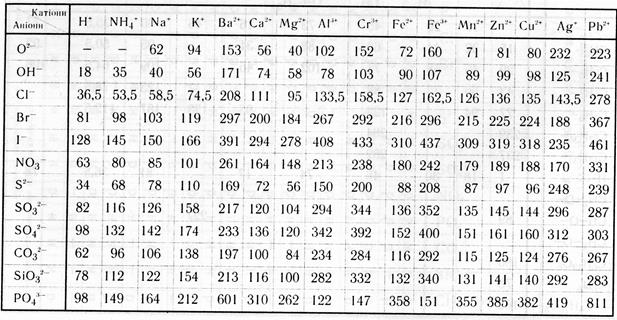
Таблиця 3.
Таблиця розчинності основ, кислот і солей у воді
|
Катіони
| Аніони
| |
OH-
| F-
| Cl-
| Br-
| I-
| S2-
| SO32-
| SO42-
| NO3-
| PO43-
| CO32-
| SiO32-
| CH3CОO--
| | H+
| р
| р
| р
| р
| р
| м
| м
| р
| р
| р
| м
| н
| р
| | NH4+
| р
| р
| р
| р
| р
| -
| р
| р
| р
| р
| р
| -
| р
| | Na+, K+
| р
| р
| р
| р
| р
| р
| р
| р
| р
| р
| р
| р
| р
| | Mg2+
| н
| м
| р
| р
| р
| -
| н
| р
| р
| н
| н
| н
| р
| | Ca2+
| м
| н
| р
| р
| р
| -
| н
| м
| р
| н
| н
| н
| р
| | Ba2+
| р
| м
| р
| р
| р
| р
| н
| н
| р
| н
| н
| н
| р
| | Al3+
| н
| м
| р
| р
| р
| -
| -
| р
| р
| н
| -
| н
| -
| | Cr3+
| н
| н
| р
| р
| н
| н
| -
| р
| р
| н
| -
| н
| -
| | Zn2+
| н
| м
| р
| р
| р
| н
| н
| р
| р
| н
| н
| н
| р
| | Mn2+
| н
| р
| р
| р
| р
| н
| н
| р
| р
| н
| н
| н
| р
| | Co2+,Ni2+
| н
| м
| р
| р
| р
| н
| н
| р
| р
| н
| н
| н
| р
| | Fe2+
| н
| м
| р
| р
| р
| н
| н
| р
| р
| н
| н
| н
| р
| | Fe3+
| н
| м
| р
| р
| -
| -
| -
| р
| р
| н
| -
| н
| -
| | Cd2+
| н
| р
| р
| р
| р
| н
| н
| р
| р
| н
| н
| н
| р
| | Hg2+
| -
| р
| р
| м
| н
| н
| н
| р
| р
| н
| -
| -
| р
| | Cu2+
| н
| р
| р
| р
| -
| н
| н
| р
| р
| н
| н
| н
| р
| | Ag+
| -
| р
| н
| н
| н
| н
| н
| м
| р
| н
| н
| н
| р
| | Sn2+
| н
| р
| р
| р
| м
| н
| -
| р
| -
| н
| -
| -
| -
| | Pb2+
| н
| н
| м
| м
| н
| н
| н
| н
| р
| н
| н
| н
| р
| | р– розчинна речовина - - речовина існує або розкладається водою
м – малорозчинна речовина н – нерозчинна речовина
| Таблиця 4.
Фізичні величини, їх позначення й одиниці
| Фізична величина
| Позначення
| Рівняння для визначення даної
фізичної величини
| Одиниця
| | Молярна маса
| M
| M = m/ν; M = 2 D H2
| кг/моль,
г/моль
| | Маса речовини
| m
| m = V ρ; m = Mν
| кг, г
| | Кількість речовини
| ν
| ν = m/M; ν = V/Vm; ν = N/NA;
| моль
| | Об’єм газу
| V
| V = m/ ρ; V = Vm ν
| м3, л
| | Молярний об’єм
| Vm
| Vm= V/ν;
Vm= M/ ρ;
| м3/моль, л/моль
| | Густина
| ρ
| ρ = m/;
ρ = M1/Vm
| кг/ м3, г/см3,
г/л, г/мл
| | Відносна
густина газу
| D
| D = ρ 1/ ρ 2; D= M1/M2
| -
|
Таблиця 5.
Масова частка у відсотках і густина розчинів деяких кислот при 180С
| Масова частка,
%
| Густина розчину, г/см3
| Масова частка,
%
| Густина розчину, г/см3
| | H2SO4
| HNO3
| HCl
| H2SO4
| HNO3
| |
| 1,027
| 1,022
| 1,019
|
| 1,439
| 1,340
| |
| 1,040
| 1,033
| 1,029
|
| 1,460
| 1,351
| |
| 1,055
| 1,044
| 1,039
|
| 1,482
| 1,362
| |
| 1,069
| 1,056
| 1,049
|
| 1,503
| 1,373
| |
| 1,083
| 1,068
| 1,059
|
| 1,525
| 1,384
| |
| 1,098
| 1,080
| 1,069
|
| 1,547
| 1,394
| |
| 1,112
| 1,093
| 1,079
|
| 1,571
| 1,403
| |
| 1,127
| 1,106
| 1,089
|
| 1,594
| 1,412
| |
| 1,143
| 1,119
| 1,100
|
| 1,617
| 1,421
| |
| 1,158
| 1,132
| 1,110
|
| 1,640
| 1,429
| |
| 1,174
| 1,145
| 1,121
|
| 1,664
| 1,437
| |
| 1,190
| 1,158
| 1,132
|
| 1,687
| 1,445
| |
| 1,205
| 1,171
| 1,142
|
| 1,710
| 1,453
| |
| 1,224
| 1,184
| 1,152
|
| 1,732
| 1,460
| |
| 1,238
| 1,198
| 1,163
|
| 1,755
| 1,467
| |
| 1,255
| 1,211
| 1,173
|
| 1,776
| 1,474
| |
| 1,273
| 1,225
| 1,183
|
| 1,793
| 1,480
| |
| 1,290
| 1,238
| 1,194
|
| 1,808
| 1,486
| |
| 1,307
| 1,251
| -
|
| 1,819
| 1,491
| |
| 1,324
| 1,264
| -
|
| 1,830
| 1,496
| |
| 1,342
| 1,277
| -
|
| 1,837
| 1,500
| |
| 1,361
| 1,290
| -
|
| 1,840
| 1,504
| |
| 1,380
| 1,303
| -
|
| 1,841
| 1,510
| |
| 1,399
| 1,316
| -
|
| 1,838
| 1,522
| |
| 1,419
| 1,328
| -
|
|
|
|
Таблиця 6.
Якісні реакції на деякі йони
| Йон
| Якісний йон чи реактив
| Ознаки реакції, її скорочене йонне рівняння
| | H+
| лакмус,
метилоранж
| забарвлюється в червоний колір
забарвлюється в червоний колір
| | Pb2+
| I-
S2-
| жовтий осад
чорний осад
| | Cu2+
| OH-
S2-
| голубий осад
чорний осад
| | Fe2+
| OH-
червона кров’яна сіль
K3[Fe(CN)6]
| зелений осад, який на повітрі стає бурим
Fe2+ + 2OH- = Fe(OH)2↓
темно-синій осад
3Fe2+ + 2[Fe(CN)6]3- = Fe3[Fe(CN)6]2↓
| | Fe3+
| OH-
жовта кров’яна сіль K4[Fe(CN)6]
калій роданід KSCN
(натрій, амоній)
| іржаво-корисневий осад Fe3+ + 3OH- = Fe(OH)3↓
синій осад
4Fe3+ + 3[Fe(CN)6]4- = Fe4[Fe(CN)6]3↓
темно-червоне забарвлення
Fe3+ + 3SCN- = Fe(SCN)3↓
| | Zn2+
| OH-
| білий осад, який розчиняється в надлишку лугу
Zn2+ + 2 OH- = Zn(OH)2↓
Zn(OH)2 + 2OH- = [Zn(OH)4]2-
| | Al3+
| OH-
| білий осад, який розчиняється в надлишку лугу
Al3+ + 3OH- = Al(OH)3↓
Al(OH)3 + OH- = [Al(OH)4]-
| | NH4+
| OH-
| запах амоніаку, вологий лакмусовий папірець синіє
NH4+ + OH- = NH3↑ + H2O
| | Ba2+
| SO42-
полум’я
| білий осад Ba2+ + SO42- = BaSO4↓
забарвлюється в жовто-зелений колір
| | Ca2+
| CO32-
полум’я
| білий осад Ca2+ + CO32- = CacO3↓
забарвлюється в цегляно-червоний колір
| | Na2+
| полум’я
| забарвлюється в жовтий колір
| | K+
| полум’я
| забарвлюється у фіолетовий колір
| | OH-
| фенолфталеїн
метилоранж
лакмус
| забарвлюється у малиновий колір
забарвлюється в жовтий колір
забарвлюється в синій колір
| | Cl-
| Ag+
H2SO4 (конц.)
| білий осад Ag+ + Cl- = AgCl↓
виділяється безбарвний газ з різким запахом (НСІ)
H+ + Cl- = HCl↑
| | Br-
| Ag+
H2SO4 (конц.)
| жовтуватий осад Ag+ + Br- = AgBr↓
виділяється SO2, а також утворюється Br2 бурого кольору 2Br- + 2H2SO4 = SO2↑ + Br2 + SO42- + 2H2O
| | I-
| Ag+
| жовтий осад Ag+ + I- = AgI↓
| | SO32-
| H+
| виділяється SO2 (запах палених сірників)
2H+ + SO32- = H2O + SO2↑
| | Йон
| Якісний йон чи реактив
| Ознаки реакції, її скорочене йонне рівняння
| | CO32-
| H+
| виділяється вуглекислий газ
2H+ + CO32- = H2O + CO2↑
| | NO3-
| H2SO4 (конц.) і мідь
| виділяється бурий газ NO2
2NO3- + 2 H2SO4 +Cu = 2SO42- +Cu2+ + 2NO2↑+ 2H2O
| | SiO32-
| H+
| драглистий осад 2H+ + SiO32- = H2SiO3↓
| | SO42-
| Ba2+
| білий осад Ba+ + SO42- = BaSO4↓
|
Таблиця 7.
|







