
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Закон равномерного распределения энергии по степеням свободы молекул. Основное уравнение молекулярно-кинетической теории газов.Содержание книги
Поиск на нашем сайте
Число степеней свободы – это число независимых величин с помощью которых может быть задано положение системы. (1 атом =3 ст., 2 атома =5ст. 3 атома=6ст.)
Закон Больцмана о равномерном распределении энергии по степеням свободы молекул: для статической системы, находящейся в состоянии термодинамического равновесия, на каждую поступательную и вращательную степени свободы приходится в среднем кинетическая энергия, равная КТ/2, а на каждую колебательную – КТ средняя энергия приходящаяся на одну степень свободы:
У одноатомной молекулы i = 3, тогда для одноатомных молекул:
для двухатомных молекул:
Таким образом, на среднюю кинетическую энергию молекулы, имеющей i-степеней свободы, приходится:
Молекулярно-кинетическая теория (сокращённо МКТ) — теория, рассматривающая строение вещества с точки зрения трёх основных приближенно верных положений: 1) все тела состоят из частиц, размером которых можно пренебречь: атомов, молекул и ионов; 2) частицы находятся в непрерывном хаотическом движении (тепловом); 3) частицы взаимодействуют друг с другом путём абсолютно упругих столкновений.
Основное уравнение молекулярно-кинетической теории идеального газа: Уравнение, связывающее макроскопическую величину – давление с микроскопическими величинами, характеризующими молекулы.
p – давление газа, n - концентрация молекул, m0 - масса молекулы. 30. Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнение Менделеева — Клапейрона) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
где · · · ·
31. Барометрическая формула — зависимость давления или плотности газа от высоты в поле тяжести.Для идеального газа, имеющего постоянную температуру
Распределением Больцмана
Выражение (5) называется распределением Больцмана для внешнего потенциального поля. Из него видно, что при постоянной температуре плотность газа больше там, где меньше потенциальная энергия его молекул. Закон распределения молекул идеального газа по скоростям, теоретически полученный Максвеллом в 1860 г. определяет, какое число dN молекул однородного (p = const) одноатомного идеального газа из общего числа N его молекул в единице объёма имеет при данной температуре Т скорости, заключенные в интервале от v до v + dv. Для вывода функции распределения молекул по скоростям f(v) равной отношению числа молекул dN, скорости которых лежат в интервале v ÷ v + dv к общему числу молекул N и величине интервала dv
32.Средний путь, проходимый молекулой за единицу времени, численно равен
Это число 33.Явления (процессы), возникающие в газах при отклонении их от равновесия, называются явлениями переноса Процесс установления внутри фаз равновесного распределения концентрации газовых молекул (а также молекул жидких и твёрдых тел) называется диффузией. Процесс направленного переноса внутренней энергии (выравнивание температуры) называется теплопроводностью. Процесс направленного переноса количества движения (связано с возникновением сил трения между слоями) называется внутренним трением. (Вязкостью)
34. Термодинамические процессы Любое состояние равновесия рабочего тела можно охарактеризовать его параметрами. Если в результате взаимодействия с окружающей средой хотя бы один из параметров изменяется, то происходит термодинамический процесс. Ранее было дано определение равновесного процесса, т.е. такого идеального процесса, когда в любой момент времени система находится в равновесии с окружающей средой. Работа Теплота
Виды теплоемкостей Удельная теплоёмкость
|
||||
|
Последнее изменение этой страницы: 2016-12-12; просмотров: 298; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.116.55 (0.005 с.) |







 — давление,
— давление, — молярный объём,
— молярный объём, — универсальная газовая постоянная
— универсальная газовая постоянная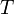 — абсолютная температура,К.
— абсолютная температура,К. и находящегося в однородном поле тяжести (во всех точках его объёма ускорение свободного падения
и находящегося в однородном поле тяжести (во всех точках его объёма ускорение свободного падения  одинаково), барометрическая формула имеет следующий вид:
одинаково), барометрическая формула имеет следующий вид:
 (5)
(5)
 . Поэтому средняя длина свободного пробега равна
. Поэтому средняя длина свободного пробега равна 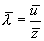 . Для определения
. Для определения  вычислим сначала среднее число соударений
вычислим сначала среднее число соударений  выбранной молекулы с другими молекулами за единицу времени. Будем считать, что молекула после соударения продолжает двигаться по прямой со средней скоростью движения
выбранной молекулы с другими молекулами за единицу времени. Будем считать, что молекула после соударения продолжает двигаться по прямой со средней скоростью движения 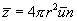
 , Дж.
, Дж.



