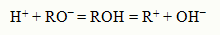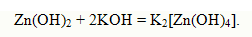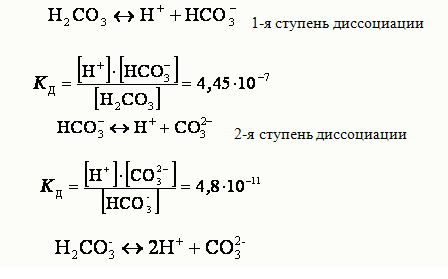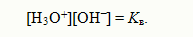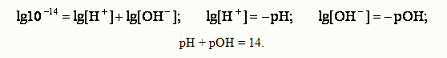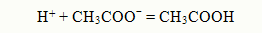Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лекция 2. Свойства растворов электролитов. Теория электролитической диссоциации. Ионное произведение воды.Содержание книги
Поиск на нашем сайте
Теории образования растворов В создании современной физико-химической теории растворов большую роль сыграли работы рус-ских ученых Д.И. Менделеева, И.А. Каблукова, Д.П. Коновалова и др. В конце 19 в. все растворы считались физическими смесями веществ, в которых отсутствуют взаи-модействия между растворенным веществом и растворителем. Химические явления при растворении были отмечены Д.И. Менделеевым. Взаимодействие молекул растворителя с растворенным веществом называется сольватацией, а образующиеся соединения – сольватами. Если растворителем является вода, то процесс называется гидратацией, а образующиеся соединения – гидратами. Образованием гидратов можно объяснить выделение теплоты при растворении. Образованием гидратов можно объяснить скачкообразное изменение свойств растворов при непрерывном изменении содержания растворенного вещества, что соответствует изменению состава продукта взаимодействия растворителя с растворенным веществом при увеличении содержания вещества в растворе. Явления, наблюдаемые при образовании растворов: увеличении е или уменьшение объема раствора, выделение или поглощение теплоты при растворении веществ, изменение окраски растворов, выпа-дение осадков. В 1887 году С. Аррениус сформулировал основные положения теории электролитической диссоциации, объясняющей поведение солей, кислот, оснований в водных растворах. Теория электролитической диссоциации В растворе электролита имеет место электролитическая диссоциация с образованием ионов. Эта идея была выдвинута С.Аррениусом. Диссоциация – самопроизвольный распад электролита на ионы. Положительно заряженные ионы называются катионами, отрицательно заряженные – анионами. Однако теория Аррениуса не учитывала всей сложности явлений в растворах. Она рассматривала ионы как независимые от растворителя частицы. Но ей противостояла гидратная теория Менделеева, в основе которой лежало представление о взаимодействии растворенного вещества с растворителем. Кажущееся противоречие обеих теорий было устранено предположением о гидратации ионов (И.А. Каблуков). Развитие этой идеи привело к объединению теорий Аррениуса и Менделеева. Распадаться на ионы могут только те молекулы, в которых химическая связь имеет достаточно высо-кую степень ионности. Чтобы ионы молекулы электролита меньше притягивались друг к другу, рас-творитель должен обладать высоким значением относительной диэлектрической проницаемо-сти (ε). Распаду электролита способствуют растворители с высоким значением ε. К ним относится вода (ε = 80,1), уксусная кислота (ε = 57), этиловый спирт (ε = 25). Вещества могут распадаться на ионы и при расплавлении, когда энергии теплового движения оказывается достаточно для разрыва полярных связей. Таким образом, электролитическая диссоциация – это процесс распада молекул веществ на ионы под действием полярных молекул растворителя, а также при их расплавлении. В зависимости от структуры растворяющегося вещества в безводном состоянии его диссоциация протекает по-разному. Наиболее типичны два случая. В одном - диссоциация протекает при раство-рении веществ с ионной структурой, в другом - при растворении веществ с полярной связью. Когда кристалл соли с ионной связью попадает в воду, то расположенные на его поверхности ионы притягивают к себе полярные молекулы воды (это ион дипольное взаимодействие). Ионы вещества и молекулы воды притягиваются друг к другу противоположными полюсами. Ионы испытывают тепловые колебания и толчки со стороны молекул воды и этого достаточно, чтобы ионы перешли из кристалла в раствор. Вслед за первым слоем ионов в раствор переходит следующий слой и таким образом происходит растворение кристаллических веществ с ионной связью. Полярные молекулы растворяющихся веществ притягивают к себе полярные молекулы воды за счет диполь – дипольного взаимодействия, вызывая расхождение полюсов молекулы вещества. Происхо-дит поляризация молекулы, которая совместно с колебательным движением атомов и тепловым дви-жением молекул воды приводит к распаду полярной молекулы на ионы. Образующиеся в обоих слу-чаях ионы гидратируются. При этом ион водорода Н+ (протон) прочно связывается с молекулой во-ды в ион гидроксонияН3О+. Схематически это можно представить уравнением:
В результате этого процесса общая пара электронов молекулы НCl остается у атома хлора, который превращается в ион Cl‾, а протон, внедряясь в электронную оболочку кислорода молекулы во-ды, образует ион гидроксония Н3О+. Протон водорода благодаря малым размерам и электростатическому полю высокой напряженности, а также отсутствию у него электронной оболочки, в водных растворах существует только в виде комплексов с молекулами воды Н3О+ окруженных другими молекулами воды. Перешедшие в раствор ионы остаются связанными с молекулами воды и образуют гидраты ионов. В случае другого растворителя эти соединения называются сольватами ионов. Но в уравнениях диссоциации обычно пишут формулы ионов, а не их гидратов или сольватов. Степень диссоциации. Сила электролита В растворах некоторых электролитов диссоциирует лишь часть молекул. Для количественной оценки процесса диссоциации было введено понятие степени электролитической диссоциации. Отношение числа молекул, диссоциированных на ионы, к общему числу молекул растворенного электролита называется степенью диссоциации a. По степени диссоциации в растворах все электролиты делятся на две группы. К первой относят электролиты, степень диссоциации которых в растворах равна единице и почти не зависит от концентрации раствора. Их называют сильными электролитами. К сильным электролитам в водных растворах принадлежит подавляющее большинство солей, щелочей, а также некоторые кислоты. В водных растворах они диссоциируют практически полностью. Истинная степень их диссоциации близка к 1 (100%), хотя экспериментально наблюдаемая (кажущаяся) находится в пределах от 30 % и выше. Электролиты, степень диссоциации которых в растворе меньше единицы и уменьшается с ростом концентрации, называют слабыми электролитами. Слабые электролиты диссоциируют на ионы в очень малой степени, в растворах они находятся, в основном, в недиссоциированном состоянии; для них α < 3%. К ним относят воду, ряд кислот, основанияр-, d- и f- элементов. Между этими группами нет четкой границы, одно и тоже вещество в одном растворителе является сильным, а в другом – слабым электролитом. Согласно теории электролитической диссоциации, кислотой является электролит, кото-рый диссоциирует с образованием ионов Н+. Присутствием ионов Н+ можнообьяснить кислый вкус, способность изменять цвет индикаторов, взаимодействовать с основаниями а также с некоторыми металлами с выделением водорода. Сильные кислоты (HCl, HNO3, H2SO4 и др.) диссоциируют практически полностью, у слабых ки-слот диссоциирована лишь часть молекул. О силе кислот можно судить и по константе диссоциации: чем она больше, тем более диссоциирована кислота. Электролит, диссоциирующий с образованием ионов ОН‾, называется основанием. Наличием ио-нов ОН‾ в растворе объясняется своеобразный "мыльный " вкус, способность изменять цвета инди-каторов иначе, чем кислотами, способность взаимодействовать с кислотами с образованием солей. Сильные основания (LiOH, NaOH, KOH и др.) диссоциируют полностью, у слабых основа-ний диссоциирована лишь часть молекул. Существуют электролиты, которые могут диссоциировать как кислоты, и как основания:
Такие электролиты называются амфотерными электролитами. Амфотерность электролитов объяс-няется малым различием прочности связей R - H и О - Н. Примеромамфотерного электролита может быть гидроксид цинка:
При взаимодействии гидроксида цинка с азотной кислотой образуется нитрат цинка:
при взаимодействии же с гидроксидом калия – гидроксоцинкат калия:
К амфотерным электролитам относятся гидроксиды алюминия Al(OH)3, свинца Pb(OH)2, олова Sn(OH)2. Соли можно определить как электролиты, которые при растворении в воде диссоциируют с образо-ванием положительных ионов отличных от ионов водорода и отрицательных ионов, отличных от гидроксид-ионов. Соли тем лучше диссоциируют, чем меньше заряды ионов, образующих соль. Константа диссоциации В растворах слабых электролитов процесс диссоциации протекает обратимо и, следовательно к нему можно применить закон действующих масс и записать константу равновесия слабого электролита, она называется константа диссоциации:
КД зависит от природы электролита и растворителя, от температуры и не зависит от концентрации раствора. Чем выше КД, тем легче электролит диссоциирует. Многоосновные кислоты диссоциируют ступенчато:
Суммарному равновесию отвечает суммарная константа диссоциации КД
При ступенчатой диссоциации веществ распад по последующей ступени всегда происходит в мень-шей степени, чем по предыдущей. Соблюдается неравенство: КД1 > КД2 > КД3…. Это объясняется тем, что энергия необходимая для отрыва иона от нейтральной молекулы меньше, чем при диссоциации по каждой следующей ступени. Ионное произведение воды Изучение очищенной от примесей воды показало, что она обладает электропроводностью, повы-шающейся с ростом температуры. Это можно объяснить небольшой самодиссоциацией воды на ионы водорода и гидроксид-ионы (автопротолизом):
По величине электрической проводимости чистой воды можно вычислить концентрацию ио-нов гидроксония Н3О+ и гидроксид-ионов в воде. При 25º С она равна 10‾7 моль/л. Константа диссоциации воды может быть вычислена по уравнению
Перепишем это уравнение следующим образом:
Поскольку степень диссоциации воды очень мала, то концентрация недиссоциированных моле-кул Н2О в воде равна общей концентрации воды.
Полученное уравнение показывает, что для воды и разбавленных водных растворов при неизменной температуре произведение концентраций ионов гидроксония и гидроксид-ионов есть величина по-стоянная. Она называется ионным произведением воды. Численное ее значение можно получить, если подставить концентрации ио-нов гидроксония и гидроксид-ионов. В чистой воде при 25ºС [H3O+] = [OH‾] = 1•10‾7 моль/л. Поэтому для указанной температуры:
Диссоциацию воды часто записывают в более простом виде:
Кв – не зависит от концентрации ионов Н+ и ОНˉ. Так, если в воду добавить кислоты, концентрация ионов Н+ резко возрастет. Тогда за счет подавления диссоциации воды равновесие этого процесса сместится влево и концентрация ионов ОНˉ уменьшится, но ионное произведение воды останется неизменным. Водородный показатель рН В соответствии теорией электролитической диссоциации ионы Н+ являются носителями кислотных свойств, а ионы ОНˉ - носителями основных свойств. раствор будет нейтральным, когда
кислым, когда
и щелочным, когда
Для характеристики кислотности (щелочности) среды введен специальный параметр – водородный показатель, или pH. Водородным показателем, или pH, называется взятый с обратным знаком десятичный логарифм концентрации водородных ионов в растворе:
Из ионного произведения следует:
Таким образом, зная рОН, можно легко рассчитать рН, и наоборот, по известному значе-нию рН легко определяется рОН. Величина рН может служить критерием силы кислоты или основания. В ряду кислот наиболее силь-ной будет та, у которой при одинаковой молярной концентрации, концентрация ионов Н+ выше (рН ниже). Водородный показатель имеет важное значение для жизнедеятельности организма, так в нор-ме рН сыворотки крови равен 7,40, слюны – 6,35 - 6,85, желудочного сока 0,9 – 1,1.Отклонение рН от нормальных значений приводит к расстройству деятельности организма. Буферные растворы Растворы, рН которых относительно мало изменяется при добавлении небольших количеств ки-слоты или основания, называются буферными. Они обычно содержат слабую кислоту и ее соль, например СН3СООН + СН3СООNa или слабое ос-нование и его соль, например, NH4OH + NH4Cl. В растворе кислота и соль диссоциируют:
При добавлении кислоты в раствор ионы водорода связываются в слабую кислоту
При добавлении основания в раствор ОНˉ ионы связываются в слабый электролит Н2О
Образование слабых электролитов при добавлении в буферные растворы кислоты или основания и обусловливает устойчивость рН. Вопросы и задания для самоподготовки: 1.Что такое сольваты, сольватация? 2.Что такое гидраты, гидратация? 3.Перечислить основные положения теории электролитической диссоциации С.Аррениуса. 4.Степень диссоциации, как показатель силы электролитов. 5.Что такое ионное произведение воды? 6.Понятие водородного показателя, его роль в определении среды растворов.
|
||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 760; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.32.252 (0.008 с.) |