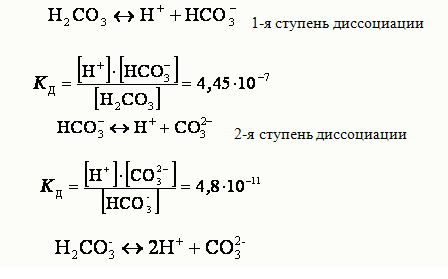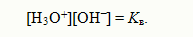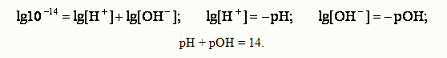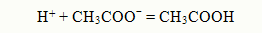Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лекция 1. Общая характеристика растворов. Растворимость газов, жидкостей, твердых тел. Диффузия. Осмос.Содержание книги
Поиск на нашем сайте
Коллоидная химия Константа диссоциации В растворах слабых электролитов процесс диссоциации протекает обратимо и, следовательно к нему можно применить закон действующих масс и записать константу равновесия слабого электролита, она называется константа диссоциации:
КД зависит от природы электролита и растворителя, от температуры и не зависит от концентрации раствора. Чем выше КД, тем легче электролит диссоциирует. Многоосновные кислоты диссоциируют ступенчато:
Суммарному равновесию отвечает суммарная константа диссоциации КД
При ступенчатой диссоциации веществ распад по последующей ступени всегда происходит в мень-шей степени, чем по предыдущей. Соблюдается неравенство: КД1 > КД2 > КД3…. Это объясняется тем, что энергия необходимая для отрыва иона от нейтральной молекулы меньше, чем при диссоциации по каждой следующей ступени. Ионное произведение воды Изучение очищенной от примесей воды показало, что она обладает электропроводностью, повы-шающейся с ростом температуры. Это можно объяснить небольшой самодиссоциацией воды на ионы водорода и гидроксид-ионы (автопротолизом):
По величине электрической проводимости чистой воды можно вычислить концентрацию ио-нов гидроксония Н3О+ и гидроксид-ионов в воде. При 25º С она равна 10‾7 моль/л. Константа диссоциации воды может быть вычислена по уравнению
Перепишем это уравнение следующим образом:
Поскольку степень диссоциации воды очень мала, то концентрация недиссоциированных моле-кул Н2О в воде равна общей концентрации воды.
Полученное уравнение показывает, что для воды и разбавленных водных растворов при неизменной температуре произведение концентраций ионов гидроксония и гидроксид-ионов есть величина по-стоянная. Она называется ионным произведением воды. Численное ее значение можно получить, если подставить концентрации ио-нов гидроксония и гидроксид-ионов. В чистой воде при 25ºС [H3O+] = [OH‾] = 1•10‾7 моль/л. Поэтому для указанной температуры:
Диссоциацию воды часто записывают в более простом виде:
Кв – не зависит от концентрации ионов Н+ и ОНˉ. Так, если в воду добавить кислоты, концентрация ионов Н+ резко возрастет. Тогда за счет подавления диссоциации воды равновесие этого процесса сместится влево и концентрация ионов ОНˉ уменьшится, но ионное произведение воды останется неизменным. Водородный показатель рН В соответствии теорией электролитической диссоциации ионы Н+ являются носителями кислотных свойств, а ионы ОНˉ - носителями основных свойств. раствор будет нейтральным, когда
кислым, когда
и щелочным, когда
Для характеристики кислотности (щелочности) среды введен специальный параметр – водородный показатель, или pH. Водородным показателем, или pH, называется взятый с обратным знаком десятичный логарифм концентрации водородных ионов в растворе:
Из ионного произведения следует:
Таким образом, зная рОН, можно легко рассчитать рН, и наоборот, по известному значе-нию рН легко определяется рОН. Величина рН может служить критерием силы кислоты или основания. В ряду кислот наиболее силь-ной будет та, у которой при одинаковой молярной концентрации, концентрация ионов Н+ выше (рН ниже). Водородный показатель имеет важное значение для жизнедеятельности организма, так в нор-ме рН сыворотки крови равен 7,40, слюны – 6,35 - 6,85, желудочного сока 0,9 – 1,1.Отклонение рН от нормальных значений приводит к расстройству деятельности организма. Буферные растворы Растворы, рН которых относительно мало изменяется при добавлении небольших количеств ки-слоты или основания, называются буферными. Они обычно содержат слабую кислоту и ее соль, например СН3СООН + СН3СООNa или слабое ос-нование и его соль, например, NH4OH + NH4Cl. В растворе кислота и соль диссоциируют:
При добавлении кислоты в раствор ионы водорода связываются в слабую кислоту
При добавлении основания в раствор ОНˉ ионы связываются в слабый электролит Н2О
Образование слабых электролитов при добавлении в буферные растворы кислоты или основания и обусловливает устойчивость рН. Вопросы и задания для самоподготовки: 1.Что такое сольваты, сольватация? 2.Что такое гидраты, гидратация? 3.Перечислить основные положения теории электролитической диссоциации С.Аррениуса. 4.Степень диссоциации, как показатель силы электролитов. 5.Что такое ионное произведение воды? 6.Понятие водородного показателя, его роль в определении среды растворов. Коллоидная химия Лекция 1. Общая характеристика растворов. Растворимость газов, жидкостей, твердых тел. Диффузия. Осмос.
Растворимость газов, жидкостей, твердых тел. Диффузия. Осмос. 1.Растворы – гомогенные (однофазные) системы, состоящие из растворенных веществ, растворителей и продуктов их взаимодействия. Из - за непостоянства состава растворов и неприменимости к ним основных химических законов растворы приближены к механическим смесям. С химическими соединениями их роднит однородность, химический состав веществ, в них находящихся. Растворы по агрегатному состоянию делятся на три группы: газообразные (воздух), жидкие (водные и спиртовые растворы), твердые (стекло, сплавы металлов). Выражение концентрации: 1) массовая доля (процентная концентрация)- отношение массы вещества к общей массе раствора, умноженное на 100%: w=m(в)/m(р)х100%; 2) молярная концентрация- количество молей растворенного раствора, содержащегося в 1л вещества: См= n(в) х1000/V(р); (моль/л) 3) нормальная концентрация – число эквивалентов вещества, содержащихся в 1л раствора: СN=m(в)х1000/ЭхV(р) (г/экв.л). 2.Растворимость – процесс взаимодействия частиц растворенного вещества и растворителя, который может сопровождаться выделением или поглощением энергии, изменением объема раствора. Д.И.Менделеев установил, что при растворении протекают одновременно два процесса: физический – равномерное распределение частиц растворяемого вещества по всему объему раствора, и химический – взаимодействие растворителя и растворяемого вещества. Д.И.Менделеев создал гидратную теорию растворов, согласно которой между частицами растворенного вещества и молекулами воды образуются химические соединения – гидраты, а сам процесс называется гидратацией. В случае если растворителем является не вода, то соединения называются сольватами, а процесс – сольватацией. А) Растворимость газов: газы способны растворяться в жидкостях лишь до некоторого предела, соответствующего насыщению раствора. На растворимость газов оказывают влияние в жидкостях оказывают влияние природа газов и жидкости, температура, давление. Газы, молекулы которых имеют неполярную связь, лучше растворяются в неполярных растворителях (толуоле, эфире). В полярных растворителях (вода, этиловый спирт) лучше растворяются газы с полярным типом связи. Закон Генри выражает зависимость растворимости газов от давления: растворимость данного газа в жидкости пропорциональна его давлению над жидкостью: С= К х р, где С- концентрация газа в жидкости; К – коэффициент пропорциональности, зависящий от природы газа; р – давление газа над раствором. Следствие из закона Генри: объем растворенного газа не зависит от внешнего давления, т.к. при увеличения давления в одинаковое число возрастают концентрации растворенного газа и газа над раствором: К= Сж/Сг, где К – коэффициент пропорциональности; Сж – концентрация газа в жидкости; Сг – концентрация газа над раствором. Б) Растворимость жидкостей зависит от природы жидкостей, различаются три вида систем: - системы, состоящие из смешивающихся друг с другом в любых соотношениях жидкостей, при этом образуется однородный раствор (вода и этиловый спирт, вода и уксусная эссенция); - системы, в состав которых входят жидкости, обладающие ограниченной растворимостью друг в друге (вода и анилин). При растворении данных жидкостей в итоге образуется двухслойная гетерогенная система, в которой при повышении температуры исчезает граница слоев. Такая температура носит название критической температуры растворения. Критическая температура растворения используется для аналитических определений продуктов (маргарин и сливочное масло). - системы из практически нерастворимых друг в друге жидкостей (вода и масло). Закон распределения: отношение концентраций вещества, распределяющегося между двумя несмешивающимися жидкостями, является для каждой температуры величиной постоянной, не зависящей от абсолютных и относительных количеств каждого из растворителей и распределяемого вещества. С1/С2=К, где С1- концентрация вещества в первой жидкости, С2 – концентрация вещества во второй жидкости; К – коэффициент распределения. В) Процесс растворения твердых веществ в жидкости состоит в разрушении кристаллической решетки и диффузии вещества в объем. Вопросы и задания для самоподготовки: 1. Растворы, классификация и примеры растворов по агрегатному состоянию. 2. Общее и различие растворов со смесями и химическими веществами. 3. Растворимость газов. Закон Генри. Применение процесса растворимости при приготовлении и хранении газированных напитков. 4. Растворимость жидкостей, понятие критической температуры. Примеры использования знаний растворимости жидкостей в технологическом процессе. 5. Растворимость твердых тел. 6. Понятие насыщенного, ненасыщенного, перенасыщенного растворов. 7. Что такое диффузия, осмос. Привести примеры. 8. Понятие криоскопии и эбуллиоскопии.
|
||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 557; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.119.149 (0.01 с.) |