
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Приклади розв'язання типових задачСодержание книги
Поиск на нашем сайте
Приклад 1. При взаємодії 24 г речовини з 19,6 г фосфатної кислоти утворилося 32,8 г солі. Обчисліть молярну масу еквівалентів речовини та солі, що утворилася. Розв'язання 1. За законом еквівалентів:
2. За законом еквівалентів:
Відповідь: молярна маса еквівалентів речовини 40 г/моль; молярна маса еквівалентів солі 54,67 г/моль.
Приклад 2. Складіть електронну формулу атома елементу із порядковим номером 22. Зобразіть його електронно-графічну формулу. Розв'язання Електронні формули відображають розподіл електронів в атомі по енергетичних рівнях, підрівнях. Електронна конфігурація позначається групами символів n l x, де n – головне квантове число, l – орбітальне квантове число (s, p, d, f), х – кількість електронів на даному підрівні (орбіталі). Послідовність заповнення підрівнів така: 1s – 2s – 2p – 3s – 3p – 4s – 3d – 4p – 5s – 4d – 5p – 6s – (5d1) – 4f – 5d – 6p – 7s – (6d1-2) – 5f – 6d – 7p. Кількість електронів в атомі дорівнює його порядковому номеру в таблиці Д.І. Менделєєва. Для елементу № 22 (Титан) електронна формула має вид: 22Ti 1s2 2s2 2p6 3s2 3p6 3d2 4s2 Титан – d-елемент Електронно-графічні формули відображають схеми розміщення електронів у квантових комірках, які є схематичним зображенням атомних орбіталей. В кожній квантовій комірці може бути не більше 2 електронів із протилежними спінами (принцип Паулі). Орбіталі даного підрівня заповнюються спочатку по одному електрону з однаковими спінами, а потім по другому електрону з протилежними спінами (правило Гунда): Ti
Приклад 3. Скільки неспарених електронів у не збудженого атома Хлору? Приведіть графічну формулу. Запишіть електронну формулу йону Хлору із зарядом 1–. Розв’язання а) Хлор стоїть у ІІІ-му періоді, сьомій групі періодичної системи Д. І. Менделєєва. Електронна конфігурація зовнішнього енергетичного рівня атому Хлору: 3s23p5, а графічна формула:.
3s2 3p5 Хлор має 1 неспарений електрон. Сl– – йон має надлишок електронів у порівнянні з атомом Хлору. Електронна формула йону Сl–: 1s22s22p63s23p6. Приклад 4. Чи можлива реакція за стандартних умов Cu(к) +ZnO(к) = CuO(к) + Zn(к)? Розв’язання Розрахуємо енергію Гіббса реакції за законом Гесса: ΔG = ΔG(CuO(к)) – ΔG(ZnO(к)) Знаходимо із додатку 1 стандартні енергії Гіббса для речовин: ΔG(ZnO(к)) = –320,7 кДж/моль; ΔG(CuO(к)) = –129,9 кДж/моль. Обчислюємо: ΔG = –129,9 – (–320,7) = 190,8 кДж/моль. Відповідь: DG > 0, реакція не протікає в прямому напрямку за стандартних умов. Приклад 5. Як впливатиме підвищення температури і тиску на стан рівноваги в таких реакціях:
а) 2H2О(г) = 2Н2(г) + О2(г), б) Н2(г) + І2(г) = 2НІ(г), Розв’язання а) Пряма реакція супроводжується вбиранням теплоти, тому нагрівання сприяє прямій реакції і рівновага зміститься в бік продуктів. У ході прямої реакції збільшується кількість молекул у газовій фазі, тому тиск сприяє зворотній реакції і рівновага зміщується в бік вихідних речовин. б) У процесі нагрівання рівновага зміститься в бік продуктів. Тиск не впливає на стан рівноваги, оскільки в ході реакції кількість молекул у газовій фазі не змінюється. Приклад 6. В 1 кг води розчинено 55 г сульфатної кислоти. Густина розчину дорівнює 1,220 г/мл. Знайти: а) масову частку сульфатної кислоти у розчині; б) молярну концентрацію кислоти; в) моляльну концентрацію кислоти; г) молярну концентрацію еквівалентів кислоти (нормальність); д) молярну долю кислоти у розчині. Розв’язання а) Масову частку знаходимо за формулою: ω ω Обчислюємо: ω б) Молярну концентрацію кислоти знаходимо за формулою:
в) Моляльну концентрацію кислоти знаходимо за формулою:
г) Молярну концентрацію еквіваленту кислоти знаходимо за формулою:
Молярну долю кислоти у розчині знаходимо за формулою: Відповідь: а) 5,2%; б) 0,65 моль/л; в) 0,56 моль/л; г) 1,5 моль/л; д) 1%.
*1000 – перерахунок мілілітрів у літри ** Приклад 7. При 315 К тиск насиченої пари над водою дорівнює 8,2 кПа. На скільки зменшиться тиск пари при тій же температурі, якщо у 472 г води розчинити 28 г сахарози (С12Н22О11). Розв’язання 1) Визначимо молярну частку води де
2) Обчислимо тиск насиченої пари розчинника за законом Рауля: р1 = N·р0, де р1 – тиск насиченої пари розчинника, р0 – тиск насиченої пари розчинника над розчинником. р1 = 0,99·8,2 кПа = 8,118 кПа 3) Розрахуємо різницю тисків Δр = (р0 – р1) = 8,2 кПа – 8,118 кПа = 0,082 кПа. Відповідь: тиск насиченої пари зменшиться на 0,082 кПа. Приклад 8. Електроліз розчину сульфатної кислоти проводили 1,5 години при силі струму 6 А. Обчисліть масу води, що розклалася, об'єм кисню та водню (н.у.). Розв’язання Масу води, що розклалась, знаходимо із рівняння закону Фарадея: m = ME I t / F При обчислені об ’ ємів газів представимо рівняння закону Фарадея у вигляді: V=VE I t / F, де V – об ’ єм газу, л; VE – молярний об ’ єм еквівалентів, л/моль. Оскільки при нормальних умовах молярний об ’ єм еквівалентів водню дорівнює 11,2 л/моль, а кисню – 5,6 л/моль і вважаючи, що 1,5 години = 5400 секунд, ME(H2O) = 9 г/моль, обчислюємо: 1) 2) 3)
Відповідь: маса води, що розклалась, 3,02 г; об'єм кисню 1,86 л; об'єм водню 3,76 л.
ОСНОВНІ ФОРМУЛИ ТА ЗАКОНИ Ø Закон еквівалентів: Ø Закон дії мас: для реакції aА + bВ → dD швидкість виражається рівнянням v = k×сa(A)×сb(B), де с(A), с(B)– молярні концентрації речовин (моль/л), k–константа швидкості. Ø Формула Вант-Гоффа: ( Ø Принцип Ле-Шательє: якщо на систему, що знаходиться у стані рівноваги, подіяти ззовні деяким фактором (концентрація, температура, тиск), то рівновага зміщується в бік тої реакції, що послаблює цей вплив Ø Молярна частка: Ø Масова частка: Ø Об’ємна частка: Ø Молярна концентрація: Ø Моляльна концентрація:
Ø Молярна концентрація еквівалентів: де ME – молярна маса еквівалентів розчиненої речовини,
Ø Осмотичний тиск (рівняння Вант-Гоффа):
Ø Зниження тиску пари розчинника над розчином, Dр (закон Рауля):
Ø Зниження температури замерзання і підвищення температури кипіння розчинів неелектролітів відносно чистого розчинника
де Ккр – кріоскопічна стала розчинника, КЕ – ебуліоскопічна стала розчинника, Сm – моляльна концентрація розчину.
Для розчинів електролітів в рівняння, що описують колігативні властивості неелектролітів, вводять поправочний коефіцієнт Вант-Гоффа (і): Ø i = 1+ α (ν-1), де α - ступінь дисоціації; ν - кількість йонів на які розпадається електроліт.
Ø Водневий показник рН = –lg C(H+), рН + рОН = 14
Ø Формула Нернста (потенціал електроду І роду):
Ø Електрорушійна сила (ЕРС) гальванічного елементу: ЕРС = Ø Закон Фарадея: де m – маса речовини, що утворилась чи піддалася перетворенню, г; ME –молярна маса еквівалентів речовини, г/моль; I – сила струму, А; t – час, с; F – стала Фарадея (96485» 96500 Кл/моль), ДОДАТКИ
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 258; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.94.180 (0.009 с.) |


 г/моль.
г/моль. ;
; 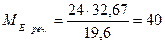 г/моль.
г/моль.

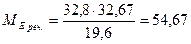 г/моль.
г/моль.
 > 0
> 0 ,
,  =
=  +
+ 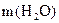 .
. .
. .
.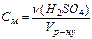 ;
;  ;
; ; звідси
; звідси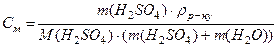 ;
;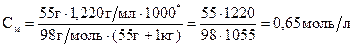 ;
;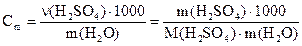 ;
;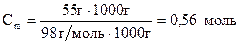 в 1000
в 1000 
 .
. ;
; моль/л.
моль/л.
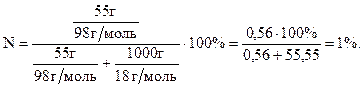

 , де Е – кількість еквівалентів.
, де Е – кількість еквівалентів.
 – кількість молів води,
– кількість молів води,  – кількість молів сахарози,
– кількість молів сахарози, 
 г;
г; л;
л; л.
л.

 –температурний коефіцієнт)
–температурний коефіцієнт) ; х1 + х2 = 1.
; х1 + х2 = 1. 100 %;
100 %; 100 %.
100 %. (моль/л)
(моль/л)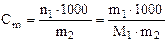 (моль/кг)
(моль/кг) (моль/л),
(моль/л),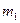 (
(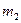 ) – маса розчиненої речовини (розчинника), г;
) – маса розчиненої речовини (розчинника), г;  – молярна маса розчиненої речовини, г/моль; V – об'єм розчину, л; n1(n2) – кількість молів розчиненої речовини (розчинника).
– молярна маса розчиненої речовини, г/моль; V – об'єм розчину, л; n1(n2) – кількість молів розчиненої речовини (розчинника).

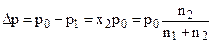
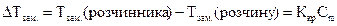
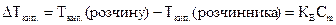 ,
, ,
, 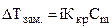 ,
,  ,
,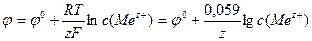
 к –
к –  , m = ME I t / F,
, m = ME I t / F, – кількість електронів, яка приймає участь в елементарному акті електрохімічної реакції.
– кількість електронів, яка приймає участь в елементарному акті електрохімічної реакції.


