
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Дослід 4. Відновні властивості металів.Содержание книги
Поиск на нашем сайте Мідь належить до малоактивних металів. Вивчіть взаємодію міді з різними кислотами. Візьміть чотири пробірки, покладіть до них по шматочку міді. У першу пробірку додайте розведену, а у другу концентровану сірчану кислоту. Розчин підігрійте. Що відбувається? Аналогічні досліди зробить з розчиненою та концентрованою азотною кислотою. Напишіть рівняння реакцій та зробіть висновок про відновно-окислювальні властивості металів.
Контрольнізапитання 1. Дайте визначення окисно-відновним реакціям. 2. Що в окисно-відновник реакціях є окисником та відновником? 3. Назвіть типи окисно-відновник реакцій. 4. Методом електронного балансу підберіть коефіцієнти в схемах окисно-відновних реакцій: a) KClO3 + KI + H2SO4 → KCl + I2 + K2SO4 + H2O b) KMnO4 + NO + H2O → MnO2 + NO2 + KOH c) K2Cr2O7 + (NH4)2S + H2O → Cr(OH)3 + S + NH3 + KOH d) Bi2S3 + HNO3 → Bi(NO3)3 + NO + S + H2O e) Zn + HNO3 → Zn(NO3)2 + NO + H2O
ХІМІЧНІ ДЖЕРЕЛА СТРУМУ
Теоретична частина Хімічні джерела струму (ХДС) – це такі пристрої, в яких при протіканні хімічних реакцій утворюється струм. Ці пристрої бувають 3-х типів: одноразової дії, багатократної дії, безперервної дії. В результаті взаємодії метал-розчин електроліту,метал набуває електричний заряд; на межі виникає подвійний електричний шар і виникає різниця ел. потенціалів.
R – газова постійна; R=8,31 Т – температура по Кельвіну; n – ступінь окислення металу (електрони); F – число Фарадея; F=96500 кл. Катод – електрод, на якому відбувається процес відновлення. Анод – електрод, на якому відбувається процес окислення.
Лабораторна робота № 9 Хімічні джерела струму (гальванічні елементи) Правила техніки безпеки: дотримуватися загальних правил безпеки при роботі в хімічних лабораторіях. Необхідні прилади і реактиви: 2 стаканчика, цинкова пластинка, мідна пластинка, електролітичний місток, гальванометр, 1М розчини сульфату цинку та сульфату міді, 0,01М розчин сульфату цинку. Виконання дослідів Дослід1.Складання мідно-цинкового гальванічного елементу
ZnSO4 CuSO4 1–микростаканчики; 2 – електролитичний місток; 3 – гальванометр. Рисунок 7.1 – Схема гальванічного елементу Занурити цинкову пластинку в стаканчик з 1М раствором сульфату цинку, а мідну пластинку в стаканчик з 1М розчином сульфату міді. З'єднати розчини електролітним містком, а до пластинок підключити гальванометр. Спостерігати відхилення стрілки гальванометра, яке обумовлене виникненням електричного струму унаслідок різних значень стандартних електродных потенціалів електродів. Зміряти е.д.с. гальванічного елементу. Розімкнути ланцюг. Скласти схему гальванічного елементу. Зробити малюнок приладу. Написати рівняння хімічних реакцій, що протікають на електродах, і сумарне рівняння хімічної реакції, в результаті якої виникає електричний струм. Порівняти теоретичне значення е.д.с. гальванічного елементу з практичним. Пояснити причину відмінності цих значень.
|
||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 295; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.33 (0.007 с.) |

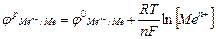
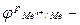 рівноважний електродний потенціал;
рівноважний електродний потенціал;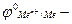 стандартний електродний потенціал;
стандартний електродний потенціал;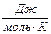
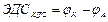
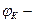 эл. потенціал катода.
эл. потенціал катода.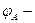 эл. потенціал анода.
эл. потенціал анода.
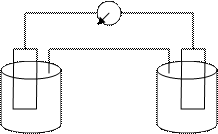 Zn (анод) Cu (катод)
Zn (анод) Cu (катод)




