
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Однакові об 'єми різних газів за одних і тих самих умов містять однакове число молекул.Содержание книги
Поиск на нашем сайте
Отже, маси однакових об'ємів двох різних газів m1і m2відносяться між собою як молекулярні або молярні маси цих газів, тобто
де Мr1 і Мr2, М1 і М2,– відповідно відносні молекулярні і молярні маси двох газів. Відношення m1/m2показує, у скільки разів один газ важчий за інший за одних і тих самих умов. Це відношення називають відносною густиною першого газу за другим і позначають літерою D:
звідки Mrl = DMr2. Молекулярна маса газу дорівнює добутку його густини відносно іншого газу на молекулярну масу цього газу. Густини різних газів часто визначають відносно водню як найлегшого з газів. Тоді молекулярну масу досліджуваного газу можна обчислити за формулою:
де DH2 – густина досліджуваного газу за воднем; 2 – молекулярна маса водню. Молекулярну масу газу обчислюють також за його густиною за киснем (Мr = 32) або за повітрям (середня молекулярна маса повітря Мrпов = 29):
Вимірювання об'ємів різних газів дало змогу встановити, що один моль будь-якого газу за нормальних умов займає в середньому об'єм 22,4 л або 0,0224 м3/моль. Цей об'єм називають молярним об'ємом газу. Молярну масу речовини, а отже, і відносну молекулярну масу можна визначити, користуючись поняттям про молярний об'єм речовини в газуватому стані. Для цього достатньо знати об'єм V0 даної маси газу mза нормальних умов і обчислити масу 22,4 л цього газу. Якщо об'єм газу виміряно за умов, що відрізняються від нормальних, то для приведення його до нормальних умов використовують універсальне рівняння стану газу, яке об'єднує закони Бойня-Маріотта і Гей-Люссака:
де V – об'єм газу за тиску Рі температури Т; V 0 – об'єм газу за нормальних умов (Т0 = 273 К; P0 = 101 325 Па). Молярну масу можна також обчислити за рівнянням Клапейрона-Менделєєва, якевиводять з універсального рівняння стану газу:
де Р– тиск газу, Па; V – об'єм газу, м3; m – маса речовини, г; М– молярна маса речовини, г/моль; Т – абсолютна температура, К; R– універсальна газова стала, що дорівнює 8,31 Дж/(моль∙К). Значення R змінюється залежно від одиниць вимірювання тиску та об'єму: R = 62 360 мм рт. ст. ∙ мл,/(моль ∙ К), якщо тиск виміряно в міліметрах ртутного стовпа, а об'єм – у мілілітрах; R=0,082 атм ∙ л/(моль ∙ К), якщо тиск виміряно в атмосферах, а об'єм – у літрах. Значення молекулярних мас, визначені цими способами, не зовсім точні, оскільки застосовані для обчислень газові закони і рівняння справедливі лише для дуже розріджених або ідеальних газів. Точніші обчислення роблять на підставі аналізу речовин. Еквівалентом елемента називають таку його кількість, яка сполучається і одним молем атомів Гідрогену або заміщує таку саму кількість атомів Гідрогену в хімічних реакціях. Масу одного еквівалента елемента називають молярною масою еквівалента. Наприклад, у сполуках HF, H2О, NH3 еквіваленти Флуору, Оксигену та Нітрогену дорівнюють І; 1/2; 1/3 моль, а молярні маси їхніх еквівалентів відповідно 18,99; 8; 4,67 г/моль. Еквівалентом складної речовини називають таку її кількість, яка взаємодіє без залишку з одним еквівалентом Гідрогену або з одним еквівалентом. будь - якої іншої речовини. Зрозуміло, що в хімічних реакціях різні індивідуальні речовини беруть участь у строго еквівалентних кількостях. У цьому і полягає закон еквівалентів: хімічні елементи сполучаються один з одним, а речовини реагують між собою у кількостях, пропорційних їхнім еквівалентам.
ЕА — m1 ЕB — (m-m1), звідки
де ( m-m1 ) — вміст елемента В у сполуці АВ. Для визначення еквівалента застосовують також метод витіснення. За цим методом, як правило, обчислення ведуть за воднем. Беруть до уваги масу металу, що витісняє водень з води, кислоти або лугу, і масу витісненого водню:
де m1—- маса металу, г; m— маса витісненого водню, г. Якщо один елемент утворює з іншим не одну, а кілька сполук, то його еквівалент не є сталою величиною. Проте в усіх цих випадках різні еквіваленти одного й того самого елемента відносяться один до одного як невеликі цілі числа. Як для елементів, так і для хімічних сполук характерні кілька різних еквівалентів та молярних мас еквівалентів. Наприклад, сульфатна кислота з гідроксидом калію може взаємодіяти з утворенням кислої або середньої солі: H2S04 + КОН = KHS04 + H20; H2S04 + 2KOH = K2S04 + 2Н20. У першому випадку молярна маса еквівалента сульфатної кислоти дорівнює 98 г/моль, оскільки в реакцію вступає така її кількість, яка відповідає одному молю атомів Гідрогену, у другому – молярна маса еквівалента H2S04 дорівнює 49 г/моль, оскільки маса сульфатної кислоти, що реагує з гідроксидом калію, відповідає двом молям атомів Гідрогену. Молярні маси еквівалентів елементів зв'язані з їхніми атомними масами та валентністю формулою:
де А– атомна маса елемента; Мекв – молярна маса еквівалента; B – валентність елемента. Атомні маси елементів завжди сталі, а молярні маси їхніх еквівалентів залишаються сталими тільки в тих елементів, які мають сталу валентність. Лабораторна робота № 1
|
||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 407; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.17.174.204 (0.007 с.) |

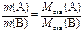 ,
,
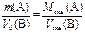
 Щоб визначити еквівалент елемента, не обов'язково мати його сполуку з Гідрогеном. Еквівалент елемента можна обчислити за складом сполуки цього елемента з будь-яким іншим елементом, еквівалент якого відомий (так званий прямий метод ). Нехай у mг сполуки АВміститься m1г елемента А,а еквівалент елемента В дорівнює ЕB. Тоді еквівалент елемента Аможна обчислити за пропорцією
Щоб визначити еквівалент елемента, не обов'язково мати його сполуку з Гідрогеном. Еквівалент елемента можна обчислити за складом сполуки цього елемента з будь-яким іншим елементом, еквівалент якого відомий (так званий прямий метод ). Нехай у mг сполуки АВміститься m1г елемента А,а еквівалент елемента В дорівнює ЕB. Тоді еквівалент елемента Аможна обчислити за пропорцією


