
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема: количественный анализ.Содержание книги Поиск на нашем сайте
Теоретический материал к занятию: Титриметрический анализ – измерение объёма титранта, затраченного на реакцию с анализируемым веществом. Титрант – раствор с точно известной концентрацией. Титрование – постепенное добавление титранта к анализируемому веществу до достижения точки эквивалентности. Точка эквивалентности (т.э.) – момент завершения реакции между титрантом и анализируемым веществом. Аликвотная проба – точно измеренный объём анализируемого вещества. Ацидиметрия – титрантом является кислота. Алкалиметрия – титрантом является основание. Первичный стандарт – раствор вещества, который готовят по точной массе. Стандартизация титранта – установление точной концентрации титранта. Закон эквивалентов: с(1/z X) ∙ V (X) = с(1/z T) ∙ V (T) Задача 1 Рассчитайте объём 20%-ого раствора KOH (ρ = 1,3 г/мл), необходимый для приготовления 1,5 л раствора с концентрацией С (KOH) = 0,1 моль/л.
2. Массу раствора щёлочи с ω = 20% можно рассчитать зная массу KOH, содержащуюся в этом растворе: ω = m (р-р) = 3. Массу KOH можно определить, зная молярную массу KOH и количество вещества KOH. m(KOH) = M(KOH) ∙ υ(KOH) M(KOH) = 56г/моль. 4. Количество вещества KOH можно определить, зная объём раствора и молярную концентрацию KOH в нём. υ(KOH) = V(р-р) ∙ C(KOH) Объём раствора и C(KOH) даны в условии задачи. 1. Находим количество вещества KOH: n(KOH) = 1,5 л ∙ 0,1 моль/л = 0,15 моль 2. Находим массу щёлочи: m(KOH) = 0,15 моль ∙ 40 г/моль = 6 г 3. Находим массу исходного раствора, содержащего 6 г KOH: m(р-р) = 4. Находим объём исходного раствора V(р-р) = Ответ: Для приготовления требуемого раствора необходимо взять 23 мл исходного раствора. Остальное – вода до объёма 1,5 л. Задача 2 Раствор гидроксида натрия неизвестной концентрации разбавлен в мерной колбе на 250 мл водой. На титрование 20 мл полученного раствора по реакции: 2NaOH + 2H2SO4 = Na2SO4 + 2H2O расходуется 24 мл рабочего раствора серной кислоты с C(1/2H2SO4) = 0,08 моль/л. Определить массу NaOH, содержащуюся в испытуемом растворе.
2. Находим массу NaOH во всём объёме: m(NaOH) = C(NaOH) ∙V1(NaOH) ∙M(NaOH) m(NaOH) = 0,605 моль/л∙0,20 л∙40 г/моль = 4,84 г Ответ: В растворе содержится 4,84 г NaOH. Домашнее задание:
1. Приведите пример вещества (X), количественное содержание которого в водном растворе можно определить прямым алкалиметрическим титрованием. Напишите уравнение реакции и выражение закона эквивалентов. Вычислите массу вещества (X), если на титрование затрачено 20,0 мл раствора титранта (какого?), с(Т) = 0,1 моль/л. _____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ _____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
2. Приведите пример вещества (X), количественное содержание которого в растворе можно определить прямым ацидиметрическим титрованием. Напишите уравнение реакции и выражение закона эквивалентов для этой реакции. Вычислите молярную концентрацию вещества (X), если на титрование раствора вещества (X) объемом 15,0 мл было затрачено 12,0 мл титранта (какого?), с (Т) = 0,07 моль/л. _____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ _____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ 3. Приведите пример вещества (X), количественное содержание которого в растворе можно определить прямым перманганатометрическим титрованием. Напишите уравнение реакции и выражение закона эквивалентов для этой реакции. Вычислите молярную концентрацию вещества (X) если на титрование 5,00мл исследуемого раствора затрачено 12,00 мл раствора титранта (какого?), с(1/z T) = 0,01 моль/л. _____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ _____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
4. Приведите пример вещества (X), количественное содержание которого можно определить обратным перманганатометрическим титрованием. Напишите уравнение реакции и выражение закона эквивалентов. Вычислите молярную концентрацию вещества (X), если к аликвотной доле вещества (X) объемом 10,00 мл добавили раствор сульфата железа (II) объемом 20,00 мл с молярной концентрацией 0,05 моль/л, а на титрование было затрачено 10,00 мл титранта (какого?), с (1/z T) = 0,05 моль/л. _____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ _____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
5. Вычислите объем раствора азотной кислоты с концентрацией 0,065 моль/л, необходимый для титрования раствора, содержащего 0,1 г гидроксида калия. _____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ _____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ 6. Раствор муравьиной кислоты массой 2,32 г разбавлен водой до 100 мл. На титрование 10 мл разбавленного раствора затрачено 7,2 мл раствора гидроксида калия с концентрацией 0,15 моль/л. Рассчитайте массовую долю муравьиной кислоты в исходном растворе. _____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ _____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Задания для самостоятельной работы из «Сборника задач и упражнений по общей химии». 1.70; 1.75; 1.78 Лабораторная работа.
|
||||||||||||
|
Последнее изменение этой страницы: 2016-12-09; просмотров: 313; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.129.249.247 (0.005 с.) |



 ω % дано в условии задачи, массу KOH следует определить.
ω % дано в условии задачи, массу KOH следует определить.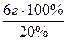 = 30 г
= 30 г = 23 мл
= 23 мл = 0,605 моль/л.
= 0,605 моль/л.



