Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Инженерная геология и карстоведениеСодержание книги Поиск на нашем сайте
Б2.ДВ1 ИНЖЕНЕРНАЯ ГЕОЛОГИЯ И Карстоведение
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
к лабораторным занятиям
ВЕЩЕСТВЕННЫЙ СОСТАВ ПОВЕРХНОСТНЫХ ЧАСТЕЙ ЗЕМНОГО ШАРА Направление подготовки 120700 Землеустройство и кадастры
Бакалавр
Очная форма обучения
УФА 2014
УДК 631.4:55+551.49(075.8) ББК 26.3+38.79
Рекомендовано к изданию методической комиссией факультета природопользования и строительства (протокол № 1 от 30 августа 2014 г.) Составитель: д.г.-м.н., профессор Абдрахманов Р.Ф., ассистент Хайдаршина Э.Т. Рецензент: к.с.-х.н., доцент Гайсин В.Ф. кафедры почвоведения и земледелия Ответственный за выпуск: зав. кафедрой природообустройства, строительства и гидравлики, к.с.-х.н., доцент Мустафин Р.Ф.
г. Уфа, БГАУ, кафедра природообустройства, строительства и гидравлики
ЭЛЕМЕНТЫ КРИСТАЛЛОГРАФИИ Внимательное изучение, горных пород, слагающих поверхность Земли показывает, что они состоят из различных, однородных по своему составу частиц вещества – минералов. Минералы – это природные, физически и химически индивидуализированные тела, возникающие в земной коре в результате физико-химических процессов без какого-либо, специального вмешательства человека в эти процессы». В настоящее время известно более 2000 минералов (учитывая разновидности, около 7000 названий). Подавляющая их часть – твердые, тела, часть – жидкие и газообразные. Среди них лишь несколько десятков минералов пользуются широким распространением, остальные встречаются редко. Общее число имеющихся в природных условиях минеральных видов вряд ли превысит 3000. Ограничение в числе видов обусловливается характером распределения химических элементов и медленностью течения процессов, ведущих к изменению внешних условий.
Минералогия, наука о минералах, рассматривает, химический состав минералов, особенности их структуры физические свойства, условия залегания, взаимосвязи и происхождение.
Почти все твердые минералы обладают кристаллической структурой, что выражается в правильности их внутреннего сложения и во внешней форме: очень часто минералы представлены в виде более или менее четко оформленных кристаллов с плоскими гранями, закономерно развивающимися в каждом данном минерале. Лишь самая малая часть минералов должна Под кристаллами понимают тела, находимые в природе или получаемые искусственно (например, в лаборатории), которые под влиянием внутренних физико-химических процессов, присущих самому веществу этого тела получили форму плоскостных многогранников. Кристаллическое вещество, из которого состоят кристаллы, обладает однородностью, анизотропностью и способностью самоограняться, что и приводит к формированию природных кристаллов. Под однородностью вещества понимается следующее: какую бы часть кристалла мы ни взяли, она будет обладать теми же физическими и химическими свойствами, что и любой другой такой же участок кристалла, взятый в любом месте кристалла, но так же ориентированный Анизотропным называется однородное тело, в которое при одинаковых свойствах по параллельным направлениям, в общем случае, обладает неодинаковыми свойствами по непараллельным направлениям. Весьма показательным примером анизотропности могут служить кристаллы слюды, которые легко расщепляются на тонкие пластинки лишь по одному направлению. Способностью самоограняться, т. е. принимать форму правильных многогранников в результате свободного роста в подходящей среде, обладают лишь кристаллы.
Изучение кристаллов показывает, что они по своей форме, как правило, симметричны. Это значит, что одну какую-либо часть кристалла можно совместить с другой его частью, мысленно повернув кристалл вокруг какой-либо оси на определенный угол или отразив одну часть в какой-либо плоскости (как в зеркале), разделяющей кристалл на две одинаковые части. В соответствии с этим следует различать оси симметрии и плоскости симметрии, а также центр симметрии. Оси, плоскости и центр симметрии именуются элементами симметрии. Ось симметрии – прямая, около которой можно повернуть многогранник (кристалл) так, чтобы все точки поверхности его в новом положении в точности совпали с точками прежнего положения, т. е. чтобы при повороте кристалл как бы совместился сам с собой. Различаются двойные, тройные, четверные шестерные оси в зависимости от того, сколько раз-два, три, четыре или шесть – можно повернуть кристалл вокруг оси так, что он каждый раз будет принимать первоначальное положение. Оси симметрии обычно обозначаются символом L с цифрой вверху или внизу справа, указывающей порядок данной оси: L2, L3, L4 или L6. В решетчатых системах а, следовательно, и в кристаллах, невозможны оси пятого порядка и оси порядка выше шести (L5 и L7). Плоскость симметрии – такая плоскость, которая делит многогранник (кристалл) на две зеркальноподобные части, причем зеркалом служит плоскость симметрии. Плоскость симметрии обозначается символом Р. Центр симметрии – точка, которая лежит в середине многогранника (кристалла) и делит пополам все линии, которые соединяют равнозначныё точки поверхности кристалла. При наличии в кристалле центра симметрии каждой грани отвечает другая грань, равная и параллельная (обратно-параллельная) первой. Центр симметрии принято обозначать буквой С. Различаются также зеркально-поворотные оси симметрии с помощью зеркально-поворотной оси симметрии можно привести кристалл в первоначальное положение следующим образом: сначала кристалл поворачивается вокруг оси на определенный угол, а затем мысленно разрезается плоскостью, перпендикулярной к этой оси, в которой каждая из частей отражается. Зеркально-поворотные оси обозначаются символом Л. Кроме перечисленных выше элементов симметрии, необходимо еще указать на понятие о единичных направлениях: единичным направлением называется единственное не повторяющееся в кристалле направление. Изучение кристаллов показывает, что существует лишь ограниченное число фигур, отвечающих тем или иным сочетаниям элементов симметрии. Совокупность элементов симметрии данной фигуры называется видом симметрии. А. В. Гадолин, русский кристаллограф, в 1867 г. показал, что можно Сингонией называется группа видов симметрии, обладающих одним или несколькими сходными элементами симметрии (с обязательным учетом осей выше второго порядка) при одинаковом числе единичных направлений. Сингонии в свою очередь делятся на три категории или группы: низшую, среднюю и высшую. Низшая сингония характеризуется отсутствием осей выше 2-го порядка и наличие нескольких единичных направлений (не меньше 3). К низшей группе относятся триклинная, моноклинная и ромбическая сингонии.
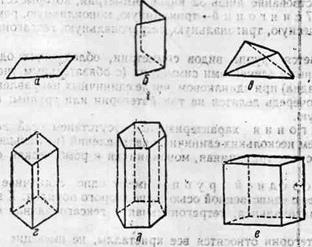
Кристаллы средней группы имеют одно единичное направление, совпадающее с единственной осью выше второго порядка. К этой категории относятся тригональная, тетрагональная и гексагональная сингонии. К высшей категории относятся все кристаллы, не имеющие единичных направлений, у которых всегда несколько осей симметрии выше второго порядка. Сингонии низшей группы Триклинная сингония. Все три угла между кристаллографическими осями косые. Элементов симметрии (осей и плоскостей) или совсем нет или имеется один центр. Пример – моноэдр (рисунок 1 а). Моноклинная сингония. Один угол между кристаллографическими осями косой, а два других прямые. Из 4 элементов симметрии могут быть: 1) одна ось второго порядка (L2) или 2) одна плоскость (Р), или 3) плоскость, ось второго порядка и центр: PL2C. Пример – диэдр или же ромбическая призма с двумя скошенными гранями (в противоположных концах) (рисунок 1 б). Ромбическая сингония. Все три угла между кристаллографическими осями прямые. Кристаллы обычно представляют комбинацию призм и пирамид, часто имеющих в сечениях, перпендикулярных к двойной оси симметрии, форму ромбов (рисунок 1 в). Сингонии средней группы Тригональная сингония. Всегда существует одна ось третьего порядка (L3). Из элементов симметрии присутствуют центр, плоскости и оси порядка выше двух (L3 3 L2 PC). Тетрагональная сингония. Всегда существует одна четверная ось (например, L4 4 L2 5 PC). Кристаллы обычно удлиненного типа, представляющие комбинацию призм и пирамид с квадратными прямоугольными параллелепипедами в поперечнике. Пример – призма с квадратным поперечным сечением (рисунок 1 г). Гексагональная сингония. Имеется одна шестерная (L6) поворотная ось симметрии. Кристаллы обычно удлинены, имеют форму шестигранных приз. Пример – призма с правильным шестиугольником в поперечнике (рисунок 1 д). Сингонии высшей группы Кубическая сингония. Кристаллы кубической сингоний обладают наибольшим количеством элементов симметрии. Несколько осей выше второго порядка. Обязательно есть 4 L3. Пример – куб (рисунок 1е).
Рисунок 1 Простые формы, возможные в кристаллах а – моноэдр, триклиниая сингония; б – диэдр, моноклинная сингония; в – ромбический тетраэдр, ромбическая сингония; г – тетрагональная призма, тетрагональная сингония: д – гексагональная призма, гексагональная сингония; е – куб, кубическая сингония
Совокупность элементов симметрии, характерную для того или иного вида симметрии, можно записать весьма кратко в виде своего рода формулы. В таблице 1 перечислены все 32 вида симметрии с соответствующими им формулами.
Таблица 1 32 вида симметрии кристаллов
Изучение внешних форм минералов и отнесение их к тому или иному виду симметрии имеет существенное значение по той причине, что все свойства минералов тесно связаны с их структурой. Эмпирическим путем выведены законы, касающиеся особенностей кристаллов: закон плоскогранности и прямореберности кристаллов, закон постоянства углов, закон рациональности отношений параметров и ряд других. Эти законы позволяют ближе понять процессы роста и развития кристаллических форм, присущих тем или иным минералам. Особенно большое значение имеет закон постоянства углов. Этот закон, известный как закон Стено-Ломонсова-Роме-Делиля, формулируется следующим образом: углы между соответственными гранями (и ребрами) во всех кристаллах одного и того же вещества постоянны. При росте кристаллов, в зависимости от условий, форма, число и размеры граней могут
Материальные частицы, слагающие кристаллические вещество, расположены в определенном порядке, они не заполняют полностью все пространство, а отстоят на некотором расстоянии друг от друга, образуя как бы скелет каждого кристалла. Расстояния между частицами (атомами, ионами и молекулами) для каждого данного направления в кристалле постоянны. Такое правильное, закономерное расположение частиц в кристалле, называется кристаллической или пространственной решеткой.
Рисунок 2 Структура кристаллической решетки некоторых минералов а – галит; б—графит; в – алмаз В зависимости от характера частиц, лежащих в узлах решетки, последняя бывает атомной, ионной и молекулярной. Так, кристаллическая решетка галита (каменной соли) состоит из ионов металла Na и галоида СI, располагающихся в вершинах элементарных кубов попеременно, в шахматном порядке (рисунок 2). Решетка кристаллов графита состоит из атомов углерода С, расположенных плоскими слоями, причем в каждом слое они находятся в вершинах правильных шестиугольников. Расстояние между атомами в плоскости равно i, 43 А (знаком А обозначается единица длины, ангстрем; 1А=10-8 см), расстояние между плоскостями = 3,35, А (см. рисунок 2). Поэтому слои легко скользят один относительно другого. Те же атомы С, расположенные так, что каждая частица окружена четырьмя соседними, образующими вершины тетраэдра, дают вещество с совершенно иными свойствами, а именно алмаз (см. рисунок 2). Способность одного и того же химического соединения при изменении внешних факторов (главным образом температуры) кристаллизоваться в различных кристаллографических форумах с изменением физических свойств называется. Кроме того, в природных условиях достаточно широко распространено явление изоморфизма, под которым понимается, свойство родственных по химическому составу веществ кристаллизоваться в близких формах, образуя кристаллы переменного состава, так называемые смешанные кристаллы. Примером такого замещения одного элемента другим может служить MgCO3 – FeCO3 (магнезит и сидерит). Изоморфные замещения при высоких температурах происходят в более широких пределах, чём при низких. Многие кристаллы построены чрезвычайно сложно; выяснение строения кристаллической решетки для естественных, а также и искусственных кристаллов составляет важную задачу современной кристаллографии. ЭЛЕМЕНТЫ МИНЕРАЛОГИИ
Различия во внешнем виде физических свойствах позволяют определять многие распространенные минералы макроскопически, то есть по их внешнему облику. Важнейшими признаками минералов в этом смысле являются удельный вес (плотность), твердость, цвет, цвет черты, блеск, спайность, излом и некоторые другие их свойства. Удельный вес минералов обычно колеблется в пределах от 2 до 10, хотя встречаются минералы и с меньшей плотностью, чем 2 (асфальт), и с большей, чем 10 (серебро, золото). Удельный вес наиболее распространенных минералов и горных пород колеблется в пределах от 2,5 до 3,5. Твердость. Под твердостью понимают сопротивление, которое оказывает данное вещество проникновению в него более прочного вещества. Для определения величины этого сопротивления или противодействия предложены различные способы – царапания, статического вдавливания, ударной пробы, шлифования, затухающих колебаний, сверления и др. В геологической практике широкое распространение получил метод, предложенный Ф. Моосом (1773—1839) и заключающийся в том, что испытываемый минерал сравнивается с некоторыми эталонными образцами путем царапания: минерал считается более твердым, чем другой, если этот последний царапается первым, т. е. если при проведении острым углом первого минерала по грани второго на втором остается царапина. Ф. Моос предложил список из распространенных минералов, которые расположены в порядке возрастания твердости и составляют шкалу твердости Мооса (таблица 2). Цифры, выражающие твердость в этой шкале, носят лишь относительный характер. Проф. Г.Б. Бокий в 1932 г. попытался определить твердость в сравнимых между собой единицах, применив метод Мартенса: под твердостью понималась нагрузка, в граммах, вызывающая царапину шириной в 0,01 мм. Еще ранее, в 1896 г., Ф. Ауэрбах определял значение твердости, вдавливая шар с радиусом в 1 см в грань кристалла, параллельную плоскости спайности; полученные абсолютные значения твердости выражались в кг/см2. В таблице 2 приведена шкала Мооса и соответствующие каждому минералу цифры, характеризующие значение твердости по Г. Б. Бокию и Ф. Ауэрбаху. Шкала Мооса практически очень удобна и помогает распознавать минералы при макроскопическом исследовании.
Таблица 2 Твердость минералов
Цвет. Окраска минералов чрезвычайно разнообразна; встречаются все, различаемые глазом цвета и их оттенки. Известны белые минералы (молочный кварц, каолинит), желтые (сера, янтарь), зеленые (малахит), синие (лазурит), красные (рубин, киноварь), фиолетовые (флюорит, аметист), золотистые (пирит), черные (графит, антрацит) и т. д. с множеством оттенков и сочетаний. Причина окраски минералов в тот или иной цвет еще далеко не всегда выяснена. Нередко минералы в мелкораздробленном состоянии имеют иной цвет, чем в куске. Так, например, пирит в куске – золотисто-желтый, в порошке – черный. Для распознавания минералов имеет иногда значение различие в цвете самого минерала и черты, которые он оставляет на белой фарфоровой шероховатой пластинке, для чего достаточно провести по пластинке острым концом минерала. Так, золотисто-желтый пирит оставляет черную черту, бурый лимонит – желтую, черный гематит – красную черту. Блеск. Различают следующие разновидности блеска: металлический, стеклянный, алмазный, жирный, шелковистый, перламутровый, матовый и др. Спайность. Многие минералы обладают способностью легко раскалываться по некоторым, строго ориентированным направлениям, зависящим от особенностей кристаллической решетки. Так, галит (каменная соль) раскалывается вдоль граней куба, слюда расслаивается на тончайшие листочки по направлению, перпендикулярному к единственной двойной оси симметрии ее пластинчатых кристаллов, и т. д. Это свойство минералов именуется спайностью. Обычно различается пять степеней совершенства спайности (А. К. Болдырев, 1934). 1. Весьма совершенная спайность. Кристалл может делиться на тончайшие листочки (слюда, гипс, графит). 2. Совершенная спайность. При ударе молотком по кристаллу очень трудно получить неровный излом (кальцит). 3. Средняя спайность. На кусках минералов отчетливо наблюдаются как плоскости спайности, так и неровные изломы (полевой шпат, авгит, роговая обманка). 4. Несовершенная спайность. Плоскостей спайности почти не видно, излом кусков неровный (апатит). 5. Весьма несовершенная спайность. Спайность практически не наблюдается, излом обычно раковистый (кварц). Наличие или отсутствие спайности всецело зависит от строения кристаллической решетки данного минерала и взаимосвязей между частицами, слагающими эту решетку. Излом. Если минерал раскалывается не по плоскостям спайности, а по случайным направлениям, то поверхность раскола приобретает в каждом данном случае свой, особый характер, так называемый излом. Излом может быть раковистым, занозистым, крючковатым, землистым и др. Другие свойства. Минералы можно различать также по степени прозрачности, магнитным свойствам, температуре плавления, явлениям флуоресценции, оптическим свойствам, ковкости, хрупкости, электрическим свойствам и т. п. Форма проявления минералов. Минералы встречаются в природе в самых различных формах: в виде хорошо выраженных более или менее крупных кристаллов или сплошного скопления многочисленных мелких кристалликов, в форме сплошных масс сферокристаллического или аморфного сложения, в виде почковидных натеков, желваков, конкреций, стяжений с радиально-лучистой или скорлуповатой структурой, в виде корочек и налетов, в виде землистых масс, в виде щеток и друз, выполняющих пустоты – жеоды, секреции, в форме сталактитов и сталагмитов, в форме мелких, рассеянных в породе зерен, в роли вещества, заполняющего полости раковин или замещающего вещество раковины или других минералов и т. д. Химическая классификация минералов. Огромное множество минералов естественно распадается на ряд групп. Можно предложить классификацию минералов по признакам единства происхождения (генетическая классификация), географического размещения (географическая классификация), пространственного распределения (геохимическая классификация), структурных особенностей, практического использования и т. п. В дальнейшем изложении будем пользоваться химической классификацией, которая в деталях разработана В. И. Вернадским (1906, 1910), Дж. Д. Дана (1920), А. Г. Бетехтиным (1950) и многими другими. В соответствия с принципиальными основами этой классификации разделим минералы на следующие группы: 1. Самородные элементы; 2. Сульфиды (сернистые соединения); 3. Галоидные соединения; 4. Карбонаты (соли угольной кислоты); 5. Сульфаты (соли серной кислоты); 6. Фосфаты (соли фосфорных кислот); 7. Окислы; 8. Силикаты (соли кремневых кислот); 9. Органические соединения. Рассматриваются следующие минералы: Самородные элементы Золото Аu Платина Pt Алмаз С Графит С Сера S Сульфиды Галенит PbS Пирит FeS2 Сфалерит ZnS Киноварь HgS Галоидные соединения Галит NaCl Сильвин КСI Флюорит CaF2 Карбонаты Кальцит СаСO3 Доломит CaMg(CO3)2 Сидерит FeCO3 Сульфаты Ангидрит CaSO4 Барит BaSO4 Гипс CaSO4·2H2O Мирабилит Na2SO4·10H2O Фосфаты Апатит Ca6(F, СI) · (РO4)3 Фосфорит Ca5F(PO4)3 Окислы Кварц SiO2 Опал SiO2·nH2O Корунд АI2O3 Боксит АI2O3·2Н2O Гематит Fe2O3 Магнетит FeO·Fe2O3 Лимонит 2 Fe2O3·nH2O Пиролюзит МnO2 Силикаты Оливин (Mg, Fe)2·SiO4 Авгит Са (Mg, Fe, AI) [(Si, AI)2O6] Роговая обманка (Са, Na)2 (Mg, Fe, AI, Fe)5 [(Si, AI)4O11]2(OH)2 Мусковит KAI2(OH)2 ·[AISi3O10] Биотит K(Mg, Fe)3· [OH, F]2· [AISi3O10] Тальк Mg3(OH2[Si4O10] Каолинит AI4(OH)8·Si4O10] Серпентин Mg6(OH)8 [Si4O10] Хлорит (Fe, Mg)5AI[OH]8[AISi3O10] Глауконит K(Fe, AI, Mg)3·(OH)2[AISi3O10] ·nH2O. Плагиоклазы Na[AISi3O8] Ca[AI2Si3O8] Ортоклаз K[AISi3O8] Микроклин K·[AISi3O8] Лейцит K[AISi2O6] Нефелин Na[AISiO4] Органические соединения Асфальт Озокерит Янтарь С10Н16О
О происхождении минералов. Минералы формируются под воздействием самых разнообразных процессов, протекающих в толще земной коры и на ее поверхности. По источнику энергии, за счет которой они происходили, их можно разделить на две главные генетические группы: 1) Эндогенные («изнутри рожденные»), образующиеся внутри земной коры, при высоких давлениях и высокой температуре, из магмы или при ее воздействии на окружающие породы. Магма представляет собой сложный природный высокотемпературный, насыщенный газами силикатный расплав, возникающий в виде отдельных очагов в глубоких зонах Земли при изменении физико-химической обстановки (давления, температуры и т. п.). Магма, излившаяся на поверхность, называется лавой. 2) Экзогенные («извне рожденные»), образующиеся при процессах, протекающих на поверхности Земли за счет внешних факторов, при низких температурах и давлениях, в условиях взаимодействия физических и химических агентов – атмосферы, гидросферы и биосферы. Минеральные массы как эндогенного, так и экзогенного происхождения при изменившихся внешних условиях претерпевают разнообразные изменения. Различают следующие типы генезиса минералов: 1. Магматический. Минералы образуются из магмы при медленном ее остывании и кристаллизации па больших глубинах в земной коре или при излиянии и застывании ее на поверхности. Таким путем образуются главнейшие породообразующие минералы – силикаты, кварц, а также многие рудные минералы. 2. Метаморфический. Минералы образуются в результате воздействия на твердые горные породы таких факторов, как высокая температура, высокое давление, газы и пары воды. Различают минералы контактного метаморфизма, т. е. минералы, образующиеся при изменении горных пород в зоне непосредственного контакта с магмой; в первой сталии процесса эти минералы оказываются результатом исключительно теплового воздействия. По мере застывания магмы из нее начинают выделяться газообразные компоненты – соединения различных металлов, которые в свою очередь образуют в контактных зонах ряд минералов; часто они имеют большое практическое значение. Примером могут служить ценнейшие месторождения железных руд, преимущественно магнитного железняка, на Урале. При взаимодействии газовых компонентов с горными породами наблюдается явлением метасоматоза – т. е. процесс замещения одних минералов и горных пород другими. 3. Гидротермальный. Минералы образуются из восходящих горячих водных растворов, которые возникают в результате сжижения паров воды и газов, выделяющихся из магмы при ее остывании и кристаллизации в глубине. Горячие водные растворы при проникновении в трещины 4. Пневматолитовый (дуновение). Минералы образуются на глубине при последних стадиях кристаллизации магмы, когда из нее выделяются пары воды, частью диссоциированные на ионы Н' и ОН', и газы HF, НО, H2S и летучие соединения В, Р, S и С, поднимающиеся по трещинам в земной коре. В этом случае при участии газообразных компонентов образуются некоторые типичные минералы (оловянный камень). К явлениям пневматолитового минералообразования можно также отнести образование минералов из летучих соединений некоторых вулканов – самородная сера, минералы бора и др., являющиеся не чем иным, как продуктами возгона (сублимации). 5. Гипергенный. Минералы образуются вблизи или на поверхности Земли в результате сложных процессов, обусловленных взаимодействием гидросферы, атмосферы, биосферы и литосферы. Здесь можно выделить несколько типов минералообразования: а) образование минералов при процессах выветривания, когда под влиянием колебаний температуры, воды, воздействия углекислоты, кислорода прежде созданные минералы и горные породы разрушаются и за счет их образуются новые. Примером является образование каолина за счет полевых шпатов и лимонита в зонах окисления других железистых соединений (сульфидов, карбонатов, окислов). б) образование минералов в морях, озерах и болотах. В морские, озерные водоемы и болота привносится поверхностными водотоками большое количество разнообразных веществ, которые при благоприятных условиях откладываются на дне их. Часто этот процесс протекает при содействии особых бактерий, способных усваивать те или иные вещества и концентрировать их в своем теле. Примером подобного минералообразования являются некоторые месторождения озерных и болотных железных руд (лимонита), а также месторождения бурого железняков приустьевых частях моря, где происходит коагуляция железистых взвесей при соприкосновении пресной речной воды с соленой морской. В морских водоемах образуются, кроме того, марганцевые руды, кальцит, фосфорит и другие минералы. в) образование минералов в лагунах (отчлененных от моря заливах) и соленых озерах. Здесь путем химического осаждения образуются гипс, поваренная соль, калийные соли, глауберова соль. Примерами являются залив Каспийского моря – Кара-Богаз-Гол, где происходит образование глауберовой соли, и озер Эльтон и Баскунчак, в которых осаждается каменная соль. Самородные элементы К самородным элементам относится около 50 минеральных видов. По своей массе они составляют менее 0,1% от массы земной коры. К ним относятся элементы химически инертные, а также элементы, легко восстанавливающиеся из своих соединений. Золото, Аu. Удельный вес–15,6-19,3; твердость – 2,5-3,0; цвет – золотисто-желтый; блеск – металлический; излом – крючковатый; очень ковко и тягуче; кристаллизуется в кубической сингонии. Обычно встречается в виде неправильных зерен, чешуек, небольших листочков, примазок и т. п. В коренном залегании золото чаще всего встречается с кварцем, сульфидами (пиритом, блеклыми рудами и др.), где оно выделилось из горячих водных растворов. Со временем коренные месторождения выветриваются и частицы золота уносятся в реки, где в толще речного песка могут образовать россыпные месторождения. Главнейшие месторождения – Урал, бассейн Лены и Алдана. Графит, С. Удельный вес – 2,1-2,2; твердость – 1,0; цвет – черный; блеск – сильный металловидный, матовый; черта – черная; спайность – совершенная в одном направлении; непрозрачен; кристаллизуется в гексагональной сингонии. Хорошие кристаллы встречаются редко, обычно обладает скрыто кристаллическим сложением. Отличается малой твердостью, гибок, способен давать черную черту. Графит часто представляет собой продукт метаморфизации углистых пород. Он находит широкое применение в металлургии, электротехнике, применяется для изготовления карандашей, в красильной промышленности.
Галоидные соединения К галоидным соединениям относится около 100 минералов, представляющих соли галоидно-водородных кислот: НСI, HF, НВr, HJ. Наибольшее распространение имеют соединения CI и F; из металлов чаще всего присутствуют К, Na, Mg, Ca. Это минералы легкие, мягкие, светлые, часто прозрачные. В генетическом отношении среди них выделяются: 1) минералы высоких температур, связанные с магматическими, пневматолитическими и гидротермальными процессами, и 2) минералы, представляющие химические осадки морей и озер. Галит (каменная соль), NaCI. Удельный вес – 2,1-2,6; твердость – 2,0; цвет – бесцветен или желтый, иногда красный, бурый, в зависимости от примесей; блеск – стеклянный; прозрачен; спайность – весьма совершенная (по граням куба); кристаллизуется в кубической сингонии, давая правильные, иногда довольно крупные кубы. Очень хрупок; известен соленым вкусом. Легко растворяется в воде. Скопления каменной соли возникают в большинстве случаев в результате высыхания лагун и соленых озер. Каменная соль образует иногда слои мощностью в несколько сот метров. Известны месторождения в Донбассе и др. Широко используется в промышленности, в том числе в пищевой. ' Сильвин, KCI. Удельный вес – 1,9-2,0; твердость – 2,0; цвет – бесцветный (прозрачный), чаще – желтоватый, красноватый, голубоватый; блеск – стеклянный; спайность – совершенная (по граням куба); кристаллизуется в кубической сингонии. Встречается в форме скоплений небольших кристаллов. Отличается горько-соленым вкусом. Образуется в результате осаждения из морской воды. Главнейшие месторождения – Соликамск (на Урале) и др. Используется как сырье для изготовления удобрений и как химическое сырье.
Окислы К окислам относится около 200 минералов; на их долю приходится до 17% от массы земной коры. К ним относятся такие распространенные минералы, как кварц и окислы железа. Твердость минералов обычно велика. Окислы железа, хрома, марг
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-09; просмотров: 115; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.189.148 (0.015 с.) |