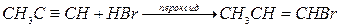Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кислотность алкинов и нуклеофильные свойства ацетиленидовСодержание книги
Поиск на нашем сайте
Алкины, имеющие атомы водорода при sp-гибридизированном атоме углерода (концевая тройная связь), являются СН-кислотами, причем более сильными, чем алкены, алканы и аммиак, но более слабыми кислотами, чем, например, вода и спирты. Соответствующие значении рКа сравниваются ниже.
Причина более высокой кислотности алкинов по сравнению с алкенами и алканами – большая устойчивость соответствующего карбаниона вследствие роста электроотрицательности углеродного атома при изменении его гибридизации от sp3- к sp2- и sp. Несмотря на повышенную кислотность алкинов не каждое сильное основание способно их ионизировать:
При действии сильных оснований алкины, имеющие концевую тройную связь, образуют соли, которые называются ацетиленидами. Например, при пропускании над металлическим натрием, нагретым до 150 °С, ацетилен превращается в натрийацетилденид:
Ацетилениды натрия и калия получают при низкой температуре действием соответствующих амидов.
Кислотные свойства алкинов с концевой тройной связью проявляются и при их взаимодействии с металлоорганическими соединениями, которые также являются очень сильными основаниями.
Получение алкинилмагний галогенида действием реактива Гриньяра на ацетилен известно на реакция Иоцига. Качественная реакция на концевую тройную связь – взаимодействие алкинов с растворами аммиакатов серебра и меди. При наличии такой связи образуется нерастворимый в воде ацетиленид, цвет которого определяется природой металла.
Пропинид серебра представляет собой осадок белого цвета, а пропинид меди – желтого цвета. Ацетилениды меди и серебра в сухом виде обладают исключительной взрывчатостью. Алкинид-ионы в составе металлических солей ацетиленида и его гомологов являются сильными нуклеофилами и находят широкое применение в органическом синтезе, в частности, для получения гомологов ацетилеа (реакция алкилирования и арилирования):
Ацетилениды тяжелых металлов, подобно другим металлоорганичсеким соединениям, легко реагируют с альдегидами, кетонами, углекислотой, образуя важные кислородсодержащие продукты – спирты, кислоты. Чаще всего для этих реакций используется смешанный ацетиленид магния (комплекс Иоцига).
В промышленности осуществляется конденсация ацетиленида с муравьиным альдегидом в присутствии ацетиленида меди под давлением с получением пропаргилового спирта и бутиндиола (метод Реппе):
Одноэлектронные реакции
Реакционная способность алкинов, в целом, может быть оценена одноэлектронными реакциями ацетилена: образованием его катион-радикала при фотовозбуждении в газовой фозе:
и образованием анион-радикала ацетилена при его бомбардировке электронами также в газовой фазе:
Данные II и AI позволяют оценить параметр η, «жесткость» электронной структуры ацетилена.
Сравнивая полученное значение со значением η для этилена (6.14 эВ), можно полагать, что алкины должны обладать меньшей реакционной способность в реакциях AE по сравнению с алкенами. Такое соотношение скоростей реакций AE алкинов и алкенов наблюдается и на практике.
РЕАКЦИИ ЭЛЕКТРОФЛЬНОГО ПРИСОЕДИНЕНИЯ
Алкины, как и алкены, наиболее склонны к реакциям электрофильного присоединения.
Галогенирование
Присоединение галогенов к тройной связи протекает как электрофильное анти-присоединение (AdE):
Механизм реакции: Стадия 1 – образование π-комплекса:
Стадия 2 – π-комплекс медленно перегруппировывается в карбокатион, а затем, вероятно, и в хлорониевый ион. Эта стадия реакции является скоростьлимитирующей.
Стадия 3 – к хлорониевому иону быстро присоединяется анион хлора со стороны, противоположной хлору в хлорониевом ионе, что и определяет стехиометрический результат реакции как анти-присоединение.
Присоединение хлора к образовавшемуся алкену идет по обычному для алкенов механизму электрофильного анти-присоединения. Присоединение галогена по двойной связи протекает легче, чем по тройной. Кроме уже предложенного выше разъяснения, этот факт может объясняться и заметно меньшей стабильностью положительно заряженного иона как в форме циклического хлорониового иона, так и в форме промежуточного винил-катиона.
Различие в реакционной способности алкенов и алкинов настолько значительно, что возможно избирательное присоединение галогенов к углеводородам, содержащим одновременно двойную и тройную связь:
В других реакциях электрофильного прсоединения (реакции с галогеноводородами, водой) указанное различие не столь велико и объясняется, прежде всего, меньшей устойчивостью промежуточно образующегося винил-катиона. Винил-катион – катион, содержащий положительный заряд на атоме углерода при двойной связи. Такой углерод находится в состоянии sp-гибридизации.
Винил-катионы образуются в результате присоединения электрофильной частицы к углерод-углеродной тройной связи.
Вместе с тем, при наличии сопряженных двойной и тройной связей присоединение галогена происходит по тройной связи:
Гидрогалогенирование
Галогеноводороды присоединяются к ацетиленовым углеводородам по правилу Марковникова:
В общем, в таких реакциях реакционная способность алкина в 100-1000 раз ниже, чем таковая для алкена. Реакция протекает также с промежуточным образованием винил-катиона.
Механизм реакции: Стадия 1 – образование π-комплекса:
Стадия 2 – образование карбокатиона (скоростьлимитирующая стадия):
Стадия 3 – стабилизация карбокатиона взаимодействием с бромид-ионом:
Взаимодействие образовавшегося алкена со второй молекулой бромводорода происходит по аналогичному механизму:
Гидробромирование алкинов менее стереоселективно по сравнению с гидробромированием алкнов, возможно образование цис- и транс-аддуктов. В присутствии пероксидов наблюдается перекисный эффект Хараша: имеет место присоединение против правила Марковникова:
Гидратация (реакция Кучерова)
Алкины присоединяют воду в присутствии серной кислоты и солей ртути (II) также по механизму реакции AE. Это превращение известно как реакция Кучерова.
К гомологам ацетилена вода присоединяется по правилу Марковникова. Продуктами гидратации алкинов являются кетоны, и лишь сам ацетилен при гидратации дает альдегид-ацетальдегид.
В качестве промежуточного продукта в реакции Кучерова образуется непредельный спирт – енол. Еиолом называют такой непредельный спирт, в котором гидроксигруппа связана с sp2-гибридизованным атомом углерода. Енолы являются крайне неустойчивыми промежуточными соединениями и изомеризуются в соединения с карбонильной группой.
|
||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 2054; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.218.44 (0.01 с.) |





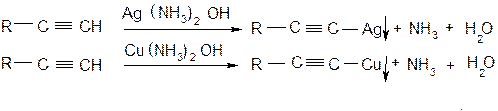










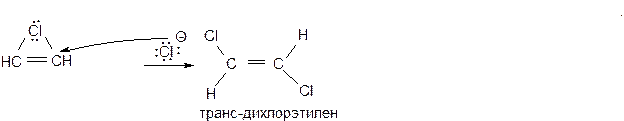



 , так как электроотрицательность атома углерода в sp3-гибридизации меньше (2,5), чем в sp2-гибридизации (2,8).
, так как электроотрицательность атома углерода в sp3-гибридизации меньше (2,5), чем в sp2-гибридизации (2,8).