
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Дегидрогалогенирование дигалогеналкановСодержание книги
Поиск на нашем сайте АЛКИНЫ (ацетиленовые углеводороды)
Алкины – ненасыщенные углеводороды, содержащие тройную связь
НОМЕНКЛАТУРА И ИЗОМЕРИЯ
По систематической номенклатуре названия алкинов образуются заменой окончания ан на ин в названиях соответствующих алканов. Ниже показаны примеры (тривиальные названия даны в скобках):
Тройная связь может быть «концевой» (например, в пропине) или «внутренней» (например, в 4-метил-2-пентине и в 1-пентен-3-ине). Структурная изомерия в ряду ацетиленовых углеводородов начинается с четвертого члена (табл. 4.1). однако изомеры С4Н6 могут различаться только положением тройной связи, но не строением углеродного скелета. Последний вид структурной изомерии начинается с пятого члена ряда. По числу изомеров ацетиленовые углеводороды занимают среднее положение между предельными углеводородами и олефинами.
СПОСОБЫ ПОЛУЧЕНИЯ
Карбидный метод Ф. Велера В реакции карбидов металлов с водой образуются алкины. До настоящего времени этот старый (1862 г.) метод являлся одним из промышленных источников получения ацетилена: взаимодействием карбида кальция с водой. Аналогично реагируют SnC2 b BaC2:
Карбид магния Mg2C3 с водой образует пропин:
Пиролиз метана
Пиролиз метана при очень высокой температуре ведет к получению ацетилена. В этих условиях ацетилен термодинамически нестабилен, поэтому пиролиз проводят при очень коротких интервалах времени (сотые доли секунды):
При окислительном пиролизе с добавкой кислорода часть метана сгорает, давая необходимую для разложения температуру:
Выход ацетилена составляет ~15 %. Пиролиз жидких углеводородов или гомологов метана при 1200-1500 °С приводит к образованию ацетилена легче, чем крекинг метана.
Синтез из элементов
Пропуская вольтову дугу между угольными электродами в атмосфере водорода, Бертло получил ацетилен. Этот метод лишен какого-либо практического значения, но важен исторически.
Дегидрогалогенирование дигалогеналканов
Ацетиленовые углеводороды образуются при действии спиртового раствора щелочи на геминальные или вицинальные дигалогенпроизводные алканов:
Реакция дегидрогалогенирования идет в две стадии:
ФИЗИЧЕСКИЕ СВОЙСТВА И СТРОЕНИЕ
Физические свойства
Физические свойства алкинов подобны свойствам соответствующих алкенов. Низшие алкены – газы, не обладающие ни цветом, ни запахом. Они имеют более высокие температуры кипения, чем алкены. Алкины с концевой тройной связью кипят ниже, чем изомеры с внутренней тройной связью (см. табл. 6.1). Таблица 6.1 Физические свойства алкинов
РЕАКЦИИ Одноэлектронные реакции
Реакционная способность алкинов, в целом, может быть оценена одноэлектронными реакциями ацетилена: образованием его катион-радикала при фотовозбуждении в газовой фозе:
и образованием анион-радикала ацетилена при его бомбардировке электронами также в газовой фазе:
Данные II и AI позволяют оценить параметр η, «жесткость» электронной структуры ацетилена.
Сравнивая полученное значение со значением η для этилена (6.14 эВ), можно полагать, что алкины должны обладать меньшей реакционной способность в реакциях AE по сравнению с алкенами. Такое соотношение скоростей реакций AE алкинов и алкенов наблюдается и на практике.
РЕАКЦИИ ЭЛЕКТРОФЛЬНОГО ПРИСОЕДИНЕНИЯ
Алкины, как и алкены, наиболее склонны к реакциям электрофильного присоединения.
Галогенирование
Присоединение галогенов к тройной связи протекает как электрофильное анти-присоединение (AdE):
Механизм реакции: Стадия 1 – образование π-комплекса:
Стадия 2 – π-комплекс медленно перегруппировывается в карбокатион, а затем, вероятно, и в хлорониевый ион. Эта стадия реакции является скоростьлимитирующей.
Стадия 3 – к хлорониевому иону быстро присоединяется анион хлора со стороны, противоположной хлору в хлорониевом ионе, что и определяет стехиометрический результат реакции как анти-присоединение.
Присоединение хлора к образовавшемуся алкену идет по обычному для алкенов механизму электрофильного анти-присоединения. Присоединение галогена по двойной связи протекает легче, чем по тройной. Кроме уже предложенного выше разъяснения, этот факт может объясняться и заметно меньшей стабильностью положительно заряженного иона как в форме циклического хлорониового иона, так и в форме промежуточного винил-катиона. Различие в реакционной способности алкенов и алкинов настолько значительно, что возможно избирательное присоединение галогенов к углеводородам, содержащим одновременно двойную и тройную связь:
В других реакциях электрофильного прсоединения (реакции с галогеноводородами, водой) указанное различие не столь велико и объясняется, прежде всего, меньшей устойчивостью промежуточно образующегося винил-катиона. Винил-катион – катион, содержащий положительный заряд на атоме углерода при двойной связи. Такой углерод находится в состоянии sp-гибридизации.
Винил-катионы образуются в результате присоединения электрофильной частицы к углерод-углеродной тройной связи.
Вместе с тем, при наличии сопряженных двойной и тройной связей присоединение галогена происходит по тройной связи:
Гидрогалогенирование
Галогеноводороды присоединяются к ацетиленовым углеводородам по правилу Марковникова:
В общем, в таких реакциях реакционная способность алкина в 100-1000 раз ниже, чем таковая для алкена. Реакция протекает также с промежуточным образованием винил-катиона.
Механизм реакции: Стадия 1 – образование π-комплекса:
Стадия 2 – образование карбокатиона (скоростьлимитирующая стадия):
Стадия 3 – стабилизация карбокатиона взаимодействием с бромид-ионом:
Взаимодействие образовавшегося алкена со второй молекулой бромводорода происходит по аналогичному механизму:
Гидробромирование алкинов менее стереоселективно по сравнению с гидробромированием алкнов, возможно образование цис- и транс-аддуктов. В присутствии пероксидов наблюдается перекисный эффект Хараша: имеет место присоединение против правила Марковникова:
Гидратация (реакция Кучерова)
Алкины присоединяют воду в присутствии серной кислоты и солей ртути (II) также по механизму реакции AE. Это превращение известно как реакция Кучерова.
К гомологам ацетилена вода присоединяется по правилу Марковникова. Продуктами гидратации алкинов являются кетоны, и лишь сам ацетилен при гидратации дает альдегид-ацетальдегид.
В качестве промежуточного продукта в реакции Кучерова образуется непредельный спирт – енол. Еиолом называют такой непредельный спирт, в котором гидроксигруппа связана с sp2-гибридизованным атомом углерода. Енолы являются крайне неустойчивыми промежуточными соединениями и изомеризуются в соединения с карбонильной группой.
Реакции винилирования
По типу AE ацетилены реагируют и с другими электрофильными реагентами. Продуктами этих реакций являются соединения СН2=СН–X, а реакции носят название реакций винилирования. Винилирование – реакции различных соединений с алкинами, в результате которых в молекулу вводится винильная группа СН2=СН–.
Эти реакции присоединения соединений с подвижным атомом водорода к ацетилену в присутствии оснований известны как реакция Реппе (1949 г.). Карбонилирование
В присутствии никелевых катализаторов алкины, в основном ацетилен, реагируют с оксидом углерода. В этой реакции в случае ацетилена образуется акриловая кислота или ее производные (эфиры, амиды).
Реакцию катализует тетракарбонил никеля, который активирует тройную связь в результате образования π-комплекса.
Изомеризация алкинов Ацетиленовые углеводороды способны к изомеризации с перемещением кратной связи или с превращением в диеновые углеводороды. Изомеризация алкина с концевой тройной связью в алкин с внутренней тройной связью (термодинамически более стабильный) при 170 °С в присутствии спиртовой щелочи идет с промежуточным образованием алленового углеводорода (Фаворский А.Е.).
Поскольку все стадии этого превращения обратимы, состав его продуктов подчиняется термодинамическому контролю. Возможна и обратная изомеризация алкина с внутренней тройной связью на конце молекулы. В качестве основания применяется суспензия металлического или амида натрия в минеральном масле при 120-160 °С. Алкины с неконцевой тройной связью в этих условиях быстро и практически необратимо превращаются в ацетилениды. Натрийалкиниды нерастворимы в минеральном масле и выводятся поэтому из сферы реакций.
В присутствии некоторых катализаторов ацетиленовые углеводороды могут превращаться в сопряженные диеновые через стадию образования алленовых.
ОКИСЛЕНИЕ АЛКИНОВ
Сильные окислители (
Ацетиленид-ион способен к окислению (отдаче электрона) с образованием свободного алкинильного радикала. При изомеризации получаются дины:
ГИДРИРОВАНИЕ АЛКИНОВ
АЛКИНЫ (ацетиленовые углеводороды)
Алкины – ненасыщенные углеводороды, содержащие тройную связь
НОМЕНКЛАТУРА И ИЗОМЕРИЯ
По систематической номенклатуре названия алкинов образуются заменой окончания ан на ин в названиях соответствующих алканов. Ниже показаны примеры (тривиальные названия даны в скобках):
Тройная связь может быть «концевой» (например, в пропине) или «внутренней» (например, в 4-метил-2-пентине и в 1-пентен-3-ине). Структурная изомерия в ряду ацетиленовых углеводородов начинается с четвертого члена (табл. 4.1). однако изомеры С4Н6 могут различаться только положением тройной связи, но не строением углеродного скелета. Последний вид структурной изомерии начинается с пятого члена ряда. По числу изомеров ацетиленовые углеводороды занимают среднее положение между предельными углеводородами и олефинами.
СПОСОБЫ ПОЛУЧЕНИЯ
Карбидный метод Ф. Велера В реакции карбидов металлов с водой образуются алкины. До настоящего времени этот старый (1862 г.) метод являлся одним из промышленных источников получения ацетилена: взаимодействием карбида кальция с водой. Аналогично реагируют SnC2 b BaC2:
Карбид магния Mg2C3 с водой образует пропин:
Пиролиз метана
Пиролиз метана при очень высокой температуре ведет к получению ацетилена. В этих условиях ацетилен термодинамически нестабилен, поэтому пиролиз проводят при очень коротких интервалах времени (сотые доли секунды):
При окислительном пиролизе с добавкой кислорода часть метана сгорает, давая необходимую для разложения температуру:
Выход ацетилена составляет ~15 %. Пиролиз жидких углеводородов или гомологов метана при 1200-1500 °С приводит к образованию ацетилена легче, чем крекинг метана.
Синтез из элементов
Пропуская вольтову дугу между угольными электродами в атмосфере водорода, Бертло получил ацетилен. Этот метод лишен какого-либо практического значения, но важен исторически.
Дегидрогалогенирование дигалогеналканов
Ацетиленовые углеводороды образуются при действии спиртового раствора щелочи на геминальные или вицинальные дигалогенпроизводные алканов:
Реакция дегидрогалогенирования идет в две стадии:
|
||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 4273; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.009 с.) |

 и образующие гомологический ряд общей формулы CnH2n-2.
и образующие гомологический ряд общей формулы CnH2n-2.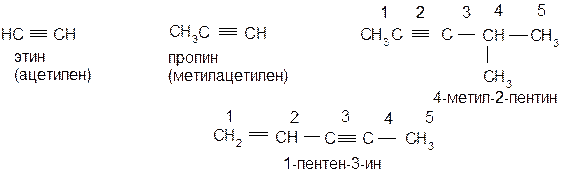


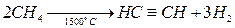











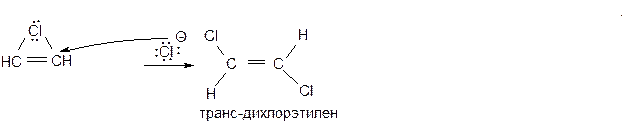



 , так как электроотрицательность атома углерода в sp3-гибридизации меньше (2,5), чем в sp2-гибридизации (2,8).
, так как электроотрицательность атома углерода в sp3-гибридизации меньше (2,5), чем в sp2-гибридизации (2,8).





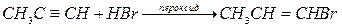



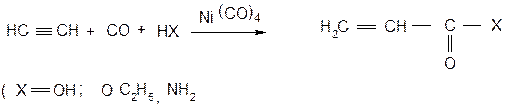



 ) реагируют с алкинами с образованием карбоновых кислот, т.е. происходит расщепление молекулы по тройной связи. В отдельных случаях удается изолировать продукты частичного окисления – α-дикетоны.
) реагируют с алкинами с образованием карбоновых кислот, т.е. происходит расщепление молекулы по тройной связи. В отдельных случаях удается изолировать продукты частичного окисления – α-дикетоны.




