
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт 2. Получение и свойства аммиакатных комплексов кобальтаСодержание книги
Поиск на нашем сайте
В две пробирки внести по 2 - 3 капли раствора соли кобальта (II) и прибавить по каплям концентрированный раствор аммиака до выпадения осадка гидроксида кобальта (II) и его дальнейшего растворения вследствие образования комплексного соединения. Одну из пробирок несколько раз встряхнуть до изменения окраски от зеленоватой до желто-коричневой. Во вторую пробирку добавить 2 - 3 капли 3%-ного раствора пероксида водорода. - Отметить, какие изменения происходят в пробирках
- Составить уравнение реакции образования осадка гидроксида кобальта (II) при действии недостатка аммиака: CoCl2 + NH4OH ®
- Составить уравнение реакции растворения осадка гидроксида кобальта (II) при действии избытка аммиака и образования аммиакатного комплекса кобальта (II): Co(OH)2 + NH4OH ®
- Составить уравнение реакции окисления кислородом воздуха полученного аммиакатного комплекса кобальта (II) в комплексное соединение кобальта (III): [Co(NH3)6](OH)2 + O2 + H2O ®
- Составить уравнение реакции окисления полученного комплексного соединения кобальта (II) пероксидом водорода с образованием аммиакатного комплекса кобальта (III): [Co(NH3)6](OH)2 + H2O2 ®
- Используя данные диаграммы Латимера, объясните, почему аммиакатный комплексный ион Со(II) окисляется кислородом воздуха, тогда как аквакомплекс Со(II) — [Со(Н2О)6]2+ — удается окислить лишь пероксидом водорода
- Составить уравнения диссоциации полученных комплексных соединений: [Co(NH3)6](OH)2 ®
[Co(NH3)6](OH)3 ® - диссоциации комплексных ионов и выражения констант их нестойкости [Co(NH3)6]2+
[Co(NH3)6]3+ - Укажите по величине константы нестойкости, какой комплексный ион прочнее: K нест [Co(NH3)6]2+ = K нест [Co(NH3)6]3+ =
- сравните координационные формулы комплексных соединений кобальта в разных степенях окисления, и укажите их пространственную конфигурацию: [Co(NH3)6]2+ [Co(NH3)6]3+
Опыт 3. Получение и свойства аммиакатного комплекса никеля(II) К 2-3 каплям раствора соли никеля (II) добавить несколько капель раствора аммиака до растворения осадка в результате образования аммиакатного комплекса. Добавить к раствору 2 - 3 капли раствора сульфида аммония (или сульфида натрия). - Отметить, какие изменения происходят в пробирке
- В осадок выпадает……………. - Составить уравнение реакции образования осадка гидроксида никеля (II) при действии недостатка аммиака: NiCl2 + NH4OH ®
- Составить уравнение реакции растворения осадка гидроксида никеля (II) при действии избытка аммиака и образования аммиакатного комплекса никеля (II): Ni(OH)2 + NH4OH ®
- Составить уравнение первичной диссоциации полученного комплексного соединения: [Ni(NH3)6](OH)2 ®
- Составить уравнение диссоциации комплексного иона и выражение для константы нестойкости [Ni(NH3)6]2+
K нест [Ni(NH3)6]2+ =
- Составить молекулярное и ионное уравнения реакции взаимодействия полученного комплексного соединения никеля с сульфидом аммония: [Ni(NH3)6]Cl2 + (NH4)2S ®
[Ni(NH3)6]2+ + S2- ®
- Рассчитайте константу равновесия по величине константы нестойкости комплексного иона и произведения растворимости сульфида никеля(II), определите направление протекания реакции. Кнест[Ni(NH3)6]2+ =10-8,3 ПРNiS = 9,3 10-22
Кравн = Вывод
Опыт 4. Получение и свойства гидроксида тетрааминмеди (II) В две пробирки внести по 4 капли раствора сульфата меди (II) и по каплям разбавленного раствора аммиака до образования и растворения осадка. В первую пробирку к образовавшемуся раствору сульфата тетрааминмеди (II) добавить по каплям 2 н. раствор азотной кислоты до образования и растворения осадка гидроксида меди (II); во вторую пробирку – несколько капель раствора сульфида натрия до образования осадка. - Охарактеризовать какие изменения произошли в пробирках;
- составить уравнение реакции образования сульфата тетрааминмеди (II) в молекулярной и ионной форме CuSO4 + NH4OH → …
- составить уравнение реакции взаимодействия сульфата тетрааминмеди (II) с соляной кислотой в молекулярной и ионной форме: [Cu(NH3)4]SO4 + HNO3 → …
- составить уравнение реакции учитывая, что во второй пробирке в осадок выпадает сульфид меди (II): [Cu(NH3)4]SO4 + Na2S → …
- Вывод
Опыт 5. Получение комплекса меди(I)
|
|||||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 776; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.130.154 (0.008 с.) |

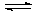 K нест [Co(NH3)6]2+ =
K нест [Co(NH3)6]2+ =


