Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Какой объем ацетилена образуется при взаимодействии 12,8г карбида кальция с водой.Содержание книги
Поиск на нашем сайте
Билет№8 1. Важнейшие классы неорганических соединений.
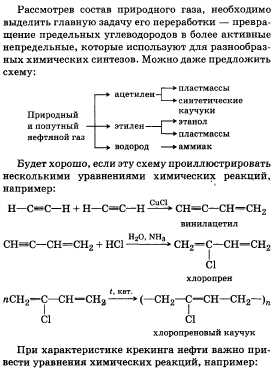
2.Природные источники углеводородов: нефть, их практическое использование. Природная нефть всегда содержит воду, минеральные соли и разного рода механические примеси. Поэтому, прежде чем поступить на переработку, природная нефть подвергается обезвоживанию, обессоливанию и ряду других предварительных операций.
Особенности перегонки нефти.
1. Способ получения нефтепродуктов путем отгонки из нефти одной фракции за другой подобно тому, как это осуществляется в лаборатории, для промышленных условий неприемлем.
2. Он очень непроизводителен, требует больших затрат и не обеспечивает достаточно четкого распределения углеводородов по фракциям в соответствии с их молекулярной массой.
Всех этих недостатков лишен способ перегонки нефти на непрерывно действующих трубчатых установках:
1) установка состоит из трубчатой печи для нагревания нефти и ректификационной колонны, где нефть разделяется на фракции (дистилляты) – отдельные смеси углеводородов в соответствии с их температурами кипения – бензин, лигроин, керосин и т. д.;
2) в трубчатой печи расположен в виде змеевика длинный трубопровод;
3) печь обогревается горящим мазутом или газом;
4) по трубопроводу непрерывно подается нефть, в нем она нагревается до 320–350 °C и в виде смеси жидкости и паров поступает в ректификационную колонну.
Особенности ректификационной колонны.
1. Ректификационная колонна – стальной цилиндрический аппарат высотой около 40 м.
2. Она имеет внутри несколько десятков горизонтальных перегородок с отверстиями, так называемых тарелок.
3. Пары нефти, поступая в колонну, поднимаются вверх и проходят через отверстия в тарелках.
4. Постепенно охлаждаясь при своем движении вверх, они сжижаются на тех или иных тарелках в зависимости от температур кипения.
5. Углеводороды менее летучие сжижаются уже на первых тарелках, образуя газойлевую фракцию, более летучие углеводороды собираются выше и образуют керосиновую фракцию, еще выше собирается лигроиновая фракция, наиболее летучие углеводороды выходят в виде паров из колонны и образуют бензин.
6. Часть бензина подается обратно в колонну для орошения, что способствует охлаждению и конденсации поднимающихся паров.
7. Жидкая часть нефти, поступающей в колонну, стекает по тарелкам вниз, образуя мазут.
Чтобы облегчить испарение летучих углеводородов, задерживающихся в мазуте, снизу навстречу стекающему мазуту подают перегретый пар.
8. Образующиеся фракции на определенных уровнях выводятся из колонны.
Далее они подвергаются очистке от примесей при помощи серной кислоты, щелочи и другими способами. Получить нерастворимое основание гидроксида меди (II) и доказать его свойства.
Билет №9 1. Металлы, их положение в периодической системе химических элементов Д. И. Менделеева, строение их атомов, металлическая связь. Общие химические свойства металлов.
2. Природные источники углеводородов: газ, нефть, каменный уголь и их практическое использование.
Сколько моль содержится 67.2 л оксида азота (IV)? Билет №10 1. Неметаллы, их положение в периодической системе химических элементов Д. И. Менделеева, строение их атомов. Окислительно-восстановительные свойства неметаллов на примере элементов подгруппы кислорода.
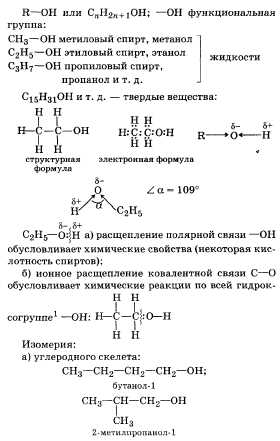
2. Предельные одноатомные спирты. Химическое строение гомологов данного класса. Свойства и применение этилового спирта. Экологическое и практическое значение. 3.Сколко грамм вещества содержится в 300г 5% раствора хлорида алюминия?
Билет №11 1. Аллотропия неорганических веществ на примере углерода и кислорода.
2. Фенол, его химическое строение, свойства, получение и применение.
3.Какова молекулярная формула углеводорода, содержащего 82,5% углерода и 17,5% водорода? Плотность по водороду паров этого вещества равна 29.
Билет №12
Степень окисления - это условный заряд атома в молекуле вычисленный согласно предположению, о том что молекула состоит только из ионов. Процесс отдачи электронов атомом, молекулой или ионом называется окислением: Э – nē → Э+n Э – восстановитель. Процесс присоединения электронов атомом, молекулой или ионом называется восстановлением: Э + nē → Э-n Э – окислитель. Атомы, ионы, молекулы, отдающие электроны – восстановители (сами окисляются). Атомы, ионы, молекулы, принимающие электроны – окислители (сами восстанавливаются). Окисление всегда сопряжено с восстановлением. Число электронов, участвующих в процессе окисления равно числу электронов, участвующих в процессе восстановления. ОКИСЛИТЕЛИ Атомы и молекулы элементов VI – VII групп (S, О2, Сl2) Ионы металлов в высоких степенях окисления (Fe3+, Cu2+) Ионы, молекулы, содержащие атомы металлов в высоких степенях окисления (KMn+7O4, K2Cr2+6O7) Ионы, молекулы, содержащие атомы неметаллов в высоких степенях окисления (HN+5O3, H2S+6O4, KCl+5O3) ВОССТАНОВИТЕЛИ Атомы всех металлов. Отрицательно заряженные ионы неметаллов (S2-, Cl-, Br-) Ионы металлов в низких степенях окисления (Fe2+, Mn2+) Ионы и молекулы, содержащие атомы в промежуточных степенях окисления (S+4O32-) H2, CO 2. Альдегиды, их химическое строение гомологов и свойства. Получение, применение муравьиного и уксусного альдегидов.
|
||||
|
Последнее изменение этой страницы: 2016-09-19; просмотров: 556; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.220.63.83 (0.007 с.) |