Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
По направлению 020400 «Биология»Содержание книги
Поиск на нашем сайте
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ ВЯТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ОБЩАЯ БИОЛОГИЯ ЛАБОРАТОРНЫЙ ПРАКТИКУМ Для студентов 1 курса, обучающихся По направлению 020400 «Биология»
КИРОВ, 2012
ОБЩАЯ БИОЛОГИЯ ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Направление 020400 «Биология»
КИРОВ 2012
ББК 28.0 Р 84 УДК 574.577
Лабораторный практикум по общей биологии / Составитель И.В.Дармов. - Киров, ВятГУ, 2012. – 68 с.
Лабораторный практикум по общей биологии составлен в соответствии с программой дисциплины «Общая биология» и предназначен для студентов 1 курса университета, обучающихся по направлению 020400 «Биология». В практикум включены задания, в ходе выполнения которых будущие бакалавры - биологи познакомятся с началами цитологии, закономерностями наследственности и изменчивости и методами их изучения. Одна из важных задач практикума – научить студентов работе в лаборатории с объектами живой природы, привить интерес к их изучению на макро- и микроуровне. Работа подготовлена на кафедре микробиологии ВятГУ. Рис. 4, табл. 11, библиогр. назв. 8.
Рецензент: доктор биологических наук, профессор В.Е.Романов
ISBN 5-230-07303-9 © И.В.Дармов, 2012
СОДЕРЖАНИЕ
Введение…………………………………………………………………. 5 Правила оформления лабораторных работ……………………………. 5 Порядок проведения занятия…………………………………………… 6 Техника безопасности…………………………………………………… 6 Тема 1. Устройство световых микроскопов и техника микроско- пирования. Особенности строения клеток прокариот и эукариот…………………………………………………..………. 7 Тема 2. Особенности строения животных и растительных клеток. Ультрамикроскопическая организация клеток прокариот и эукариот…………………………………………………………. 18 Тема 3. Размножение организмов. Деление клеток. Митоз. Мейоз... 22 Тема 4. Закономерности явлений наследственности. Дрозофила как объект генетических исследований……………………………… 29 Тема 5. Закономерности явлений изменчивости. Статистическое изучение модификационной изменчивости……………………. 37 Список литературы…………………………………………………… 45
ВВЕДЕНИЕ Лабораторный практикум по общей биологии предназначен для студентов 1 курса университета, обучающихся по направлению 020400 «Биология». Особенность предлагаемого курса состоит в том, что он является вводным по отношению ко всем остальным биологическим дисциплинам. При его освоении студенты должны опираться на знания, полученные при обучении в средних учебных заведениях. Основой практикума является изучение базовых понятий цитологии, способов размножения живых организмов и механизмов клеточного деления. Важное место в практикуме занимает освоение практических приемов световой микроскопии и приготовления временных микропрепаратов, ознакомление с методами изучения наследственности с использованием лабораторных линий дрозофилы, а также статистического анализа модификационной изменчивости. Практикум предполагает самостоятельную подготовку студентов к каждому занятию. Вопросы для самоподготовки приведены в начале соответствующей темы. Контроль знаний студентов осуществляется путем письменного решения тестовых заданий и устного собеседования с преподавателем по каждой теме.
ПРАВИЛА ОФОРМЛЕНИЯ ОТЧЕТОВ ПО ЛАБОРАТОРНЫМ РАБОТАМ Лабораторные работы следует оформлять в альбоме формата 30х21 см. В верхней части страницы необходимо указать номер и название темы, цели занятия; ниже должны быть представлены все материалы, которые перечислены в конце каждой темы (схемы, таблицы, зарисовки и т.д.). Зарисовки являются необходимым элементом изучения живого объекта; они нужны, чтобы лучше понять и закрепить в памяти строение объекта, форму отдельных структур, их взаимное расположение. Над каждым рисунком необходимо указать номер и название работы и воспроизвести содержание надписи, которое приведено в тексте каждого задания. При выполнении зарисовок необходимо пользоваться простым и несколькими цветными карандашами. Поскольку рисование на занятиях по биологии не самоцель, а метод изучения объекта, при зарисовке необходимо соблюдать следующие правила: 1. Рисовать только на одной стороне листа, т.к. рисунки, сделанные на обеих сторонах, накладываются друг на друга и со временем портятся. 2. Рисунок должен быть крупным, детали хорошо различимыми. На одной странице не следует помещать более 2-3 рисунков простых объектов. Если объект сложный и крупный, то делают только один рисунок на странице. 3. Главное требование к рисунку – правильное отображение формы, соотношения размеров (длины, ширины и высоты) отдельных частей и целого объекта. Чтобы добиться этого, сначала нужно нанести общий контур объекта (крупно), затем слегка наметить контуры основных деталей и лишь после этого вырисовать их четко. 4. Правильное отображение соотношения частей изучаемого организма позволит выполнить и другое требование – показать индивидуальные особенности объекта, т.е. зарисовать не абстрактную, а конкретную клетку, органеллу и т.д. Это очень важно, т.к. приучает будущего специалиста к наблюдательности, учит видеть наряду с общим индивидуальное. 5. Вокруг рисунка не нужно рисовать контуры поля зрения микроскопа. 6. На каждом рисунке обязательно должны быть сделаны обозначения его отдельных частей. Надписи выполняются авторучкой следующим способом: напротив отдельных частей объекта надо поставить стрелки и рядом с каждой написать название. Все надписи должны быть расположены параллельно друг другу. 7. Будьте внимательны: при изучении очередной темы должны быть выполнены и отражены в альбоме все без исключения задания, указанные в практикуме. Только после этого работа предъявляется преподавателю для проверки.
1. Введение – 5 минут. 2. Письменный контроль исходного уровня знаний (решение тестовых заданий) – 15 минут. 3. Собеседование по вопросам самоподготовки и коррекция знаний – 45 минут. 4. Самостоятельная работа – 110 минут. 5. Подведение итогов занятия –3 минуты. 6. Сбор отчетов (альбомов) для проверки преподавателем – 2 минуты.
ТЕХНИКА БЕЗОПАСНОСТИ
При выполнении лабораторных работ необходимо неукоснительно соблюдать общепринятые правила безопасного обращения с кислотами и щелочами, лабораторной стеклянной посудой (предметными и покровными стеклами, пипетками, чашками Петри, пробирками и др.), колющими и режущими инструментами (скальпелями, препаровальными иглами и др.), электрооборудованием (осветителями); соблюдать осторожность при использовании открытого огня (спиртовки); не допускать пролива и возгорания легковоспламеняющихся жидкостей (этилового спирта, эфира). КЛЕТОК ПРОКАРИОТ И ЭУКАРИОТ
Цели занятия: · Изучить устройство светового микроскопа, освоить методику установки света, технику приготовления и микроскопирования временных препаратов. · Познакомиться со строением клетки, научиться отличать прокариотические клетки от эукариотических. · Научиться правильно оформлять отчет о лабораторной работе.
Вопросы и задания для самоподготовки 1. Биология как наука. Методы биологии. 6. Основные положения современной клеточной теории. 7. Надцарства (империи) и царства живых организмов. 8. Строение прокариотической клетки. 9. Уметь показать на микроскопе механическую, оптическую и осветительную части и рассказать об их устройстве. 10. Какие бывают окуляры; объективы и их фокусное расстояние. Особенности иммерсионного объектива. 11. Что такое увеличение и разрешающая способность микроскопа? 12. Настройка освещения по методу светлого поля. 13. Основные правила работы с оптическим микроскопом. 14. Постоянные и временные микропрепараты. Основные этапы приготовления временных микропрепаратов.
Оборудование и материалы: 1. Микроскоп Микмед -5 или аналог. 2. Предметные и покровные стекла, чашки Петри, стаканчики с водой, глазные пипетки, пинцеты, ножницы, кусочки ваты, иммерсионное масло. 3. Постоянные микропрепараты: фиксированные окрашенные мазки культур сенной палочки и сарцины, крови лягушки. 4. Материалы для приготовления временных препаратов: 2-3 головки репчатого лука. 5. 0,01% раствор метиленовой сини, раствор иода.
Световая микроскопия – один из основных методов изучения биологических объектов, поэтому владение техникой микроскопирования необходимо для всех последующих занятий по биологическим наукам, а также для практической деятельности микробиолога. Рассмотрим конструкцию световых микроскопов на примере микроскопа отечественного производства Микмед - 5. Световой микроскоп состоит из трех основных частей: механической, осветительной, оптической. К механической ч а с т и относятся: штатив, револьверное устройство, макро- и микрометрические винты, предметный столик (рис.1).
Рисунок 1 – Устройство светового микроскопа Микмед -5 1 – окуляры; 2 – бинокулярная насадка; 3 – винт крепления насадки; 4 – револьверное устройство; 5 – объективы; 6 – штатив; 7 – предметный столик; 8 – кольцо;
Штатив состоит из массивного основания и изогнутого под углом тубусодержателя. Основание имеет снизу четыре опорные площадки, что обеспечивает устойчивое положение микроскопа на рабочем столе. В верхней части тубусодержателя имеется головка для закрепления бинокулярной насадки и гнездо с винтовой нарезкой для револьвера. Тубус (окулярная трубка) представляет собой полую трубку, в верхнюю часть которой вставляется окуляр. Револьвер (от лат. revolvo – вращаю) – это вращающийся диск с четырьмя гнездами для ввинчивания объективов. Винт грубой фокусировки микроскопа – макрометрический винт, или кремальера – расположен с левой стороны штатива. С помощью этого винта предметный столик передвигается в вертикальном направлении вверх и вниз на большое расстояние. Макрометрический винт используется при слабом увеличении, когда объект изучается главным образом в одной плоскости. Рукоятки микрометрической фокусировки (они - меньшего диаметра)расположены с обеих сторон штатива,используются при сильном увеличении и позволяют при их использовании рассматривать детали объекта, лежащие на разной глубине. Ими следует пользоваться только тогда, когда при помощи кремальеры объект поставлен точно в фокус. Предметный столик представляет собой четырехугольную пластину с отверстием в центре, над которым помещают предметное стекло с изучаемым объектом. Во избежание смещения, предметное стекло фиксируют специальным прижимом препаратоводителя. Справа под предметным столиком находятся рукоятки механизма координатного перемещения, с помощью которого препарат можно передвигать в поперечном и продольном направлениях. Конденсор находится под предметным столиком, состоит из двух линз, закрепленных в общую оправу, вставлен в кронштейн, который крепится к предметному столику. Для перемещения конденсора служит специальная рукоятка, расположенная слева от наблюдателя. Меняя положение конденсора, можно изменять интенсивность освещения объекта: при опускании освещенность уменьшается, при поднимании – увеличивается. Ирисовая диафрагма вмонтирована в нижнюю часть конденсора. Она представляет собой кольцо с подвижно укрепленными стальными пластинками, которые могут сдвигаться и раздвигаться с помощью особой ручки; в центре остается отверстие для прохождения светового пучка. Диафрагма позволяет регулировать величину светового потока; максимально суженная, она способствует наибольшей четкости изображения. О п т и ч е с к а я ч а с т ь микроскопа представлена окулярами и объективами. Окуляр (от лат. oculus – глаз) помещается в верхней части тубуса и обращен к глазу. Окуляр представляет собой две линзы, заключенные в металлическую гильзу. По числу на верхней плоскости окуляра можно судить о кратности его увеличения (х7, х10, х15). Окуляр можно вынимать из тубуса и заменять по мере необходимости другим. Объектив – это система линз, укрепленных в общей металлической оправе. Объективы ввинчиваются в гнезда револьвера и имеют различную кратность увеличения, которая обозначена числом на их боковой поверхности. Различают объективы малого увеличения (х4 и х10), объектив большого увеличения (х40) и иммерсионный объектив (х100), используемый для изучения наиболее мелких объектов. Все объективы по способу применения делят на сухие и иммерсионные (от лат. immersio – погружаю или окунаю). У сухих объективов между фронтальной линзой и рассматриваемым препаратом находится воздух. Воздух и стекло имеют разные показатели преломления света (соответственно 1,0 и 1,52), в результате чего лучи света, переходя из одной среды в другую, преломляются, рассеиваются, происходит частичное искажение рассматриваемых объектов (рис.2). У иммерсионных объективов пространство между фронтальной линзой и препаратом заполнено, как правило, кедровым маслом или водой. Предметное стекло, стекло объектива и кедровое масло имеют почти одинаковый показатель преломления света (1,52 и 1,515), поэтому лучи, проходя из одной среды в другую, почти не преломляются, свет не рассеивается, рассматриваемые объекты не искажаются. Показатель преломления света, близкий к таковому стекла, имеют и другие вещества, которые используются в качестве иммерсионных составов: касторовое масло (1,48-1,49), гвоздичное масло (1,53), смесь касторового и гвоздичного масел (1,515).
Рисунок 2 – Ход лучей между конденсором и объективом микроскопа Справа – сухой объектив, слева – иммерсионный. 1 – линза объектива; 2 – верхняя линза конденсора; 3 – предметное стекло; 4 – объект; 5 – покровное стекло; 6 – иммерсионное масло; 7 – воздух. АБ – луч света, проходящий через воздушную среду, отклоняется и не попадает в объектив; ВГ – луч света, проходящий через иммерсионное масло, попадает в объектив.
Общее увеличение микроскопа равно произведению увеличения объектива на увеличение окуляра. Эта величина, однако, не характеризует всех возможностей микроскопа. Увеличенное изображение может быть как четким, так и нечетким. Отчетливость получаемого изображения определяется разрешающей способностью микроскопа. Под последней понимают минимальное расстояние между двумя видимыми точками, когда они еще не сливаются в одну, т.е. чем лучше разрешающая способность, тем меньший объект можно увидеть. Разрешающая способность светового микроскопа определяется в основном дифракцией световых лучей и равна примерно половине длины волны используемого света. Освещая препарат светом с более короткой длиной волны (голубым или синим), можно увидеть более мелкие объекты; при этом разрешающая способность микроскопа близка к 0,2 мкм. С этой целью микроскоп укомплектован синим светофильтром. ЗАДАНИЕ. Ознакомьтесь с устройством световых микроскопов. Найдите и назовите все их основные части.
Настройка освещения
Наилучшие результаты при работе с микроскопом могут быть получены лишь при условии правильного освещения объекта. Вот один из способов установки света на микроскопе Микмед - 5. 1. Для настройки микроскопа приготовьте препарат, который представляет собой два положенных крест-накрест волоса. Для приготовления этого временного препарата отрежьте ножницами часть волоса длиной примерно 3 см, разрежьте его пополам и поместите оба кусочка друг на друга на предметное стекло, сделав перекрест. Затем глазной пипеткой нанесите на волосы каплю воды и накройте покровным стеклом. Постарайтесь избежать образования пузырьков воздуха под покровным стеклом: возьмите покровное стекло за боковые грани и прикоснитесь его ребром к поверхности капли воды с краю так, чтобы вода растеклась по ребру покровного стекла, затем осторожно опустите (уроните) покровное стекло на предметное. Научитесь брать каплю жидкости такого объема, чтобы она заполнила все пространство под покровным стеклом. Слишком малая капля жидкости не заполнит всего пространства, и оставшийся в виде пузырьков воздух затруднит работу. Взяв слишком большую каплю, вы увидите, что вода выступила за пределы покровного стекла. В этом случае избыток воды нужно удалить полоской фильтровальной бумаги. Препарат поместите на предметный столик и закрепите его прижимом препаратоводителя. Поставьте место перекреста волос точно в центр светового пучка. Вместо указанного препарата может быть использован любой другой препарат, детали которого хорошо различимы при малом увеличении. 2. Установите в рабочее положение объектив малого увеличения (х4). Когда объектив займет срединное положение над отверстием столика, в револьвере сработает защелка, при этом будет слышен легкий щелчок, и револьвер фиксируется. Поднимите конденсор до упора. При переходе к объективам других увеличений положение конденсора по высоте не менять. 3. Смотря сбоку, с помощью макрометрического винта поднимите предметный столик почти до соприкосновения объекта с с фронтальной линзой объектива. Глядя в окуляр, медленным вращением кремальеры в обратном направлении осторожно опускайте предметный столик до тех пор, пока в поле зрения не появятся очертания объекта. С помощью рукоятки механизма микрометрической фокусировки добейтесь резкого изображения объекта. ЗАДАНИЕ. Приготовьте микропрепарат и настройте освещение, как указано выше.
ТЕМА 3 МИТОЗ. МЕЙОЗ
Цели занятия: · Изучить основные формы бесполого и полового размножения. · Изучить митотический цикл клетки, научиться различать фазы митоза на временных препаратах клеток корешков растений. · Изучить структурные особенности метафазных хромосом. · Изучить основные стадии мейоза.
Вопросы и задания для самоподготовки
1. Дайте сравнительную характеристику бесполого и полового размноже- 3. Формы полового размножения, их особенности и значение. 4. Типы тканей по митотической активности. Резервный пул клеток. 5. Клеточный и митотический цикл, его фазы и периоды. 7. Биологическое значение митоза. Амитоз, эндомитоз, политения. 9. Мейоз, основные фазы и стадии I деления. 10. Мейоз, основные фазы II деления. 11. Отличия митоза от мейоза. 12. Биологическое значение мейоза. 13. Образование мужских и женских половых клеток, характеристика ос- 14. Место мейоза в жизненном цикле организмов.
Оборудование и материалы: 1. Микроскопы, предметные и покровные стекла, препаровальные иглы, пинцеты, стаканчики с дистиллированной водой, деревянные палочки (спички). 2. Свежевыращенные или фиксированные корешки лука, чеснока. 3. Стаканы с суспензией пекарских дрожжей. 4. Чашки Петри с культурой плесневого гриба мукор.
Растений ПОДГОТОВКА К ЗАНЯТИЮ (ОСУЩЕСТВЛЯЕТСЯ ЛАБОРАНТОМ) За 5-7 дней до начала занятий прорастите в стаканчике с водой несколько (2-3) головок репчатого лука и чеснока. Когда длина корешков достигнет 7-10 мм, отрежьте ножницами кончики корешков длиной около 5 мм. Поместите корешки в модифицированный фиксатор Карнуа (ледяная уксусная кислота и этанол в соотношении 1:3) на 3-4 часа. По истечении этого времени перенесите корешки в стакан с водой, перемешайте его содержимое стеклянной палочкой в течение нескольких минут, выньте корешки из воды и поместите во флакончик, содержащий 70%-ный раствор этанола, для хранения. Флакончик закройте корковой пробкой и поставьте в холодильник. В таких условиях корешки могут храниться до года и более. За сутки до занятий поместите корешки на 10-15 минут в смесь концентрированной соляной кислоты и метанола (в соотношении 1:1) для размягчения (мацерации). Смесь осторожно слейте, а корешки промойте водой в течение 5 минут. Промытые корешки поместите в пенициллиновый флакончик с красителем (ацетоорсеин или ацетокармин) на 18-20 часов. Предметные и покровные стекла должны быть заранее тщательно обезжирены хромовой смесью, промыты дистиллированной водой и высушены. Заблаговременно приготовьте красители по следующей прописи: АЦЕТООРСЕИН. В стеклянную колбу объемом 150-200 мл наливают 45 мл ледяной уксусной кислоты, вставляют стеклянную воронку и помещают колбу в водяную баню на электроплитке с асбестовой пластинкой. В горячую уксусную кислоту осторожно через воронку вносят 1 г орсеина, растворяют его, покачивая колбу, охлаждают раствор и добавляют 55 мл дистиллированной воды. Раствор хорошо перемешивают, фильтруют. Готовый краситель хранят в холодильнике в склянке с притертой пробкой. АЦЕТОКАРМИН. В стеклянную колбу объемом 150-200 мл наливают 55 мл дистиллированной воды, добавляют 45 мл ледяной уксусной кислоты и 2-5 г кармина. В колбу вставляют стеклянную воронку. Затем колбу ставят на водяную баню или электроплитку, спираль которой закрыта асбестовой пластинкой. Раствор кипятят в течение 30-60 минут, охлаждают и фильтруют. Готовый краситель переливают в склянку с притертой пробкой и хранят в холодильнике неограниченное время.
ВЫПОЛНЕНИЕ РАБОТЫ
Препаровальной иглой извлеките из красителя корешок лука или чеснока, поместите его на предметное стекло в каплю красителя и накройте покровным стеклом, слегка надавив. Кончиком спички или деревянной палочки круговыми движениями (по спирали от центра к периферии) осторожно (!) раздавите корешок, стараясь распределить клетки равномерно в один слой, не смещая покровное стекло. Препарат поместите на предметный столик микроскопа и рассмотрите сначала при малом (с объективом х10), а затем при большом (с объективом х40) увеличении. Отыщите фазы митотического цикла.
ЗАДАНИЕ. Самостоятельно приготовьте несколько давленых препаратов из корешков лука и чеснока, подготовленных и окрашенных накануне.
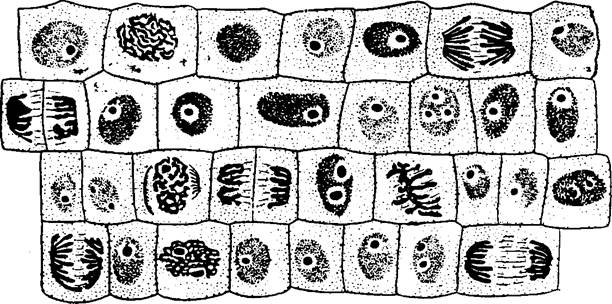
Выявление фаз митоза На давленом микропрепарате корешка лука или чеснока при малом увеличении микроскопа найдите в поле зрения зону деления. Затем этот участок рассмотрите с объективом х40. Найдите интерфазу и различные фазы митоза. Интерфаза (период между двумя делениями). Ядро в клетке округлое с четкими границами. В нем видны 1 или 2 ядрышка. В это время в клетке происходят сложные биохимические процессы, репликация ДНК, синтез белков (гистонов и др.). Профаза. Ядро увеличивается, в нем исчезают ядрышки. В кариоплазме появляется клубок из тонких нитей. Это – хромосомы (окрашенные тельца). В конце профазы ядерная мембрана растворяется и хромосомы оказываются в цитоплазме. Метафаза. Хромосомы приобретают вид сильно изогнутых палочковидных структур; каждая из них состоит из двух хроматид, соединенных посредством центромеры. К центромере присоединяются нити митотическоговеретена. Найдите клетки, где хромосомы лежат в экваториальной плоскости, образуя «метафазную звезду». Анафаза. В клетке видны две «звезды», т.к. хроматиды в результате сокращения нитей митотического веретена перемещаются к противоположным полюсам клетки. Хромосомы имеют вид шпильки. Телофаза. У противоположных полюсов клетки видны рыхлые клубки из частично деспирализованных хромосом, вокруг них формируются ядерные оболочки. Телофаза заканчивается цитокинезом – разделением цитоплазмы. В центре клеток начинает формироваться перегородка, которая постепенно делит материнскую клетку на две дочерние. У растительных клеток перегородка формируется от центра – кнаружи, а у животных клеток происходит перешнуровка материнской клетки надвое (за счет эластичности цитоплазматической мембраны). Разные виды растений и животных различаются по количеству хромосом и по морфологическим особенностям последних. Строение хромосом лучше всего выявляется в метафазе митоза, когда они укорочены и расположены в экваториальной плоскости клетки (метафазная пластинка). С.Г.Навашиным в 1914 году была разработана классификация хромосом по их морфологии (рис.4). Согласно этой классификации, хромосомы делятся на типы в зависимости от положения центромеры, т.е. от соотношения длин плеч. Кроме положения центромеры, форму хромосом определяет вторичное расчленение – наличие на концах хромосом своеобразных придатков – спутников, отделенных от хромосомы утонченной частью (ниточкой или стерженьком). Исследуя метафазные пластинки под микроскопом, определяют кариотип данного организма, т.е. особенности хромосомного аппарата диплоидной клетки, включая количество, размеры, форму хромосом, специфичных для каждого вида или особи. У большинства культурных растений в соматических клетках содержится небольшое число хромосом, например, у ржи и гороха – 7 пар, у кормовых бобов – 6 пар.
Рисунок 4 - Основные типы хромосом: 1,7 – метацентрическая (равноплечая), 2 – субметацентрическая (слабо неравноплечая), 3, 4, 5 – акроцентрическая (резко неравноплечая), 6 – телоцентрическая, 8 – акроцентрическая со вторичной перетяжкой, 9 – спутничная. Центромеры обозначены светлым кружком.
ЗАДАНИЕ. Зарисуйте клетки на различных стадиях митоза и в интерфазе.
Надпись над рисунком: Митоз в клетках корешка лука (Allium cepa L.) или чеснока. Давленый препарат. Окраска ацетоорсеином (или ацетокармином). х400. На рисунке должны быть указаны интерфаза, профаза, метафаза, анафаза, телофаза. Попытайтесь определить количество хромосом (2n) в клетках корешка изучаемого растения, запишите это число. Перерисуйте типы хромосом (рис.4) и запомните их названия.
ТЕМА 4 ИССЛЕДОВАНИЙ
Цели занятия: · Изучить законы Менделя и основные понятия классической генетики. · Изучить основные положения хромосомной теории наследственности. · Изучить биологию и морфологические признаки дрозофилы, уяснить правила работы с этим объектом. · Познакомиться с особенностями строения дрозофил мутантных линий. Вопросы для самоподготовки 1. Опыты Менделя по скрещиванию. Гибридологический метод. 2. Смысл терминов: доминантность, рецессивность, гомозиготность, гетерозиготность, ген, фен, генотип, фенотип. 3. Второй закон Менделя. Правила записи опытов по скрещиванию. 4. Решетка Пеннета. Цитологический смысл законов Менделя. 5. Третий закон Менделя. Правило чистоты гамет. 6. Статистическая природа генетических закономерностей. 7. Хромосомная теория наследственности. Генетические карты. 8. Биология дрозофилы. Особенности морфологии самок и самцов. 9. Мутантные линии дрозофилы. Обозначения мутантных линий и мутантных генов. 10. Методика скрещивания дрозофил.
Оборудование и материалы: 1. Микроскопы, лупы, термостат с температурой 25оС. 2. Предметные и покровные стекла, кисточки, пинцеты, препаровальные иглы, стаканчики с водой, нестерильные пробирки с ватно-марлевыми пробками, пробирки с питательной средой, эфир для наркоза, листы белой бумаги. 3. Пробирки с наркотизированными линиями дрозофилы: дикого типа, white, black, vermillion, scarlet, cut, muller-5, vestigial, yellow cut vermillion, vestigial scarlet. 4. Живые объекты: лабораторные популяции дрозофилы, в которых имеются все стадии жизненного цикла; самцы и самки (раздельно) для скрещивания (дикий тип, vestigial, scarlet, white).
ОБЩИЕ ЗАМЕЧАНИЯ ПО БИОЛОГИИ ДРОЗОФИЛЫ Плодовая мушка Drosophila melanogaster является удобным объектом генетических исследований. Ее преимущество перед другими объектами заключается в непродолжительном цикле развития, высокой плодовитости, большом числе изученных генов, определяющих легко различимые признаки, малом числе хромосом (2n=8), удобстве и дешевизне разведения. Drosophila melanogaster представляет собой небольшую муху длиной около 3 мм с темно-красными глазами и телом серого цвета. Прямые нормально развитые крылья расположены вдоль тела и превышают его по длине на 1/3. Самки дрозофилы крупнее самцов, имеют широкое заостренное на конце брюшко, на спинке – хорошо заметные пигментированные кольца (тергиты), их 5-6. У самцов более узкое округленное брюшко, пигментных колец на брюшке 2-3, на конце они слиты в одно. Кроме того, у самцов имеются так называемые половые гребешки в виде ряда крепких хитиновых щетинок на первом (дистальном) членике передних ног, которыми они пользуются для удержания самок во время копуляции. Однако этот признак можно различить только под микроскопом. Продолжительность жизненного цикла дрозофилы при оптимальной температуре развития +25оС составляет 10 суток. При снижении температуры на 1оС развитие замедляется в среднем на сутки (например, при температуре +20оС – до 14-15 дней). При повышении температуры цикл развития, соответственно, ускоряется (например, при температуре +27оС – до 8-9 суток). Однако повышение температуры выше +27оС приводит к падению плодовитости мух вплоть до их полной стерильности. Питается дрозофила фруктами и овощами. В лаборатории ее разводят на специальных питательных средах. Яйцо дрозофилы длиной около 0,5 мм снабжено двумя отростками, при помощи которых оно держится на поверхности среды. Самка откладывает яйца вскоре после оплодотворения. В благоприятных условиях каждая самка откладывает до 50-80 яиц в сутки, а в течение 3-4 суток может отложить более 200 яиц. В лабораторных условиях личинки появляются из яиц через 20-24 часа после оплодотворения. Личиночный период состоит из 3 стадий. Первая и вторая стадии заканчиваются линьками, третья – окукливанием, которое начинается примерно через 4 суток после вылупливания из яйца. Первое время после выхода личинки находятся на поверхности среды, затем они уходят вглубь ее, интенсивно питаются, растут, а перед окукливанием покидают питательную среду, перестают питаться и некоторое время ползают по стенкам сосуда. Затем они становятся неподвижными, сокращаются в длину и приобретают характерную для куколки форму; в состоянии куколки они находятся примерно 4 суток. За это время разрушаются личиночные органы и формируются органы взрослой мухи. Только гонады и нервная система не претерпевают изменений. В конце стадии куколки сквозь оболочку просвечивают темные участки тела, хорошо видны глаза, особенно, если они имеют яркую окраску. У только что вылупившихся мух более длинное тело, почти лишенное пигмента, короткие, еще не расправившиеся крылья. Через 8-10 часов самки уже способны к оплодотворению. Они начинают откладывать яйца с конца вторых суток и продолжают до конца жизни. Плодовая муха широко распространена в природе, особенно в южных районах. В средней полосе она появляется обычно летом с обилием овощей и фруктов. Для проведения генетических исследований в первой трети ХХ века в лаборатории Т.Г.Моргана были выведены мутантные линии дрозофилы, многие из которых сохранены и используются генетиками до сих пор. Лабораторные коллекции характеризуются, как правило, большим набором линий мух, которые отличаются от дикого типа изменением того или иного признака. Установлено, что у самок дрозофилы после спаривания жизнеспособная сперма может сохраняться в половых путях в течение нескольких суток. Поэтому у оплодотворенной самки в любой данный момент в семяприемнике находится некоторое количество спермы от предыдущей копуляции. По этой причине и во избежание искаженных результатов в опытах скрещивания используются только девственные (виргильные) самки, которых отбирают в течение 6-8 часов после вылета из куколки, когда они еще не способны к оплодотворению.
Дрозофил мутантных линий В генетических исследованиях используются мутантные линии дрозофилы. Чаще всего у дрозофилы мутационным изменениям подвергаются такие признаки, как форма и окраска глаз, окраска тела, форма и характер развития крыльев, строение щетинок. Соответствующие мутации локализованы на хромосомах. Дрозофила имеет 8 хромосом (2n=8), число групп сцепления равно 4. У с
|
|||||||
|
Последнее изменение этой страницы: 2016-09-19; просмотров: 819; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.63.199 (0.017 с.) |