
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Це кінетична енергія всіх частинок системи (молекул, атомів, електронів тощо) та потенціальна енергія їх взаємодії, за винятком кінетичної та потенціальної енергії системи в цілому.Содержание книги
Поиск на нашем сайте
Тому, що це кінетична енергія всіх частинок системи (молекул, атомів, електронів тощо) та потенціальна енергія їх взаємодії, за винятком кінетичної та потенціальної енергії системи в цілому
162). В яких системах крітерієм напряму перебігу самодовільних процесів є ентропія? В ізольованих системах, для яких V=const та U=const Тому, що в ізольованих системах при постійному значенні об’єму та внутрішньої енергії критерієм напрямку перебігу самодовільних процесів є ентропія.
163). В якому випадку константа хімічної рівноваги зменшується? При підвищенні тиску - для реакції, що йде із збільшенням числа молів газоподібних речовин. Тому, що для реакцій, що проходять зі збільшенням числа молів газоподібних речовин, підвищується тиск, а тому реакція зміщується в сторону зменшення тиску, тобто в сторону зменшення константи хімічної рівноваги .
164). Для реакції A+ B <=> C + D вихідні концентрації речовин дорівнюють: СА = 1 моль/л, СВ = 2 моль/л, СC = 3 моль/л, СD = 4 моль/л. В якому напрямку проходитиме реакція, якщо константа рівноваги Kp =5? Самодовільно піде зворотна реакція Тому, що добуток концентрації продуктів реакції буде більше добутку концентрації вихідних речовин, реакція буде йти в зворотньому напрямку.
165). Як зміниться швидкість прямої реакції 2A => B + C після того, як прореагує 50% початкової кількості речовини А? Зменшиться у 4 рази Тому, що після того як концентрація вихідної речовини зменшиться на 50% (тобто зменшиться в 2 рази)її концентрація буде дорівнювати
166). Яка з нижченаведених особливостей не є характерною для каталізаторів? Каталізатор характеризується здатністю до підвищення концентрації реагуючих речовин на поверхні поділу фаз, що зумовлює його каталітичну активність. Тому, що взагалі каталізатор характеризується селективністю до окремих реакцій, не впливає на константу рівноваги, а лише прискорює її становлення, зменшує енергію активації реакції, інколи бере участь в хімічному процесі, витрачаючись на одній стадії і регенерується на іншій.
167). Якщо реакція протікає в дві стадії, а продукт першої стадії є вихідною речовиною другої стадії, то така реакція має назву Послідовна реакція Тому, що послідовні реакції це реакції, коли продукт першої реакції є вихідною речовиною другої реакції і т.д.
168). Якими є характерні особливості кінетики хімічної реакції першого порядку? Швидкість реакції пропорційна поточній концентрації, період напівперетворення не залежить від початкової концентрації. Кінетичне рівняння реакції першого порядку (I) та період напівперетворення (II) показують, що швидкість реакції пропорційна поточній концентрації (С0). Період напівперетворення (II) не залежить від початкової концентрації реагуючих речовин.
169). Яким приблизно буде потенціал водневого електроду, зануреного до дистильованої води при стандартній температурі? Приблизно –0,4 Тому, що
170). Що називається електродом другого роду? Електрод, що складається з металу, покритого шаром його важкорозчинної солі і зануреного в розчин, який містить аніони цієї солі. Тому, що схематично ці електроди зображають так:Ме/МеА, Аn-. Наприклад, Ag/AgCl, KCl – хлорсрібний електрод складається із срібної дротини або пластинки з нанесеним на неї шаром важкорозчинної солі (AgCl), зануреної в розчин KCl.
171). Як веде себе залежність осмотичного тиску розчину ПАР від концентрації ПАР після досягнення ККМ? Осмотичний тиск припиняє зростання та залишається практично незмінним або зростає дуже мало. Тому, що критична концентрація міцелоутворення (ККМ) – це концентрація ПАР при якій в його розчині виникає число міцел, що перебувають в термодинамічній рівновазі з молекулами (йонами) і різко змінюється ряд властивостей розчинів, в тому числі і осмотичний тиск, який практично в золі ККМ не змінюється.
172). Чим обумовлюється броунівський рух частинок дисперсних систем?
|
||||
|
Последнее изменение этой страницы: 2016-09-19; просмотров: 229; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.165.149 (0.008 с.) |

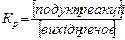
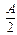 . Швидкість реакції
. Швидкість реакції  в той час як на початку швидкість реакції дорівнювала
в той час як на початку швидкість реакції дорівнювала  . Таким чином швидкість реакції при зменшенні концентрації в 2 рази зменшиться в 4 рази.
. Таким чином швидкість реакції при зменшенні концентрації в 2 рази зменшиться в 4 рази.



