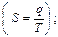Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Захист колоїдного розчину від коагуляції.Содержание книги
Поиск на нашем сайте
Тому, що білки, полісахариди та ін. ВМР піднімають величину порогу коагуляції золів, виконують захисну дію. Це використовують при одержанні препаратів срібла, золота та ін.
122)Яке із п’яти тверджень правильне: поверхнева енергія більше поверхневого натягу; Тому, що поверхневий натяг - це лише та поверхнева енергія, яка відноситься до одиниці (наприклад до 1 м2) поверхні поділу фаз.
123) Поверхневий натяг рідин не визначають: осмометричним методом; Тому, що всі інші приведені методи використовуються, а осмометричний метод використовується при визначенні молекул маси речовин. 124) Який вигляд має ізотерма поверхневого натягу: гіпербола; 125)Позитивній адсорбції відповідає: С2 > С1, s2 < s1, d s / dС < 0, G > 0; Тому, що відповідь дає довільний підбір чисел в рівняння Гіббса:
126). Яка з перелічених величин є поверхневою активністю: d s/dС; Тому, що у формулі - 127). Рівнянню Гіббса відповідає вираз: Тому, що у формулі - 128). Указати порядок реакції, якщо швидкість реакції не залежить від концентрації реагуючих речовин: Нульовий. Тому, що якщо швидкість реакції не залежить від концентрації реагуючих речовин, тобто швидкість підводу речовин більша швидкості її розходу називаються реакціями нульового порядку. 129). На константу швидкості хімічної реакції не впливає: концентрація реагуючих речовин; Тому, що константа швидкості хімічної реакції – це швидкість реакції при концентрації реагуючих речовин рівних 1, тому не залежить від концентрації реагуючих речовин.
130). При гомогенному каталізі: каталізатор та реагуюча суміш знаходяться в одній фазі; Тому, що гомогенний каталіз – це каталіз, коли каталізатор і всі реагуючи речовини складають одну загальну фазу. 131). Гомогенна система складається з: компонентів, які знаходяться в одній фазі; Тому, що всі компоненти системи знаходяться в рідкому або газоподібному стані. 132). Правильному відношенню відповідає вираз: Тому, що це математичний вираз для оборотних процесів другого закону термодинаміки. За фізичним змістом ентропія (S) – це кількість зв’язаної енергії (доля внутрішньої енергії, яка не може бути перетворена в корисну роботу) віднесена до одного градуса
133). Рівнянню енергії Гіббса відповідає вираз: ∆G = ∆H – T∆S; 134). Ентропія системи зменшується в процесі: Кристалізації; Тому, що ентропія є функцією неупорядкованості (хаотичного руху) багатьох молекул. Тобто чим більше значення ентропії тим більш неупорядкована система. Тоту ентропія правильно утвореного кристалу чистої речовини при абсолютному 0 рівна 0. Тому процес кристалізації речовини веде до зменшення ентропії.
135). Метод газової хроматографії використовується для ідентифікації досліджуваних сполук. Параметр, за допомогою якого проводять ідентифікацію речовини у газовій хроматографії: час утримання; Тому, що це час від моменту введення проби до моменту появи на хроматограмі максимуму піка. 136). До якого типу хроматографії відносять метод газо-рідинної хроматографії: розподільча; Тому, що газорідинна хроматографія використовується для розділення легких, органічних та неорганічних речовин. 137). В’язкість – це: внутрішнє тертя між шарами рідин або газів, які рухаються відносно один одного; Тому, що це основне визначення поняття «в’язкість». 138). Рівнянню Пуазейля відповідає вираз:
Тому, що рівняння запропоноване Пуазейлем для визначення в’язкості крові: V – об’єм рідини, яка витікає із капіляра; r - радіус капіляра; l – довжина капіляра; p – тиск, під яким рідина продавлюється через капіляр; t – час дослідження; h- в’язкість рідини.
139). Серед наведених методів аналізу дисперсних систем оптичним не є: віскозиметрія; Яка використовується для визначення молекул маси високомолекулярних речовин (ВМС) і не відноситься до оптичних методів взагалі. 140). Коагуляція – це: процес злиття (або злипання) частинок дисперсної фази при втраті системою агрегативної стійкості; Тому, що коагуляція – це процес протилежний стійкості дисперсних систем, тобто можливості протягом певного часу зберігати незмінними склад та основні властивості. 140). Указати, який із наведених не є методом очистки колоїдних розчинів: нефелометрія; Яка не відноситься до методів очистки, а являється оптичним методом аналізу, який полягає у вимірювані інтенсивності розсіяного світла і визначенні концентрації золю або розмірів його частинок.
141). Активність – це величина: підстановка якої замість концентрації в термодинамічні рівняння робить їх справедливими для реальних систем; Тому, що рівняння класичної теорії електролітичної дисоціації Арреніуса для опису концентрованих слабких і сильних електролітів (будь-якої концентрації) призводило до великих похибок. Вимірювання ступеня іонізації різними методами давали результати, які не узгоджувались між собою. Цю проблему рішили П. Дебай та Г.Гюккель, які припустили, що навколо кожного позитивного йона скупчуються негативно заряджені йони, утворюючи іонну атмосферу. Це зніжує рухливість йона. Для кількісних розрахунків характеристик розчинів сильних електролітів. Г.Льюіс запропонував замість концентрації використовувати активність електроліту. - ас і активність його йонів: а+ - катіонів; а- - аніонів.
142). Еквівалентна електропровідність має найбільше значення, якщо: це гранично розведений розчин. Тому, що еквівалентна електропровідність зростає зі збільшенням розведення розчину, в якому знаходиться однакова кількість молекул, а число йонів у міру розведення збільшується. Еквівалентна електропровідність досягає максимуму, коли ступінь іонізації дорівнюватиме одиниці і всі молекули розпадуться на йони. Цей стан називають гранично розведений розчин.
143). За допомогою гальванічного елементу Ag, AgCl½HCl½скляна мембрана½досліджуваний розчин½KCl½AgCl, Ag можна проводити титрування: кислотно-основне; Тому, що скляний електрод та електрод порівняння хлорсрібний використовують в ксилотно-основному титруванні. 144). Указати типи набухання: Обмежене та необмежене. Тому, що в залежності від будови макроланцюга полімера і характеру взаємодії макромолекул між собою і молекулами розчинника розрізняють обмежене і не обмежене набухання.
145). Тиск набухання визначають за емпіричним рівнянням Позняка, яке має вираз: π = kС 1/ n ; Тому, що при набуханні полімера в умовах збереження сталого об’єму виникає тиск набуханні який розраховується за імперічним рівнянням Позняка. π = kС 1/ n ;
146). Під дією електролітів відбувається процес виділення ВМР із розчину, який має назву: висолювання; Тому, що при введенні до розчину ВМР великих кількостей електролітів спостерігається виділення ВМР із розчину, тобто його розшарування. Це явище отримало назву – висолювання. 147). В ІЕТ білкова молекула: не переміщується в постійному електричному полі; Тому, що при певному значенні рН, яке називається ізоелектричною точкою (ІЕТ). Число іонізованих основних груп білка дорівнює числу іонізованих кислотних груп. В такому стані молекула білка електронейтральна і її електрична рухомість падає до нуля. 148). Якщо рН розчину менше рН ІЕТ білка, то в розчині: превалюють катіонні форми амінокислот;. Якщо, наприклад, рН розчину 5, а рН ІЕТ 10, то зрозуміло, що розчин кислий, а значить амінокислота знаходиться в катіонні формі
149). Драглі – це системи, які утворюються внаслідок:
|
||||
|
Последнее изменение этой страницы: 2016-09-19; просмотров: 271; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.176.213 (0.007 с.) |


 називається поверхневою активністю.
називається поверхневою активністю.