
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Стандартизация растворов титрантовСодержание книги Поиск на нашем сайте Раствор титранта должен быть стандартизирован. Под стандартизацией раствора имеют ввиду установление его точной концентрации с относительной погрешностью не превышающей 0,1%. Различ. станд. р-ры 1-ого и 2-ого рода. Р-ры 1-ого рода называют приготовленными, а р-ры 2-ого рода – установленными. Приготовленные р-ры точной концентрации получают растворением точной навески с тщательно очищенного исходного вещества в определённом объёме растворителя (воды). Так готовят титрованный водный р-р NaCl. Но многие р-ры (HCl) так приготовить нельзя. В таких случаях готовят р-р титранта, концентрация которого известна лишь приблизительно, а затем его стандартизируют, т.е. устанавливают концентрацию точно. При этом применяют специальные установочные вещества, так называемые СТАНДАРТЫ. Эти вещества должны иметь состав точно отвечающий химической формуле, быть устойчивыми на воздухе и иметь по возможности большую молярную массу эквивалента. Они должны быть достаточно доступными и легко очищаться от примесей. Реакция титранта с р-ром установочного вещества должна отвечать требованиям, которые предъявляют к титрометрическим реакциям. Например, р-ры NaOH и KOH часто стандартизируют по бифталату калия:
Как правило стандартизацию стремятся проводить в тех же условиях, какие будут при выполнении анализа и использовать для этого по возможности тоже вещество, которое будет анализироваться в дальнейшем. После установления точной концентрации установочного р-ра его можно использовать как титрант.
Точка эквивалентности ЭКВИВАЛЕНТ – некая реальная или условная частица числа Х, которая в данной кослотно-основной реакции эквивалентна 1 иону Н+ (реже иону ОН-) или в данной реакции окисления-восстановления эквивалентна 1 электрону. Под условной частицей (структурным элементом) понимают как реально существующие частицы (электроны, ионы, атомы, молекулы), так и доли этих частиц, иногда их группы. Фактор эквивалентности и эквивалент данного вещества являются непостоянными величинами, а зависят от стехиометрии реакции, определяющей число ионов водорода в реакции либо число полученных или отданных электронов в реакции. Точка эквивалентности (в титриметрическом анализе) — момент титрования, когда число эквивалентов добавляемого титранта эквивалентно или равно числу эквивалентов определяемого вещества в образце. Точкой эквивалентности называется момент, наступающий в ходе титрования, когда реагирующие вещества полностью прореагировали. В этот момент они находятся в эквивалентных количествах, т.е. достаточных для полного, без остатка, протекания реакции.
Точка конца титрования В точке эквивалентности наблюдается резкое изменение электропроводности. Титрование проводят до точки конца титрования, когда с помощью приборн.методов устанавливают соответствие эквивалентности титранта и титруемого вещества. Точка конца титрования соответствует точному объему добавленного титранта, кот. не меньше эквивалент-го объема титранта, т.е. равно или чуть больше, эта точка устанавливается индикатор.методами, физико-хим.инструм-ми методами. В индикаторных методах чаще всего исп.цветной индикатор, кот.изменяет свой цвет. Кривые титрования Способы титрования В титриметрии испол. 3 способа титрования: прямое, обратное и по заместителю. Прямое титрование – титров. р-ра опред.вещества А непосредственно р-м титранта В. Его применяют в том случае, если р-я между А и В протекает быстро. Содержание комп-та А при прямом титр-нии титрантом В рас-ся на основе р-ва п(А)=п(В). В кач-ве примера определ.в-ва сп-м прямого тит-я след.р-я титр-я:
n (CH3COOH)=n (NaOH) Обратное титр-е зак-ся в добавлении к опред.в-ву А избытка точно известного к-ва станд.р-ра В и после завершения р-ии между ними осущ.титров-е ост-гося кол-ва в-вар-м титранта В’. Этот способ применяют в тех случаях, когда р-я между А и В протек.нед.быстро, либо нет подх-гоиндикатора для фиксир-я точки экв-ти этой реакции. Пример:
n(1/2 CaCO3)=n(HCl)- n(NaOH) Титрование по заместителю з-ся в титр-ии титрантом В не опред.в-ва А, а экв-го ему кол-ва з-ля А’, получив-гося в рез-те предвар.провед-й р-ии между опред.в-м А и каким-либо реагентом. Титров-е по з-лю примен.обычно в тех случаях, когда невозможно провести прямое титрование. К-во молей эк-та опред-го в-ва титр-ии з-ля всегда равно к-ву молей эк-та титранта п(А)=п(В)=п(А’). пример:
n(K2Cr2O7)= n(I2)= n(Na2S2O3)
|
||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 262; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.102 (0.007 с.) |


 CH3COOH + NaOH CH3COONa + H2O
CH3COOH + NaOH CH3COONa + H2O CaCO3 + 2HCl (из-к) CaCl2 + CO2 + H2O
CaCO3 + 2HCl (из-к) CaCl2 + CO2 + H2O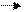 HCl (ост) + NaOH NaCl + H2O
HCl (ост) + NaOH NaCl + H2O K2Cr2O7 + 6KI + 7H2SO4 Cr2(SO4)3 + 3I2 (з-ль) + 4K2SO4 + 7H2O
K2Cr2O7 + 6KI + 7H2SO4 Cr2(SO4)3 + 3I2 (з-ль) + 4K2SO4 + 7H2O I2 + 2Na2S2O3 2NaI + Na2S4O6
I2 + 2Na2S2O3 2NaI + Na2S4O6


