
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Какие продукты выделяются на катоде и аноде.Содержание книги
Поиск на нашем сайте
На катоде выделяется Cu, на аноде – Cl2. б) NaОН = Na+ + ОН-. K(-) A(+) инертный Na+ 4ОН 2H2O + 2ē = H2 + 2OH- На катоде выделяется Н2, на аноде – О2. 2. Составить схемы электролиза и написать уравнения электродных процессов водного раствора сульфата никеля (II), если: а) анод инертный; б) анод никелевый. Какие продукты выделяются на катоде и аноде?
K(-) A(+) инертный Ni2+ + 2ē = Ni 2H2O + 2ē = H2 + 2OH- 2H2O – 4ē = О2 + 4H+. На катоде выделяется Ni и H2, на аноде выделяется О2. б) анод – никелевый: NiSO4 = Ni2+ + K(-) A(+) (Ni) Ni2+ + 2ē = Ni 2H2O + 2ē = H2 + 2OH- Ni – 2ē = Ni2+. На катоде выделяется Ni и H2, на аноде растворяется Ni. 3. При электролизе растворов а) нитрата кальция, б) нитрата серебра на аноде выделяется 560 мл газа (н.у.). Составить схему электролиза и написать уравнения электродных процессов. Определить, какое вещество и в каком количестве выделилось на катоде. Анод инертный.
В соответствии со схемой электролиза n эк (О2)(анод) = n эк (Н2)(катод) или Откуда
На катоде выделилось 1120 см3 водорода. Ответ: 1120 см3 водорода. б) AgNO3 = Ag+ + Схема электролиза: K(-) A(+) инертный Ag+ + ē = Ag H2O 2H2O – 4ē = О2 + 4H+ На катоде выделяется Ag, на аноде выделяется О2. По закону эквивалентов: n эк(О2)(анод) = n эк(Ag)(катод) или
Откуда где На катоде выделилось 10,8 г серебра. Ответ: 10,8 г серебра. СПОСОБЫ ВЫРАЖЕНИЯ СОСТАВА РАСТВОРОВ УРОВЕНЬ А Записать выражение массовой доли растворенного вещества. Указать единицу измерения. Ответ:
Записать выражение молярной доли растворенного вещества. Ответ:
Записать выражение молярной концентрации вещества. Указать единицу измерения. Ответ: с в = Записать выражение молярной концентрации эквивалентов вещества. Указать единицу измерения. Ответ: с эк(в) = Записать выражение моляльности вещества в растворе. Указать единицу измерения. сm (в) = Записать выражение титра раствора вещества. Указать единицу измерения. Ответ: T в = ЭНЕРГЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ УРОВЕНЬ А 1. Указать, какие из приведенных реакций являются эндотермическими: а) Mn(к) + 1/2O2(г) = MnO(к); б) 1/2N2(г) + 3/2H2(г) = NH3(г); в) 1/2N2(г) + 1/2O2(г) = NO(г). Решение Так как данные реакции являются реакциями образования 1 моль сложного вещества из простых веществ, то изменение энтальпии приведенных процессов есть стандартная энтальпия образования этих веществ. Для определения теплового эффекта (изменения энтальпии) реакции из таблицы выписываем значения стандартных энтальпий образования: MnO(к)), NH3(г), NO(г): Δ f Hо (298 К, MnO(к)) = –384,93 кДж/моль; Δ f Hо(298 К, NH3(г)) = –46,2 кДж/моль; Δ f Hо = (298 К, NO(г)) = 90,3 кДж/моль. Реакции а, б имеют отрицательные значения изменения энтальпии, а реакция в – положительное значение изменения энтальпии. Эндотермическими являются те реакции, изменения энтальпии которых имеют положительные значения. Ответ: в). 2. Без использования табличных данных определить, для каких из перечисленных реакций изменение энтропии имеет положительное значение: а) CO(г) + H2(г) = C(к) + H2O(г); б) 2Cu(NO3)2(к) = 2CuO(к) + 4NO2(г) + O2(г); в) 2PbS(к) + 3O2(г) = 2PbO(к) + 2SO2(г). Решение Так как наибольшее значение стандартной энтропии имеют вещества, находящиеся в газообразном состоянии, то энтропия увеличивается, если в ходе реакции возрастает число газовых моль (реакция б)). При протекании реакций а и в наблюдается уменьшение числа газовых моль системы. Следовательно, изменение энтропии данных реакций имеет отриательное значение. Ответ: б). Написать формулу для расчета стандартной энтальпии растворения вещества. Указать единицы измерения. Ответ: ΔраствН°(298К) = СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ И ХИМИЧЕСКОЕ РАВНОВЕСИЕ УРОВЕНЬ А 1.Написать формулу связи Кр с термодинамическими функциями. Ответ: ∆ rG º(298 K) = ∆ rH º(298 K) – T ∆ rS º(298 K) = –2,3 RT lg Kp. 2. Написать формулу зависимости скорости реакции от температуры и Е акт. Ответ:
|
|||||||||||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 469; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.33 (0.008 с.) |

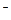 – 4ē = О2 + 2H2О
– 4ē = О2 + 2H2О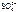 .
Схему электролиза составляем в соответствии с табл. 11.1. и 11.2:
.
Схему электролиза составляем в соответствии с табл. 11.1. и 11.2:
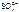
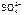 , Н2О
, Н2О  анод = 560 см3
Анод инертный
анод = 560 см3
Анод инертный
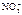 .
Схема электролиза:
K(-) A(+) инертный
Ca2+
.
Схема электролиза:
K(-) A(+) инертный
Ca2+ 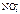 2H2O + 2ē = H2O – 4ē =
= H2 + 2OH- =О2 + 4H+
На катоде выделяется Н2, на аноде выделяется О2.
По закону эквивалентов:
n эк (В1)(анод) = n эк (В2)(катод)
2H2O + 2ē = H2O – 4ē =
= H2 + 2OH- =О2 + 4H+
На катоде выделяется Н2, на аноде выделяется О2.
По закону эквивалентов:
n эк (В1)(анод) = n эк (В2)(катод)
 –?
3.
–?
3.  –?
4.
–?
4. 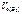 –?
–?
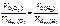 ,
,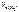 =
= 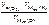 =
= 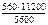 = 1120 см3,
= 1120 см3,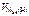 = 11200 см3/моль.
= 11200 см3/моль.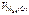 = 5600 см3/моль.
= 5600 см3/моль.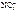 .
.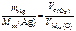 ,
,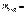
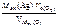 =
= 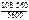 = 10,8 г.
= 10,8 г.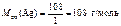 .
.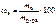 , %.
, %.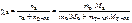 .
.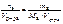 , моль/л.
, моль/л.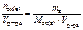 , моль/л.
, моль/л.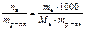 , моль/кг.
, моль/кг.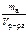 , г/см3.
, г/см3.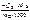 =
= 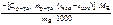 , кДж/моль.
, кДж/моль.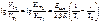 .
.


