
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определить моляльность вещества в растворе, если в 100 г раствора содержится 5,3 г карбоната натрия.Содержание книги
Поиск на нашем сайте
Массу воды определяем из условия
Тогда
Следовательно,
Где 1000 – коэффициент пересчета граммов в килограммы. Ответ: 5. Определить титр раствора вещества, если в 200 см3 раствора содержится 0,1 моль гидроксида калия.
Согласно условию задачи откуда m KOH = 0,1· M KOH = 0,1·56 = 5,6 г, где М КОН – молярная масса гидроксида калия: М КОН = 39 + 16 + 1 = 56 г/моль. Следовательно, Ответ: СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ И ХИМИЧЕСКОЕ РАВНОВЕСИЕ УРОВЕНЬ В Реакция между веществами А и В описывается уравнением А(г) + 2В(г) = 2С(г). Константа скорости этой реакции равна 0,1. Начальные концентрации реагирующих веществ с о(А) = 0,4 моль/л, с о(В) = 0,8 моль/л. Вычислить начальную скорость реакции и определить во сколько раз она изменится, если концентрация вещества А уменьшится на 0,1 моль/л.
Исходные вещества реагируют между собой согласно стехиометрическим коэффициентам в уравнении реакции. Моль А – 2 моль В 0,1 моль А – х моль В х = Следовательно, уменьшение концентрации вещества А на 0,1 моль/л сопровождается уменьшением концентрации вещества В на 0,2 моль/л, тогда: V кон = К· с А·
В связи с уменьшением концентрации реагирующих веществ в ходе реакции скорость реакции уменьшается:
Т.е. скорость реакции уменьшилась в 2,37 раза. Ответ: При уменьшении концентрации вещества А на 0,1 моль/л, скорость реакции уменьшилась в 2,37 раза. 2.Энергия активации некоторой реакции равна 60 кДж/моль. Во сколько раз изменится скорость реакции: а) при повышении температуры от 320 до 360 К? б) если она протекает при 298 К в присутствии катализатора (Е ак (кат)= 48 кДж/моль)?
б) Зависимость скорости реакции от наличия катализатора выражается уравнением
откуда Ответ: а) при повышении температуры от 320 до 360 К скорость реакции возрастает в 12,3 раза; б) в присутствии катализатора скорость реакции возрастает в 127 раз. 3.Используя справочные данные по Δ fH º(298 K) и S º(298 K) веществ, определить температуру, при которой константа равновесия реакции CO2(г) + C(к) <=> 2CO(г) равна единице. Записать выражение для константы равновесия данной реакции. Твердые вещества в выражение Кр не включаются. Значения Δ fH º(298 K) и S º (298 K) веществ берем из таблицы. По условию Кр = 1, следовательно, lgKp = 0, тогда Δ rH °(298 K) – T Δ rS °(298 K) = 0, T = где 103 – коэффициент пересчета килоджоулей в джоули. Δ rH º(298 K) = 2Δ fH º(298 K, CO(г)) – [Δ fH º(298 K, CO2(г)) + + Δ fH º(298 K, Cк)] Δ rH º(298 K) = 2(–110,5) – [(–393,5) + 0] = 172,5 кДж. Δ rS º(298 K) = 2 S º(298 K, CO(г)) – [ S º(298 K, CO2(г)) + S º(298 K, C(k))] = = 2·197,5 – (213,7 + 5,74) = 175,56 Дж/К. Т = Δ rH º(298 K) – T Δ rS º (298 K) = –2,303 RT lgKp Ответ: Кр = 1 при 982,6 К.
2. В 100 г воды содержится 2,3 г неэлектролита. Раствор обладает при 25 ºС осмотическим давлением, равным 618,5 кПа. Определить молярную массу неэлектролита. Плотность раствора принять равной 1 г/см3.
с в = где m в – масса растворенного неэлектролита, г; М в – молярная масса растворенного неэлектролита, г/моль. π = М в = Ответ: молярная масса растворенного вещества равна 90,06 г/моль. РАСТВОРЫ СИЛЬНЫХ И СЛАБЫХ ЭЛЕКТРОЛИТОВ. ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ. ИОННО-МОЛЕКУЛЯРНЫЕ УРАВНЕНИЯ УРОВЕНЬ В 1. Вычислить рН следующих водных растворов: а) 0,02 М HCl, б) 0,2 М KOH.
HCl – сильный электролит, α = 1,
n рН = -lg2·10-2 = -lg2 + (-lg10-2)= – 0,3 + 2 = 1,7. б) KOH = К+ + ОН-; рН = 14 – рОН; рОН = -lg c c КОН – сильный электролит, α = 1, n рОН = –lg(2·10-1) = –lg2 + (–lg10-1) = – 0,3 + 1 = 0,7. рН = 14 – 0,7 = 13,3. Ответ: рН 0,02 М HCl равно 1,7; РН 0,2 М КОН равно 13,3.
|
|||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 272; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.16.82.182 (0.009 с.) |


 .
.

 .
.
 ,
, моль/кг.
моль/кг.
 .
.

 = 0,1 моль,
= 0,1 моль, .
. = 0,028 г/см3.
= 0,028 г/см3. = 0,4 моль/л
с
= 0,4 моль/л
с  = 0,8 моль/л
с
= 0,8 моль/л
с  = K· с
= K· с  ·
·  =
= 0,1∙0,4·0,82 = = 0,0256 моль/(л∙с).
=
= 0,1∙0,4·0,82 = = 0,0256 моль/(л∙с).
 =?
=?
 моль.
моль. .
. = 0,1(0,4 – 0,1)(0,8 – 0,2)2 = 0,0108 моль/(л·с).
= 0,1(0,4 – 0,1)(0,8 – 0,2)2 = 0,0108 моль/(л·с).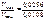 = 2,37,
= 2,37, = 0,0256 моль/(л∙с).
= 0,0256 моль/(л∙с). = 48кДж/моль
= 48кДж/моль
 =
=  ;
;
 =
=  1,09,
где 103 – коэффициент пересчета килоджоулей в
джоули, тогда
1,09,
где 103 – коэффициент пересчета килоджоулей в
джоули, тогда
 =101,09 = 12,3 раза.
=101,09 = 12,3 раза.
 –?
б)
–?
б) 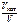 –?
–?
 =
= 
 2,103,
2,103, = 101,03= 127.
= 101,03= 127. ,
, = 982,6 K.
= 982,6 K.
 .
.
 = 100 г
π = 618,5 кПа
ρр-ра = 1 г/см3
= 100 г
π = 618,5 кПа
ρр-ра = 1 г/см3
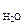 )/ρр-ра, см3.
V р-ра =
)/ρр-ра, см3.
V р-ра =  102,3 см3 = 0,102 л.
102,3 см3 = 0,102 л.
 , моль/л,
, моль/л, ∙ R ∙ T, кПа;
∙ R ∙ T, кПа; = 90,33 г/моль.
= 90,33 г/моль. ;
;

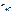 – число Н+, образовавшихся при диссоциации одной молекулы НСl,
– число Н+, образовавшихся при диссоциации одной молекулы НСl, = 1, тогда
= 1, тогда  = c
= c  = 0,02 моль/л = 2 · 10-2 моль/л.
= 0,02 моль/л = 2 · 10-2 моль/л. ,
, = c
= c 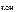 · α · n
· α · n  ,
, = 1, тогда c
= 1, тогда c 


