Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Состав и свойства газовых гидратовСодержание книги
Поиск на нашем сайте
Газовые гидраты – это твердые растворы, растворителем которых является кристаллическая решетка состоящая из молекул воды. Внутри воды размещаются молекулы «растворенного газа», размеры которых определяют возможность образования гидратов только из метана, этана, пропана и изобутана. Для образования газовых гидратов необходимы низкие температуры и давления, сочетания которых возможно в пластовых условиях лишь в районах развития мощной толщи многолетней мерзлоты. По различным оценкам, запасы земных углеводородов в гидратах составляют от 1,8·105 до 7,6·109 км³. Сейчас природные газовые гидраты приковывают особое внимание как возможный источник ископаемого топлива, а также участник изменений климата.
Образование газовых гидратов
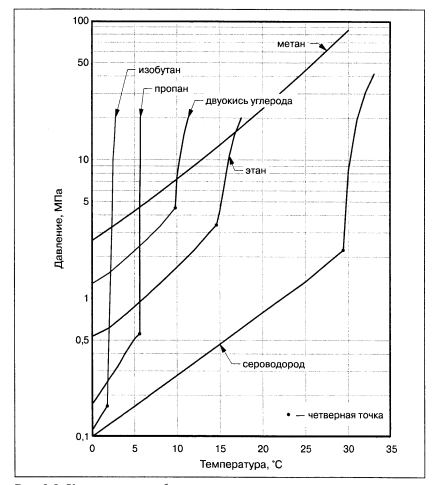
Газовые гидраты подразделяются на техногенные (искусственные) и природные (естественные). Все известные газы при определенных давлениях и температурах образуют кристаллогидраты, структура которых зависит от состава газа, давления и температуры. Гидраты могут стабильно существовать в широком диапазоне давлений и температур. Например, гидрат метана существует при давлениях от 2*10-8 до 2*103 MPa и температурах от 70 до 350 K. Некоторые свойства гидратов уникальны. Например, один объем воды при переходе в гидратное состояние связывает 207 объемов метана. При этом ее удельный объем возрастает на 26% (при замерзании воды ее удельный объем возрастает на 9%). 1 м3 гидрата метана при P=26 атм и Т=0°С содержит 164 объема газа. При этом на долю газа приходится 0.2 м3, на воду 0,8 м3. Удельный объем метана в гидрате соответствует давлению порядка 1400 атм. Разложение гидрата в замкнутом объеме сопровождается значительным повышением давления. На рисунке 3.1.1 дана диаграмма условий существования гидрата некоторых компонентов природного газа в координатах давление-температура.
Рисунок 3.1.1 - Кривые газо-гидрато-образования для некоторых компонентов природного газа.
Для образования газогидрата необходимы следующие три условия: 1. Благоприятные термобарические условия. Образованию газогидратов благоприятствует сочетание низкой температуры и высокого давления. 2. Наличие гидратообразующего вещества. К гидратообразующим веществам относятся метан, этан, пропан, двуокись углерода и др. 3. Достаточное количество воды. Воды не должно быть ни слишком мало, ни слишком много. Для предотвращения газогидратообразования достаточно исключить одно из трёх условий. Природные газовые гидраты представляют собой метастабильный минерал, образование и разложение которого зависит от температуры, давления, химического состава газа и воды, свойств пористой среды и др. Морфология газогидратов весьма разнообразна. В настоящее время выделяют три основных типа кристаллов: · массивные кристаллы. Формируются за счёт сорбции газа и воды на всей поверхности непрерывно растущего кристалла; · вискерные кристаллы. Возникают при туннельной сорбции молекул к основанию растущего кристалла; · гель-кристаллы. Образуются в объёме воды из растворённого в ней газа при достижении условий гидратообразования. В пластах горных пород гидраты могут быть как распределены в виде микроскопических включений, так и образовывать крупные частицы, вплоть до протяжённых пластов многометровой толщины. Благодаря своей клатратной структуре единичный объём газового гидрата может содержать до 160—180 объёмов чистого газа. Плотность гидрата ниже плотности воды и льда (для гидрата метана около 900 кг/м³). Ускоренному образованию газовых гидратов способствуют следующие явления: · Турбулентность. Образование газовых гидратов активно протекает на участках с высокими скоростями потока среды. При перемешивании газа в трубопроводе, технологическом резервуаре, теплообменнике и т.п. интенсивность газогидратообразования возрастает. · Центры кристаллизации. Центр кристаллизации представляет собой точку, в которой имеются благоприятные условия для фазового превращения, в данном случае – образования твердой фазы из жидкой. · Свободная вода. Наличие свободной воды не является обязательным условием для гидратообразования, однако интенсивность этого процесса в присутствии свободной воды значительно возрастает. Кроме того, поверхность раздела фаз вода-газ является удобным центром кристаллизации для образования газогидратов.
Строение гидратов
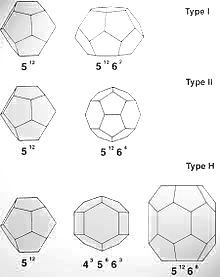
В структуре газогидратов молекулы воды образуют ажурный каркас (то есть решётку хозяина), в котором имеются полости. Установлено, что полости каркаса обычно являются 12- («малые» полости), 14-, 16- и 20-гранниками («большие» полости), немного деформированными относительно идеальной формы. Эти полости могут занимать молекулы газа («молекулы—гости»). Молекулы газа связаны с каркасом воды ван-дер-ваальсовскими связями. В общем виде состав газовых гидратов описывается формулой M·n·H2O, где М — молекула газа-гидрато-образователя, n — число молекул воды, приходящихся на одну включённую молекулу газа, причём n — переменное число, зависящее от типа гидрато-образователя, давления и температуры. Полости, комбинируясь между собой, образуют сплошную структуру различных типов. По принятой классификации они называются КС, ТС, ГС - соответственно кубическая, тетрагональная и гексагональная структура. В природе наиболее часто встречаются гидраты типов КС-I (англ. sI), КС-II (англ. sII), в то время как остальные являются метастабильными.
Таблица 3.2.1 - Некоторые структуры клатратных каркасов газовых гидратов.
Рисунок 3.2.1 - Кристаллические модификации газогидратов. При повышении температуры и уменьшении давления гидрат разлагается на газ и воду с поглощением большого количества теплоты. Разложение гидрата в замкнутом объёме либо в пористой среде (естественные условия) приводит к значительному повышению давления. Кристаллогидраты обладают высоким электрическим сопротивлением, хорошо проводят звук, и практически непроницаемы для свободных молекул воды и газа. Для них характерна аномально низкая теплопроводность (для гидрата метана при 273 К в пять раз ниже, чем у льда). Для описания термодинамических свойств гидратов в настоящее время широко используется теория Ван-дер-Ваальса - Платтеу. Основные положения данной теории: · решётка хозяина не деформируется в зависимости от степени заполнения молекулами-гостями либо от их вида; · в каждой молекулярной полости может находиться не более одной молекулы-гостя; · взаимодействие молекул-гостей пренебрежимо мало; · к описанию применима статистическая физика. Несмотря на успешное описание термодинамических характеристик, теория Ван-дер-Ваальса - Платтеу противоречит данным некоторых экспериментов. В частности, показано, что молекулы-гости способны определять как симметрию кристаллической решётки гидрата, так и последовательность фазовых переходов гидрата. Помимо того, обнаружено сильное воздействие гостей на молекулы-хозяева, вызывающее повышение наиболее вероятных частот собственных колебаний. Большинство природных газов (CH4, C2H6, C3H8, CO2, N2, H2S, изобутан и т. п.) образуют гидраты, которые существуют при определённых термобарических условиях. Область их существования приурочена к морским донным осадкам и к областям многолетнемёрзлых пород. Преобладающими природными газовыми гидратами являются гидраты метана и диоксида углерода. При добыче газа гидраты могут образовываться в стволах скважин, промышленных коммуникациях и магистральных газопроводах. Отлагаясь на стенках труб, гидраты резко уменьшают их пропускную способность. Для борьбы с образованием гидратов на газовых промыслах вводят в скважины и трубопроводы различные ингибиторы(метиловый спирт, гликоли, 30%-ный раствор CaCl2), а также поддерживают температуру потока газа выше температуры гидратообразования с помощью подогревателей, теплоизоляцией трубопроводов и подбором режима эксплуатации, обеспечивающего максимальную температуру газового потока. Для предупреждения гидратообразования в магистральных газопроводах наиболее эффективна газоосушка — очистка газа от паров воды.
Состав и свойства воды
Около 71 % поверхности Земли покрыто водой (океаны, моря, озёра, реки, льды) — 361,13 млн км2. На Земле примерно 96,5 % воды приходится на океаны, 1,7 % мировых запасов составляют грунтовые воды, ещё 1,7 % — ледники и ледяные шапки Антарктиды и Гренландии, небольшая часть находится в реках, озёрах и болотах, и 0,001 % в облаках (образуются из взвешенных в воздухе частиц льда и жидкой воды). Бо́льшая часть земной воды — солёная, непригодная для сельского хозяйства и питья. Доля пресной составляет около 2,5 %, причём 98,8 % этой воды находится в ледниках и грунтовых водах. Менее 0,3 % всей пресной воды содержится в реках, озёрах и атмосфере, и ещё меньшее количество (0,003 %) находится в живых организмах. Исключительно важна роль воды в возникновении и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды. Вода является важнейшим веществом для всех живых существ на планете Земля.
Химический состав воды
Вода (оксид водорода) — бинарное неорганическое соединение с химической формулой Н2O. Молекула воды состоит из двух атомов водорода и одного — кислорода, которые соединены между собой ковалентной связью. При нормальных условиях представляет собой прозрачную жидкость, не имеет цвета (в малом объёме), запаха и вкуса. В твёрдом состоянии называется льдом (кристаллы льда могут образовывать снег или иней), а в газообразном — водяным паром. Вода также может существовать в виде жидких кристаллов (на гидрофильных поверхностях). Составляет приблизительно около 0,05 массы Земли. Состав воды можно выяснить с помощью реакции разложения электрическим током. Образуется два объема водорода на один объем кислорода (объем газа пропорционален количеству вещества): 2H2O = 2H2↑ + O2↑ Вода состоит из молекул. Каждая молекула содержит два атома водорода, соединенные ковалентными связями с одним атомом кислорода. Угол между связями около 105º.
|
|||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-25; просмотров: 5191; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.116.86.160 (0.009 с.) |