
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Общие сведения и краткие методические указанияСодержание книги Поиск на нашем сайте
Л И Ч Н А Я К Н И Ж К А студента I курса дневного отделения ПЛАНЫ УЧЕБНЫХ ЗАНЯТИЙ II семестра Учебного года
Москва 2012
Личная книжка студента 1 курса дневного отделения. Планы учебных занятий II семестра 2011/2012 учебного года / РХТУ им.Д.И.Менделеева. М., 2012, 52 с.
©Российский химико-технологический университет им.Д.И.Менделеева,2012 МАТЕМАТИКА МАТЕМАТИЧЕСКИЙ АНАЛИЗ Библиографический список 1. Письменный Д.В. «Сборник задач по высшей математике»,1 курс (часть 1) «Сборник задач по высшей математике», 2 курс (часть 2), Москва, изд. «Айрис», 2010г.
ЛЕКЦИИ
СЕМИНАРЫ
ХИМИЯ ЭЛЕМЕНТОВ М е т о д и ч е с к и е у к а з а н и я Учебные занятия по курсу «Химия элементов» состоят из лекций, лабораторных работ и домашней работы. В курсе «Химия элементов» на базе полученных в первом семестре сведений об основах химической термодинамики, основах химии растворов и основах строения вещества рассматриваются свойства s-, p-, d-, f- элементов и их соединений, изучаются способы получения наиболее широко применяемых веществ и их свойства. На лабораторных занятиях студенты приобретают навыки решения конкретных задач и закрепляют свои знания наиболее важных разделов курса. При подготовке к лабораторным занятиям студент должен проработать соответствующие разделы курса по конспекту лекций и учебникам [1] [2] [3][4] из библиографического списка (страницы приведены в соответствующем разделе «Лекции») и решить задачи, указанные в домашнем задании. При подготовке к лабораторным работам в лабораторном журнале следует написать: 1) название лабораторной работы и дату ее выполнения; 2) цель лабораторной работы; 3) схему установки или прибора; 4) порядок выполнения работы; 5) уравнения реакций; 6) схему протокола работы. При недостаточной подготовке и (или) невыполнении домашней работы студент к лабораторной работе не допускается. В начале некоторых занятий проводится контроль текущей успеваемости студентов (15-20 мин) по теме занятия. Суммарный рейтинговый балл за семестр по курсу «Химия элементов» (максимально 60 баллов) составляется из баллов, полученных за: а) три рубежные контрольные работы – максимально 36 баллов; б) выполнение и защита лабораторных работ – от 10 до 15 баллов; в) домашние работы – максимально 9 баллов (выставляемых в конце семестра). Изучение курса “Химия элементов” завершается экзаменом (максимально 40 баллов). До экзамена не допускаются студенты: а) не выполнившие лабораторный практикум, б) набравшие в семестре менее 35 баллов. Библиографический список. 1. Карапетьянц М.Х., Дракин С.И. Общая и неорганическая химия. М.: Химия, 1981.- 630 с. 2. Карапетьянц М.Х., Дракин С.И. Общая и неорганическая химия. М.: Химия, 1992-2004.-592с. 3. Соловьев С.Н. Начала химии. Химия элементов и их соединений (часть 1). М.: РХТУ им. Д.И.Менделеева, 2011 г.- 148 с. 4. Соловьев С.Н. Начала химии. Химия элементов и их соединений (часть 2). М.: РХТУ им. Д.И.Менделеева, 2011 г.- 78 с. 5. Практикум по неорганической химии /Под ред. А.Ф. Воробьева и С.И. Дракина. М.: Химия, 1984.-246 с. 6. Задания для программированного контроля по неорганической химии (для студентов дневного отделения) / Под ред. А.Ф. Воробьева; М.:МХТИ им. Д.И. Менделеева, 1987. -48 с. «3460» 7. Задания к курсовой работе по курсу “Неорганическая химия” / Под. ред. 8. Задания к курсовой работе по курсу “Теоретические основы химии” / Под. ред. 9. В.А.Василёв, Ю.Л.Супоницкий. Методы сравнительного расчета в курсе общей и неорганической химии; М.: МХТИ им. Д.И. Менделеева, 2009.- 57 с. ЛЕКЦИИ Лекция 1. s - элементы. Общая характеристика элементов группы 1; нахождение в природе, получение. Сравнение химической активности щелочных металлов. Гидриды, оксиды, пероксиды, надпероксиды, озониды; химическая связь в этих соединениях, их свойства. Гидроксиды, их получение и свойства. Общая характеристика солей. Понятие об аммиачном способе получения соды. Применение металлов и соединений. Общая характеристика элементов группы 2; нахождение в природе, получение и свойства, применение. Гидриды, оксиды, гидроксиды, получение и свойства, применение. Общая характеристика солей, их растворимость, гидролиз. Применение соединений. Представление о вяжущих веществах. Закономерности изменения свойств металлов и однотипных соединений в ряду бериллий - радий. Токсичность соединений бериллия. [1] - с.295-326, [2] - с.315-342, [3] – с.4-35. Лекции 2 – 3. Группа 13 (р - элементы) Общая характеристика элементов группы. Характерные степени окисления элементов и отвечающие им типы соединений. А. Бор. Общая характеристика, нахождение в природе, получение, свойства, применение. Бориды, их получение и свойства. Бороводороды, их получение, строение и свойства. Борогидриды металлов. Оксид бора и борные кислоты, строение и свойства; бораты. Химия водных растворов. Галогениды бора, тетрафторобораты, строение, свойства, получение. Нитрид бора, строение и свойства. Применение соединений бора; их токсичность. Б. Алюминий. Общая характеристика, нахождение в природе, свойства, получение и применение. Оксид, оксогидроксид и гидроксид, строение, получение и свойства. Общая характеристика солей алюминия, их растворимость, гидролиз. Химия водных растворов, гидролиз. Квасцы. Гидрид алюминия, алюмогидриды металлов. Применение соединений алюминия. Токсикология. В. Галлий, Индий, Таллий. Общая характеристика, нахождение в природе, понятие о получении; свойства, применение. Оксиды и гидроксиды, получение и свойства. Соединение типа А В. Соединения таллия (1). Применение соединений галлия, индия, таллия. Токсичность соединений. Сопоставление свойств простых веществ и однотипных соединений бора, алюминия, галлия, индия и таллия. [1] - с.326-351, [2] - с.342-362, [3] – с.36-54. Лекции 4 – 5. Группа 14 (р - элементы) Общая характеристика группы. Степени окисления элементов и типы соединений. Понятие о гомоцепных и гетероцепных неорганических полимерах. А. Углерод. Общая характеристика, нахождение в природе. Аллотропные модификации углерода, строение и свойства. Получение искусственных алмазов. Активированный уголь, его адсорбционные свойства. Углеграфитовые материалы. Стеклоуглерод. Соединения внедрения графита. Химические свойства углерода. Карбиды, их получение, строение и классификация. Оксиды углерода (11, 1У), строение, свойства, получение. Оксид-дихлорид углерода. Карбамид, строение, свойства, получение. Угольная кислота и ее соли. Цианид водорода и цианиды металлов; их получение и свойства. Цианид-ион как лиганд. Цианидные комплексы металлов. Тиоцианаты. Применение углерода и его неорганических соединений. Б. Кремний. Общая характеристика, нахождение в природе, получение, свойства, применение. Диоксид, строение и свойства. Кварцевое стекло. Силикагель. Силикаты и алюмосиликаты, понятие о их типах. Природные и искусственные цеолиты. Виды стекла и керамики, получение и свойства. Водородные соединения кремния; получение и свойства. Силициды металлов. Нитрид кремния. Применение соединений кремния. В. Германий, олово, свинец. Общая характеристика, нахождение в природе, получение, свойства. Характер изменения строения и свойств простых веществ в ряду углерод - свинец. Водородные соединения германия. Оксиды и гидроксиды, их амфотерность. Химия водных растворов. Германаты (II, IV), станнаты (II, IV), плюмбаты (II, IV). Сульфиды, их свойства. Общая характеристика солей, их растворимость. Сравнение окислительно-восстановительных свойств однотипных соединений. Применение германия, олова, свинца и их соединений. [1] - с.351-392, [2] - с.362-395, [3] – с.54-79. Лекции 6 – 8. Группа 15 (р - элементы) Общая характеристика. Степени окисления элементов и типы соединений. А. Азот. Общая характеристика и нахождение в природе. Строение молекулярного азота и его свойства, получение. Проблема связанного азота и пути ее решения. Нитрогенильные комплексы. Водородные соединения. Аммиак, строение молекулы, получение и свойства Жидкий аммиак как растворитель. Соли аммония, их свойства. Аммиак как лиганд. Амминокомплексы металлов. Амиды, имиды, нитриды, их взаимодействие с водой. Гидроксиламин, строение молекулы, свойства и получение. Гидразин, получение, строение, свойства. Азотоводородная кислота, получение, строение и свойства. Азиды металлов. Оксиды азота, их получение, строение и свойства. Влияние на окружающую среду оксидов азота. Кислородосодержащие кислоты. Азотистая кислота, ее строение и свойства. Нитриты, их свойства. Азотная кислота, получение, строение и свойства, взаимодействие с металлами и неметаллами, зависимость окислительных свойств от концентрации. Нитраты, их термическая устойчивость, окислительная активность. Соединения нитрозила и нитроила. Применение азота и его соединений. Азотные удобрения. Б. Фосфор. Общая характеристика, нахождение в природе. Красный, белый, черный фосфор. Их получение, строение и свойства. Токсичность белого фосфора. Водородные соединения фосфора, их получение, строение и свойства. Производные фосфония. Фосфиды металлов. Оксиды фосфора (III, V); получение, строение, свойства. Фосфорные кислоты получение, строение и свойства. Триоксогидрофосфат (III) водорода, диоксодигидрофосфат (I) водорода - строение, свойства и получение. Галогениды фосфора, получение, строение, свойства, гидролиз. Оксохлорид фосфора. Применение фосфора и его соединений. Фосфорные удобрения. В. Мышьяк, сурьма, висмут. Общая характеристика, нахождение в природе, получение, свойства. Сравнение свойств аммиака, фосфина, арсина, стибина и висмутина. Получение арсина. Арсениды и стибиды. Оксиды. Кислоты мышьяка и сурьмы, их получение и свойства. Сравнение строения и свойств галогенидов азота, фосфора, мышьяка, сурьмы и висмута. Их гидролиз. Соли антимонила и висмутила. Сульфиды, их отношение к кислотам и к раствору сульфида аммония. Сравнение окислительно-восстановительных свойств однотипных соединений р-элементов У группы. Применение мышьяка, сурьмы, висмута и их соединений. Токсичность производных мышьяка, сурьмы, висмута. [1] - с.392-435, [2] - с.395-430, [3] – с.79-112. Лекции 9 – 10. Группа 16 (р - элементы) Общая характеристика. Степени окисления элементов и типы соединений. А. Кислород. Общая характеристика, нахождение в природе, получение и свойства. Строение молекулы. Озон, его получение, строение, свойства. Фториды кислорода. Диоксигенильные соединения. Вода. Квазикристаллическая структура. Структура льда. Свойства воды как растворителя. Жесткость воды. Характер изменения кислотно-основных свойств в ряду оксидов s- и р-элементов данного периода. Пероксид водорода, его получение, строение. Кислотные, окислительные и восстановительные свойства. Пероксиды металлов. Применение кислорода и его соединений. Б. Сера, Селен, Теллур. Общая характеристика, нахождение в природе, получение и свойства. Аллотропия серы, селена и теллура. Сравнение строения и свойств простых веществ в ряду кислород - полоний. Сульфаны. Сероводород, получение, строение, свойства. Сульфиды, методы их получения и свойства. Растворимость и гидролиз сульфидов, их отношение к кислотам. Полисульфиды. Селениды и теллуриды. Диоксиды, их строение, получение и свойства. Влияние на окружающую среду промышленных выбросов диоксида серы. Триоксид серы, получение, строение и свойства. Кислородосодержащие кислоты серы и их соли. Сульфиты, их окислительно-восстановительные свойства. Серная кислота, получение, строение, свойства. Взаимодействие серной кислоты с металлами и неметаллами. Дегидратирующее действие серной кислоты. Соли серной кислоты, их свойства; квасцы. Дисерная кислота. Тиосерная кислота, тиосульфат натрия, получение, строение и свойства. Пероксодисерная кислота, строение, свойства, получение. Соединения серы с галогенами, их получение, свойства и строение. Хлорсульфоновая кислота, получение, строение и свойства. Применение серы, селена, теллура и их соединений. Токсичность соединений. [1] - с.435-462, [2] - с.430-452, [3] – с.112-127. Лекция 11. Группа 6 (d - элементы) Общая характеристика. Степени окисления элементов. Нахождение элементов в природе. Получение простых веществ, их свойства. Строение и свойства карбонилов. Химия водных растворов; аква- и гидроксокомплексы хрома (III), кристаллогидраты, гидратная изомерия, квасцы. Типы и строение комплексных соединений хрома (III). Оксид хрома (VI), хромата, дихроматы (VI), их получение и свойства. Влияние степени окисления хрома на кислотно-основные и окислительно-восстановительные свойства его соединений. Характеристика соединений молибдена и вольфрама; их общность и различие с однотипными соединениями хрома. Применение хрома, молибдена, вольфрама и их соединений. Токсичность соединений хрома. Биологическая роль соединений молибдена. [1] - с.527-544, [2] - с.507-521, [4] – с.26-35. Лекция 12. Группа 7 (d - элементы) Общая характеристика. Степени окисления элементов. Нахождение элементов в природе. Получение, свойства простых веществ. Карбонилы марганца. Соединения марганца (II), их получение, свойства. Диоксид марганца. Манганаты, получение и свойства. Перманганаты, получение и свойства. Оксид марганца (VII) и марганцовая кислота. Влияние среды на направление окислительно-восстановительных реакций с участием соединений марганца. Характеристика соединений технеция и рения и сравнение их свойств со свойствами соединений марганца. Применение марганца, технеция, рения и их соединений. [1] - с.544-554, [2] - с.521-529, [4] – с.35-41. Лекция 13. Группы 8, 9, 10 (d - элементы) Строение атомов и деление элементов на подгруппы и семейства. Семейство железа. Общая характеристика. Нахождение элементов в природе. Получение простых веществ. Чугун, сталь. Коррозия железа. Сравнение химической активности. Карбонильные соединения металлов. Соединения железа. Влияние степени окисления железа на кислотно-основные и окислительно-восстановительные свойства его соединений. Комплексные соединения железа, их строение. Сравнение свойств однотипных соединений железа, кобальта и никеля. Соединения железа, кобальта в биологических процессах. Применение железа, кобальта, никеля и их соединений. Семейство платины. Общая характеристика, нахождение элементов в природе. Получение и свойства платиновых металлов. Степени окисления и координационные числа атомов и ионов платиновых металлов. Типы соединений; их кислотно-основные и окислительно-восстановительные свойства. Комплексные соединения. [1] - с.554-581, [2] - с.529-551, [4] – с.42-55. Лекция 14. Группы 11,12 (d - элементы) Общая характеристика. Степени окисления элементов. Нахождение их в природе. Получение и свойства металлов. Влияние комплексообразования на их химическую активность в водных растворах. Соединения с кислородом, серой и галогенами. Соли, их растворимость, гидролиз. Комплексные соединения. Применение элементов и их соединений. Биологическая роль соединений меди, их токсичность. Токсичность ртути, кадмия и их соединений. Цинк как биоэлемент. [1] - с.581-602, [2] - с.551-569, [4] – с.56-70.
Лекция 15. f – элементы Лантаноиды. Общая характеристика химических свойств, понятие о методах получения и разделения этих металлов. Кислотно-основные свойства оксидов и гидроксидов элементов (ΙΙΙ), гидролиз солей. Актиноиды. Сопоставление химических свойств актиноидов со свойствами лантаноидов. Оксид и гидроксид тория (ΙV), соединения с галогенами, их химические свойства. Кислородные соединения и галогениды урана, соли уранила, уранаты. Применение лантаноидов, актиноидов и их соединений. [1] - с.602-611, [2] - с.569-577, [4] – с.71-75. Лекции 16 – 17. Группы 17 и 18 (р - элементы) О месте водорода в периодической системе. Общая характеристика элемента, нахождение в природе, получение и свойства. Гидриды, их классификация. Общая характеристика водородных соединений неметаллов. Применение водорода и его соединений. Водородная энергетика. Общая характеристика галогенов. Степени окисления элементов. Нахождение в природе. Простые вещества, их строение и свойства, методы получения. Отношение галогенов к воде и растворам щелочей. Водородные соединения галогенов, их получение и свойства. Ассоциация молекул фторида водорода. Дифториды калия и натрия. Восстановительные свойства галогеноводородных кислот и их солей. Оксиды хлора и иода, их получение, структура и свойства. Кислородсодержащие кислоты хлора, брома, иода; способы получения, структура и свойства. Соли кислородсодержащих кислот. Сопоставление кислотных и окислительных свойств кислородсодержащих кислот и их солей. Применение галогенов и их соединений. Общая характеристика благородных газов. Нахождение элементов в природе. Получение, свойства и применение простых веществ. Фториды, оксофториды, оксиды ксенона; строение, свойства и получение. Производные кислородсодержащих кислот ксенона. Понятие о других соединениях благородных газов. Применение благородных газов и их соединений. [1] - с.462-490, [2] - с.452-476, [3] – с.127-145.
ЛАБОРАТОРНЫЕ РАБОТЫ Работа 1. В часы лабораторной работы проводится семинар на тему «Равновесие диссоциации комплексных соединений; решение задач с использованием величин Куст (β) комплексов и ПР» Работа 2. Определение карбонатной жесткости воды. Домашнее задание: [5] - с.133. Работа 3. Щелочные, щелочноземельные металлы и магний. Домашнее задание: [5] - с.127-130; [6] - с.4-7. Работа 4. Бор и алюминий. Домашнее задание: [5] - с.136-143; [6] - с.7-11. Работа 5. Углерод и кремний. Семинар – подготовка к рубежной контрольной работе. Домашнее задание: [5] - с.148-154; [6] - с.11-15. Работа 6. Рубежная контрольная работа. Сдача лабораторных работ. Работа 7. Олово и свинец. Домашнее задание: [5] - с.148-154; [6] - с.11-15. Работа 8. Азот. Домашнее задание: [5] - с.160-165; [6] - с.15-19. Работа 9. Фосфор, сурьма, висмут. Домашнее задание: [5] - с.172-179; [6] - с.19-22. Работа 10. Сера, селен, теллур. Семинар – подготовка к рубежной контрольной работе. Домашнее задание: [5] - с.184-189; [6] - с.22-26. Работа 11. Рубежная контрольная работа. Сдача лабораторных работ. Работа 12. Хром, молибден, вольфрам. Домашнее задание: [5] - с.210-214; [6] - с.29-33. Работа 13. Марганец, железо, кобальт, никель. Домашнее задание: [5] - с.218-222; [6] - с.33-37. Работа 14. Медь, серебро. Семинар – подготовка к рубежной контрольной работе. Домашнее задание: [5] - с.226-230; [6] - с.37-41. Работа 15. Рубежная контрольная работа. Сдача лабораторных работ. Работа 16. Цинк, кадмий, ртуть. Домашнее задание: [5] - с.234-238; [6] - с.41-44. Работа 17. Итоговое занятие. ФИЗИКА ЛЕКЦИИ Лекция 1. Предмет физики. Роль курса физики в химико-технологическом вузе. Предмет кинематики. Система отсчета. Векторная и координатная формы описания движения материальной точки. Перемещение, скорость, ускорение. Кинематическое уравнение равноускоренного движения. Кинематика движения по криволинейной траектории. Нормальное, тангенциальное и полное ускорения. Вращательное движение твердого тела. Кинематические характеристики вращательного движения (угловое перемещение, угловая скорость, угловое ускорение) и их связи с соответствующими линейными характеристиками. Частота вращения. Лекция 2. Предмет динамики. Инерциальные системы отсчета. Первый закон Ньютона. Масса. Сила. Второй закон Ньютона. Третий закон Ньютона и закон сохранения импульса. Понятие о фундаментальных силах. Силы в механике. Закон всемирного тяготения. Гравитационные силы. Силы упругости. Закон Гука. Силы трения. Эмпирические законы сухого и вязкого трения. Движение тела под действием переменной силы. Движение тела переменной массы. Уравнения Мещерского. Формула Циолковского. Лекция 3. Работа постоянной и переменной силы. Мощность. Энергия. Консервативные силы. Центральные силы и их консервативный характер. Кинетическая энергия. Потенциальная энергия. Связь силы с изменением потенциальной энергии. Закон сохранения энергии в природе. Закон сохранения механической энергии в поле консервативных сил. Понятие о внутренней энергии. Упругий и неупругий удары шаров. Лекция 4. Вращательное движение твердого тела относительно неподвижной оси. Момент силы и момент импульса относительно оси. Основной закон динамики вращательного движения. Момент инерции материальной точки и твердого тела. Теорема Штейнера. Кинетическая энергия тела, вращающегося относительно неподвижной оси. Закон сохранения момента импульса механической системы. Понятие о моменте силы и моменте импульса относительно точки. Жесткий ротатор как модель двухатомной молекулы. Приведенная масса. Приведенный момент инерции. Лекция 5. Кинематика гармонических колебаний. Амплитуда, угловая частота и фаза гармонических колебаний. Скорость и ускорение при гармонических колебаниях. Векторная диаграмма. Сложение колебаний одного направления и одинаковой частоты. Сложение взаимно перпендикулярных колебаний. Динамика гармонических колебаний. Дифференциальное уравнение гармонических колебаний. Энергия гармонических колебаний. Примеры свободных колебательных систем: пружинный маятник, математический маятник, физический маятник. Двухатомная молекула как линейный гармонический осциллятор. Лекция 6. Понятие о затухающих и вынужденных колебаниях. Дифференциальное уравнение затухающих колебаний. Зависимость амплитуды колебаний от времени. Коэффициент затухания. Логарифмический декремент затухания. Вынужденные колебания. Дифференциальное уравнение вынужденных колебаний. Зависимость амплитуды вынужденных колебаний от частоты изменения вынуждающей силы. Механический резонанс. Резонансная частота. Резонансная амплитуда. Лекция 7. Волновое движение. Волны продольные и поперечные. Волновая поверхность. Фронт волны. Плоская и сферическая волна. Скорость распространения колебаний в среде. Уравнение плоской бегущей волны. Длина волны. Волновое число. Графическое изображение волны. Дифференциальное волновое уравнение. Понятие о фазовой и групповой скорости. Энергия, переносимая волной. Поток энергии. Плотность потока энергии. Принцип суперпозиции волн. Стоячая волна. Узлы и пучности стоячей волны. Лекция 8. Предмет молекулярной физики. Статистический и термодинамический методы. Основные положения молекулярно-кинетической теории. Размеры и сечение столкновения молекул. Число столкновений и средняя длина свободного пробега молекул. Их зависимости от давления температуры и размеров молекул. Число Ван-дер-Ваальса. Идеальный газ. Основное уравнение молекулярно-кинетической теории идеального газа. Идеальный газ в силовом поле. Распределение Больцмана и его общефизический смысл. Барометрическая формула. Случайные величины и их описание. Функция распределения. Связь функции распределения с вероятностью. Условия нормировки. Средние значения. Понятие о флуктуациях. Распределение Максвелла. Функция распределения молекул по абсолютным значениям скорости. Вероятнейшая, средняя арифметическая и средняя квадратичная скорости молекул. Число ударов молекул о стенку. Распределение молекул по кинетическим энергиям их поступательного движения. Графики функций распределения молекул идеального газа по абсолютным значениям скоростей и кинетическим энергиям их поступательного движения. Лекция 9. Термодинамический метод в физике. Параметры, характеризующие состояние макросистемы: объем, давление, температура, число молекул или количество вещества. Равновесные состояния. Нулевое начало термодинамики. Внутренняя энергия. Количество теплоты. Работа, совершаемая термодинамической системой. Теплоемкость системы. Удельная и молярная теплоемкости. Число степеней свободы. Равномерное распределение энергии по степеням свободы. Внутренняя энергия идеального газа. Первое начало термодинамики и его применение к изопроцессам в идеальных газах. Адиабатный процесс. Уравнение адиабаты. Связь показателя адиабаты с числом степеней свободы. Понятие о политропном процессе. Понятие о равновесных процессах. Обратимые и необратимые процессы. Циклы. Цикл Карно. Второе начало термодинамики. Понятие об энтропии и её статистическое толкование. Возрастание энтропии при необратимых процессах. Лекция 10. Предмет физической кинетики. Явления переноса. Перенос энергии, импульса и массы на молекулярном уровне. Число столкновений и средняя длина свободного пробега молекул идеального газа (вывод). Диффузия. Закон Фика. Коэффициент молекулярной диффузии. Теплопроводность. Закон Фурье. Коэффициент теплопроводности идеального газа. Внутреннее трение (вязкость). Закон Ньютона. Коэффициент динамической вязкости. Связь коэффициентов теплопроводности, вязкости и диффузии идеального газа и их зависимости от давления, температуры и размеров молекул. Особенности явлений переноса в ультраразреженных газах. Тепловое движение молекул в жидкости. Время оседлой жизни молекул. Диффузия в жидкости. Зависимость коэффициента диффузии от температуры. Вязкость жидкости. Зависимость коэффициента вязкости от температуры. Лекция 11. Реальный газ. Понятие о ван-дер-ваальсовых силах. Уравнение Ван-дер-Ваальса. Фазовая диаграмма жидкость-газ. Фазовые переходы. Насыщенный пар. Метастабильные состояния. Критическое состояние. Критические параметры. Общие свойства жидкостей и газов. Идеальная жидкость. Стационарное течение идеальной жидкости. Уравнение Бернулли. Лекция 12. Предмет электростатики. Электрический заряд. Закон Кулона. Диэлектрическая проницаемость. Напряженность и потенциал электростатического поля. Принцип суперпозиции электрических полей. Связь потенциала с напряженностью. Электрические силовые линии и эквипотенциальные поверхности. Поток вектора напряженности электрического поля. Теорема Остроградского-Гаусса и применение её к расчету электрических полей,обладающих симметрией. Лекция 13. Работа сил электростатического поля. Циркуляция вектора напряженности. Проводники в электростатическом поле. Электростатическая защита. Электроемкость уединенного проводника и конденсатора. Энергия заряженного конденсатора. Объемная плотность энергии электростатического поля. Энергия системы взаимодействующих электрических зарядов. Лекция 14. Диполь. Потенциал и напряженность поля точечного диполя. Действие внешнего однородного электростатического поля на диполь (механический момент сил, действующих на диполь, и потенциальная энергия диполя). Действие неоднородного электростатического поля на диполь. Лекция 15. Диэлектрики в электростатическом поле. Полярные и неполярные молекулы. Поляризация диэлектриков. Электрическое поле в однородном диэлектрике (среднее макроскопическое поле). Поляризованность. Диэлектрическая восприимчивость и связь её с диэлектрической проницаемостью диэлектрика. Деформационная (электронная, атомная) и ориентационная механизмы поляризации. Понятие о локальном электрическом поле. Поляризуемость молекулы. Формулы Клаузиуса-Мосотти, Дебая-Ланжевена и Лоренц-Лоренца. Лекция 16. Постоянный электрический ток. Условия существования тока. Сила и плотность тока. Связь плотности тока с зарядом, концентрацией носителей заряда и средней скоростью их направленного движения. Законы Ома и Джоуля-Ленца в интегральной и дифференциальной формах. Электродвижущая сила источника тока. Лекция 17. Обзорная. СЕМИНАРЫ Семинар 1. Некоторые сведения о системе единиц. Порядок решения физических задач. Кинематика. Векторная и координатная формы описания движения материальной точки. Кинематические уравнения движения. Криволинейное движение. Нормальное и тангенциальное ускорения. Кинематические характеристики вращательного движения.
На сем. 1. Решение задач (ауд.): § 1 (20,23,27,47,54).
Семинар 2. Динамика. Второй закон Ньютона. Движение тела под действием переменной силы. Движение тела переменной массы. Закон сохранения импульса. Неупругое и упругое столкновение шаров.. К сем. 2. Решения задач (дома): § 1 (27,43,56); § 2 (3,12,27,81,82). На сем 2. Решение задач (ауд): § 2 (13,29,36).
Семинар 3. Закон всемирного тяготения. Закон Гука. Силы трения. К сем. 3. Решение задач (дома): § 2 (6,9); § 4 (5). На сем 3. Решение задач (ауд): § 4 (10,47).
Семинар 17. Итоговый. К последнему (итоговому) семинару студент должен представить преподавателю, ведущему семинарские занятия, маршрутный лист с оценкой (в баллах) за проделанные лабораторные работы и тетради с контрольными работами и со всеми решенными домашними задачами в соответствии с учебным планом. Решение задач должно быть аккуратно записано и содержать: 1) Рисунок (чертеж, график, схему), поясняющие физическое содержание задачи; 2) Решение задачи в общем виде (т.е. в буквенном выражении); 3) Проверку единиц измерения в полученном выражении; 4) Перевод в единицы СИ величин, заданных в условии задачи; 5) Расчетную формулу с подставленными числовыми значениями физических величин, промежуточными вычислениями (детали вычислений) и числовой ответ, содержащий, как правило, три значащие цифры с указанием единиц измерения. Ответ должен быть записан как в стандартной форме, так и с использованием (если это возможно) кратных и д
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 173; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.255.170 (0.016 с.) |

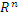 : определение, его множества. Функции нескольких переменных: определение, область определения, область значений, линии и поверхности уровня, предел в точке. Непрерывность, точки разрыва.
: определение, его множества. Функции нескольких переменных: определение, область определения, область значений, линии и поверхности уровня, предел в точке. Непрерывность, точки разрыва.



